diferența dintre legături duble și Triple simple
diferența principală – legături simple vs duble vs Triple
legăturile chimice țin atomii dintr-o moleculă împreună prin stabilirea forțelor între electronii și nucleele a doi atomi. Reacțiile chimice sunt guvernate de stabilirea sau ruperea legăturilor chimice. Există diferite tipuri de legături, cum ar fi covalent, ionic, van der Waal etc. Proprietățile legăturilor variază în funcție de diferite aspecte, cum ar fi natura moleculei, tipul solid (cristalin sau amorf) etc. Legăturile covalente se formează prin împărțirea a doi sau mai mulți electroni. Numărul de electroni împărțiți între atomi determină numărul de legături; indiferent dacă este simplu, dublu sau triplu. Prin urmare, legăturile simple, duble și triple sunt legături covalente. Principala diferență între o singură legătură dublă și triplă este numărul de electroni împărțiți. Dacă numărul partajat este o pereche de electroni, legătura va fi o singură legătură, în timp ce dacă doi atomi legați de două perechi (patru electroni), va forma o dublă legătură. Legăturile Triple se formează prin împărțirea a trei perechi (șase atomi) de electroni. Acești electroni de partajare sunt cunoscuți în mod obișnuit ca electroni de valență. Acest articol se va uita la,
1. Ce este o singură legătură?
– definiție, proprietăți, Exemple
2. Ce este o legătură dublă?
– definiție, proprietăți, Exemple
3. Ce este o legătură triplă?
– definiție, proprietăți, Exemple
4. Care este diferența dintre obligațiunile simple duble și Triple?
ce este o singură legătură
o singură legătură se formează prin împărțirea unei perechi de electroni de valență între doi atomi adiacenți. O singură legătură este cea mai simplă formă a unei legături covalente, unde fiecare atom furnizează un electron de valență. Acești electroni de valență sunt localizați în învelișul exterior al atomilor. Aici, electronii încărcați negativ sunt atrași de nucleele încărcate pozitiv ale atomilor. Aceste forțe de tragere țin atomii împreună. Acest aranjament este cunoscut ca o singură legătură. Moleculele cu legături simple sunt mai puțin reactive spre deosebire de moleculele cu legături multiple. Mai mult, ele sunt mai slabe decât legăturile multiple și au lungimi de legătură mai mari datorită forței de tragere scăzute între atomi în comparație cu legăturile multiple. O singură legătură este notată doar cu o singură liniuță; ex: C C. alcani precum metanul, etanul, propanul sunt câteva exemple pentru compușii cu legături simple.
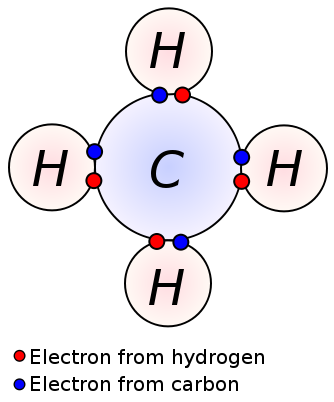
Metan
ce este o legătură dublă
o legătură dublă se formează prin împărțirea a două perechi de electroni de valență localizați în orbita cea mai exterioară a atomilor. Compușii cu legături duble sunt foarte reactivi decât compușii cu o singură legătură, dar mai puțin reactivi decât compușii cu legături triple. Legăturile duble sunt notate cu două liniuțe paralele; ex: C=C. Câteva exemple de compuși cu legături duble includ alchene precum etilenă, propenă, compuși carbonilici (c=o), compuși azoici (N=N), imine (C=N) și sulfoxizi (s=o).
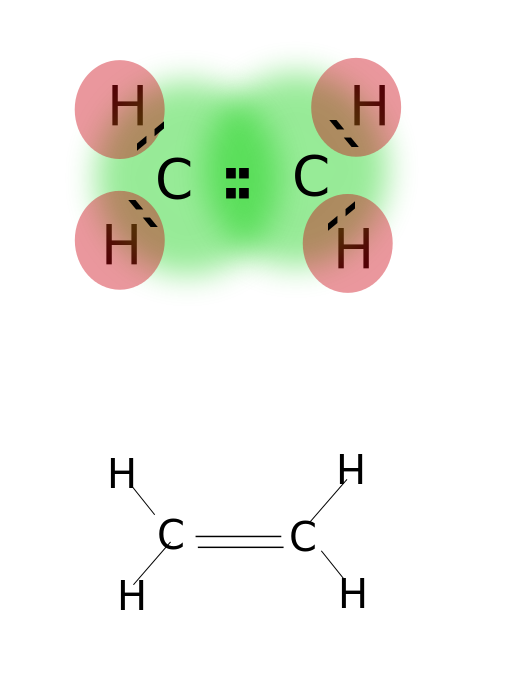
etilenă
ce este o legătură triplă
când doi atomi împărtășesc trei perechi de electroni de valență (șase electroni de valență), legăturile stabilite se numesc legături triple. Legăturile Triple sunt cele mai puternice și cele mai reactive legături covalente. În comparație cu legăturile simple și duble, legăturile triple au cea mai mică lungime a legăturii datorită forței de tragere mai mari dintre doi atomi. O legătură triplă este notată prin trei liniuțe paralele între doi atomi; ex: C-C-C. Câteva exemple de compuși cu legături triple includ azotul gazos (N-C-N), ionul cianură (C-C-N), acetilena (ch-c-c-ch) și monoxidul de carbon (C-C-C-N).
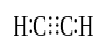
acetilenă
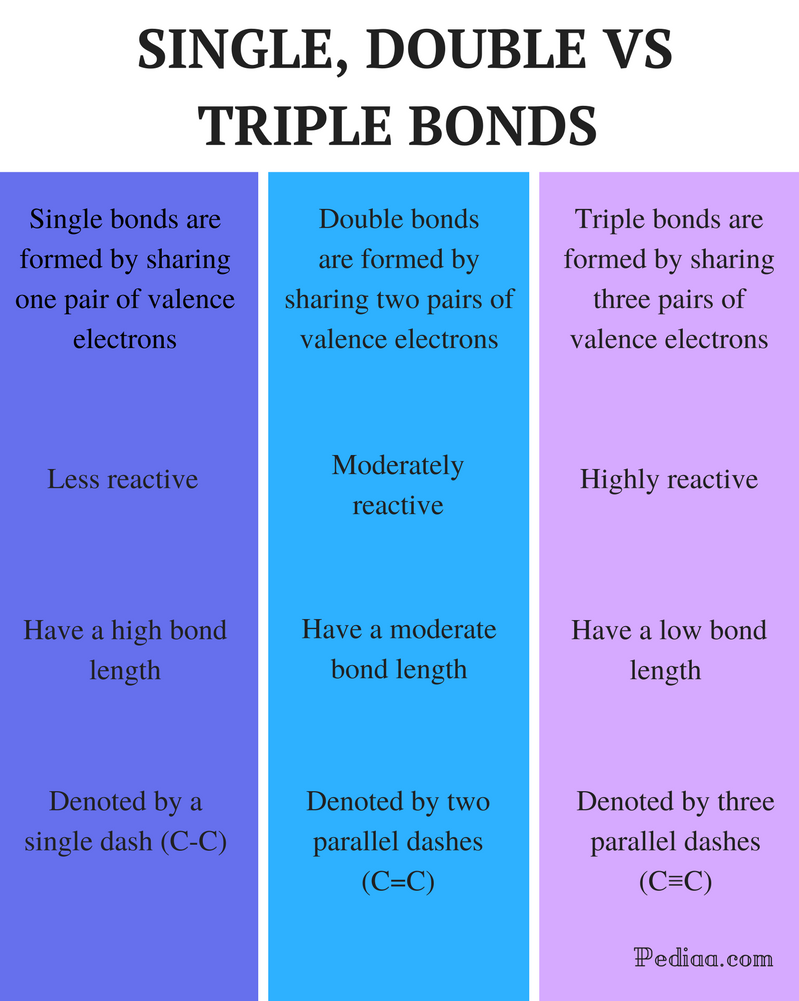
diferența dintre legături duble și Triple simple
definiție:
legătură unică: O singură legătură se formează prin împărțirea unei perechi de electroni de valență.
legătură dublă: o legătură dublă se formează prin împărțirea a două perechi de electroni de valență.
legătură triplă: o legătură triplă se formează prin împărțirea a trei perechi de electroni de valență.
reactivitate:
legătură unică: legăturile simple sunt mai puțin reactive.
legătură dublă: legăturile duble sunt moderat reactive.
legătură triplă: legăturile Triple sunt foarte reactive.
lungimea legăturii:
legătura unică: legăturile simple au o lungime Mare a legăturii.
legătură dublă: legăturile duble au o lungime moderată a legăturii.
legătură triplă: Legăturile Triple au o rezistență scăzută a legăturilor.
notat cu:
legătură unică: legăturile simple sunt notate cu o singură liniuță (C-C).
legătură dublă: legăturile duble sunt notate cu două liniuțe paralele (C=C).
legătură triplă: legăturile Triple sunt notate cu trei liniuțe paralele (c).
Exemple:
legătură unică: Exemplele includ alcani precum metan, etan, propan, butan etc.
legătură dublă: Exemplele includ etilenă, propenă, compuși carbonilici (C=o), compuși azoici (N=N), imine (C=N) și sulfoxizi (s=o).
legătură triplă: Printre exemple se numără azotul gazos (N.C. N.), ionul cianură (C. C. N.), acetilena (CH. C. C.) și monoxidul de carbon (C. C. C. O.).
![]()
Leave a Reply