7.2: Chymotrypsin
introduktion
Chymotrypsin är ett av de mest studerade enzymerna på grund av dess tvåfaskinetik: Pre-steady-state och steady state. Studien av dessa två kinetiska tillstånd ger bevis på” Ping-Pong ” – mekanismen, bildandet av kovalenta komplex som leder till kovalenta hydrolysreaktioner och hastigheten för de katalyserade reaktionerna. Syntes av chymotrypsin förekommer främst i bukspottkörteln. Istället för den aktiva formen produceras den emellertid som en inaktiv zymogen som kallas chymotrypsinogen för att förhindra att dess proteasaktivitet smälter bukspottkörteln. Vid utsöndring i tunntarmens lumen omvandlas den till sin aktiva form av ett annat enzym som kallas trypsin. Detta beroende av ett annat enzym för aktivering av ett proteas är ett vanligt sätt för kroppen att förhindra uppslutning av organ och andra skadliga enzymatiska biverkningar.
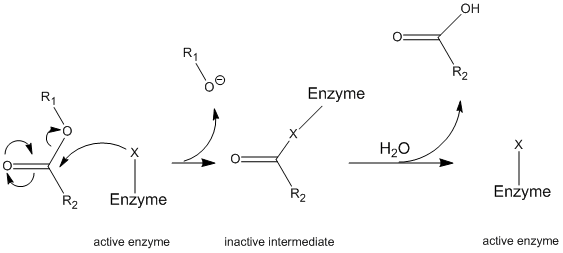
Chymotrypsin verkar genom en allmän mekanism som kallas ping-pong-mekanismen (figur \(\PageIndex{1}\)) där enzymet reagerar med ett substrat för att bilda en enzymintermediär. Denna mellanprodukt har olika egenskaper än det ursprungliga enzymet, så för att regenerera den initiala enzymatiska aktiviteten måste den reagera med ett sekundärt substrat. Denna process illustreras nedan:

Mer specifikt fungerar chymotrypsin genom en viss typ av ping-pong mekanism som kallas kovalent hydrolys. Detta innebär att enzymet först bildar en kovalent bindning med målsubstratet och förskjuter den mer stabila delen till lösning. Detta enzym-substratkomplex kallas enzymet mellanliggande. Mellanprodukten reagerar sedan med vatten, vilket förskjuter den återstående delen av det ursprungliga substratet och reformerar det ursprungliga enzymet.
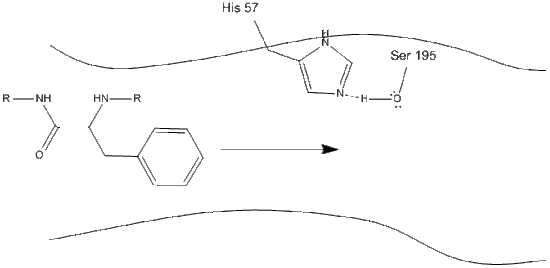
Chymotrypsin, som de flesta enzymer, är specifik i de typer av substrat som den reagerar med. Som ett proteas klyver det polypeptider, och dess inneboende specificitet gör det möjligt att endast verka på karboxiterminalen av aromatiska rester. Det är en något komplicerad mekanism, och förklaras bäst i en serie steg.
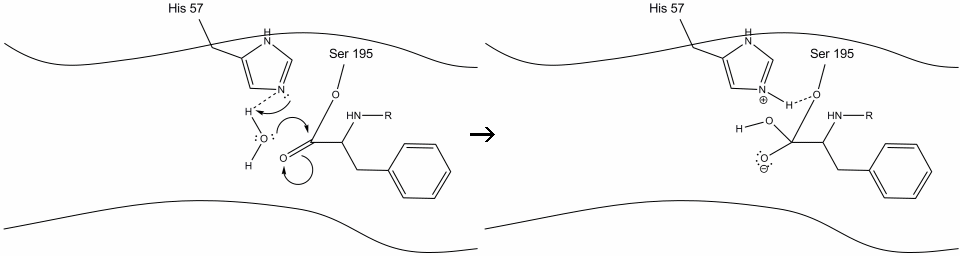
1. Målet går in i den aktiva platsen för chymotrypsin, och det hålls där av hydrofoba interaktioner mellan exponerade icke-polära grupper av enzymrester och substratets icke-polära aromatiska sidokedja. Det är viktigt att notera vätebindningen mellan Schiff-kvävet på histidin-57 och syresidokedjan serin-195.
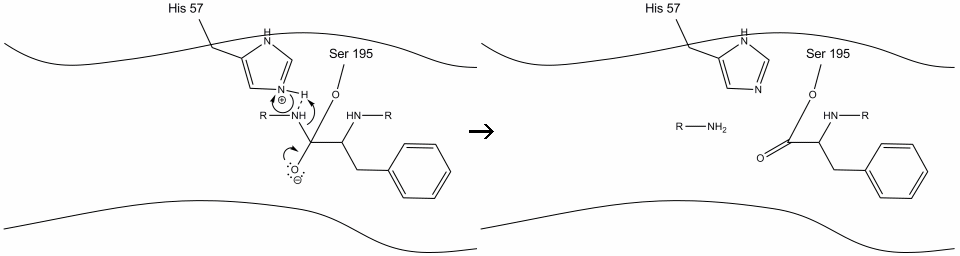
2. Med hjälp av histidin-serin-vätebindningen utför hydroxylgruppen på serin-195 en nukleofil attack på karbonylkolet i en aromatisk aminosyra samtidigt som hydroxylvätet överförs till histidin Schiff-kvävet. Denna attack skjuter pi-karbonylelektronerna på karbonylsyret och bildar en kortlivad intermediär bestående av ett c-terminal kol med fyra enkelbindningar: en syreanjon, beta-kolet i den aromatiska aminosyran, N-terminalen för den efterföljande aminosyran i substratproteinet och serin-195 sidokedja syre.
.gif?revision=1&size=bestfit&width=720&height=192)
3. Denna mellanprodukt är kortlivad, eftersom oxyanionelektronerna reformerar pi-bindningen med C-terminalen för den aromatiska aminosyran. Bindningen mellan karboxiterminalen för den aromatiska aminosyran och N-terminalen för den efterföljande återstoden klyvs och dess elektroner används för att extrahera väte från det protonerade Schiff-kvävet på histidin-57. Bindningarna mellan karbonylkolet och serin-195-syret förblir i en esterkonfiguration. Detta kallas acyl-enzym intermediär. Den C-terminala sidan av polypeptiden är nu fri att dissociera från enzymets aktiva plats.
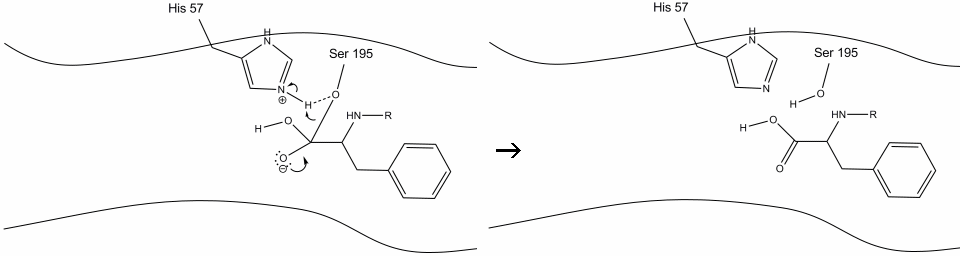
4. Vattenmolekyler kan nu komma in och binda till aktiv plats genom vätebindning mellan väteatomerna i vatten och histidin-57 Schiff kväve.
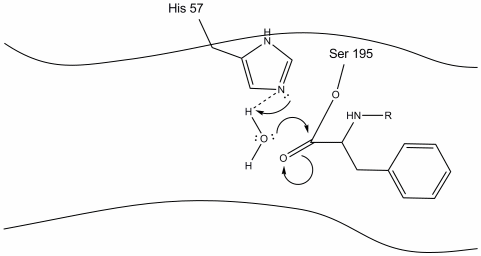
5. Vattensyret gör nu en nukleofil attack på karbonylkolet i acyl-enzymet mellanprodukt, vilket pressar karbonylens pi-elektroner på karbonylkolet när histidin-57 extraherar en proton från vatten. Detta bildar ett annat kvaternärt kol kovalent bundet med serin, en hydroxyl, en oxyanion och den aromatiska aminosyran. Protonen på den nyligen protonerade histidin-57 kan nu göra en vätebindning med serinsyret.
6. Oxyanionelektronerna reformerar karbonylpi-bindningen och klyver bindningen mellan karbonylkolet och serinhydroxylen. Elektronerna i denna bindning används av serin syre för att deprotonera histidin Schiff kväve och reformera det ursprungliga enzymet. Substratet har inte längre affinitet för den aktiva platsen, och det skiljer sig snart från komplexet.
Leave a Reply