Fosfofruktokinas (PFK)
innehåll
- 1 Introduktion
- 2 roll i glykolys
- 3 mekanism och reglering av fosfofruktokinas
- 4 reglering
- 5 konformationsförändringar i en Dimerisk enhet av PFK
- 6 De viktigaste Konformationsförändringarna i en subenhet av PFK.
- 7 Platsstyrd mutagenes
- 8 sjukdom
- 9 3D-strukturer av PFK
introduktion
fosfofruktokinas-1 (PFK-1) är ett glykolytiskt enzym som katalyserar överföringen av en fosforylgrupp från till till utbyte och . Se Glykolysenzymer. Mg2 + är också viktigt i denna reaktion (). Fosfofruktokinas-2 (PFK-2) verkar på samma substrat för att ge ADP och . . PFK-reaktionen är starkt exergonisk (irreversibel) under fysiologiska förhållanden och är därför en av den glykolytiska vägens hastighetsbestämmande steg. I de flesta organismer/vävnader är PFK den glykolytiska vägens huvudsakliga flussreglerande enzym; dess aktivitet styrs av koncentrationerna av ett ovanligt stort antal metaboliter inklusive ATP, ADP, AMP, PEP och fruktos-2,6-bisfosfat.
är en tetramer av identiska 320-restsubenheter. Det är ett allosteriskt enzym som beskrivs med hjälp av symmetrimodellen för allosterism där det finns en samordnad övergång från dess högaktivitets r-tillstånd till dess Lågaktivitetstillstånd t-tillstånd. Röntgenstrukturerna för både r-och T-tillstånd i enzymet har rapporterats. Bindningen av en molekyl av dess substrat F6P, som binder till r-tillståndsenzymet med hög affinitet men till t-tillståndsenzymet med låg affinitet, får PFK att ta upp R-tillståndet, vilket i sin tur ökar bindningsaffiniteten hos enzymet för ytterligare F6P (en homotropisk effekt). Aktivatorer, såsom ADP och AMP binder till så kallade allosteriska platser, bindningsställen som skiljer sig från det aktiva stället, där de också underlättar bildandet av R-tillståndet och därmed aktiverar enzymet (en heterotropisk effekt; ADP, som är en produkt av PFK-reaktionen, binder också vid enzymets aktiva ställe). På liknande sätt binder hämmare såsom PEP till allosteriska platser (som i fallet med PFK överlappar det aktiverande allosteriska stället) där de främjar bildandet av T-tillståndet och därigenom hämmar enzymet.
två av de aktiva platserna för enzymet är belägna vid gränssnittet för med de aktiva platsgränssnitten i magenta med substraten i cyan. Två mer aktiva platser finns i gränssnittet för underenheter B (grön) och C (rosa). En närbild av underenheten d (gul) visar att aminosyror från båda underenheterna a (ljusblå) och D (gul) bidrar till bindningen av F6P. två av de allosteriska platserna är belägna vid gränssnittet till och två vid gränssnittet för underenheterna C och D. igen är gränssnitten magenta med den allosteriska liganden i cyan. En närbild av underenheten A visar bidrag från båda underenheterna till bindningen av ADP. De konformationella förändringarna i att gå mellan R – och T-tillstånden i PFK illustreras nedan.
atomkoordinaterna för R state PFK erhölls från 4pfk; de för t state PFK erhölls från Philip Evans, MRC Laboratory of Molecular Biology, Cambridge, Storbritannien men är nu tillgängliga som 6pfk.
roll i glykolys
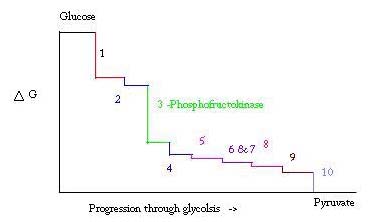
glykolys är processen för att förbereda och bryta ner glukos för att göra pyruvsyra, som används vid anaerob andning eller som en av startreaktanterna i citronsyracykeln. Tre punkter i glykolysprocessen uppträder med en stor negativ fri energi och är därför irreversibla. Dessa tre punkter är hexokinas, fosfofruktokinas och pyruvatkinas; av dessa tre PFK anses vara den viktigaste regleringspunkten för glykolys i muskler med en KUBG= -25,9 kJ/mol.
mekanism och reglering av fosfofruktokinas
fosfofruktokinas binder både Mg2+-ATP och fruktos-6-fosfat (F6P) för att göra fruktos-1,6-bisfosfat och Mg2+-ADP. Även om bilden med båda dessa produkter inte har bestämts har bundet till enzymet varit. Det finns tre ligandbindningsställen per underenhet. Två utgör den aktiva platsen, som binder F6P och ATP, medan den tredje är en allosterisk bindningsplats. Några föreslagna rester som är involverade på den aktiva platsen inkluderar . PFK finns i två konformationella tillstånd, båda och som är i jämvikt. ATP binder både aktiva och allosteriska platser i båda konformationerna. Medan ATP binder den aktiva platsen lika bra, binder den företrädesvis den allosteriska platsen i t-tillståndet. denna preferensbindning orsakar en förskjutning från jämvikt mellan de två tillstånden, till en större mängd t-tillstånd , vilket minskar affiniteten för F6P. binder också till allosterisk plats för att öka förhållandet mellan r-tillståndsfofruktokinas. Tillsammans med ADP,AMP och F2 hämmar 6P ATP: s reglerande roll. PFK: s Km för ATP är .020mM och .032mm.
reglering
glykolys är en väsentlig metabolisk process för överlevnad. Därför måste det i sin aktivering och undertryckning vara starkt reglerat. Tre punkter i glykolysprocessen uppträder med en stor negativ fri energi och är därför irreversibla. Dessa tre punkter är hexokinas, fosfofruktokinas och pyruvatkinas. Dessa tre reaktioner är kandidater för att vara de viktigaste punkterna i reglering på grund av deras höga negativa fria energier. Av de tre anses PFK vara den viktigaste regleringspunkten för glykolys (#3 på bilden nedan) i muscle, med en UBIG= -25.9 kJ/mol, eftersom det är ett engagerat steg. När PFK konverterar F6P till F1, 6P, kommer reaktionen inte lätt att vändas på grund av den höga mängden energi som måste övervinnas för att gå bakåt. . Denna energibarriär är meningsfull eftersom pyruvatkinas katalyserar den slutliga reaktionen (#10) och hexokinas (#1) inte är involverad i glykolys alls när processen påbörjas från glykogen.
PFK regleras av ATP, AMP och ADP. Medan ATP binder vid det aktiva stället lika bra i både R – och T-tillstånd, binder det företrädesvis allosteriskt ställe i t-tillståndet. denna preferensbindning orsakar en övergång från jämvikt mellan de två tillstånden, till en större mängd t-tillstånd , vilket minskar affiniteten för F6P.allosterisk aktivator ADP binder också till allosteriskt ställe för att öka förhållandet mellan r-tillståndsfofruktokinas. Som framgår av diagrammet nedan är tomterna för aktiviteten hos PFK sigmoidala. Detta visar vidare enzymets kooperativa natur. Den initiala bindningen av substrat till enzymet är svårt, men när det är bundet och tvingar förändringen i tillstånd från T -> r, binder de andra substraten mycket lättare. Grafen visar också att tillsats av ATP flyttar tomten åt höger (dvs minskar affiniteten för F6P), medan tillsats av AMP flyttar den till vänster.
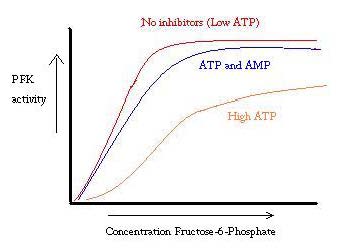
regleringssystemet matchar väl med PFK: s funktion. När PFK är aktiv produceras ATP nedströms från det eftersom ytterligare produkter bryts ner mer fullständigt. Således, när ATP-nivåerna är låga och mer behöver göras, kommer aktiviteten hos PFK att ökas, eftersom ADP kommer att vara i hög koncentration. Det motsatta gäller också, eftersom hög ATP-koncentration hämmar proteinaktivitet. Och ändå kan denna förklaring inte helt redogöra för regleringen av PFK, eftersom nivåerna av ATP inte varierar tillräckligt mycket mellan aktiva och vilande muskler. Ett annat sätt för allosterisk reglering måste hittas.
PFK: s Km för ATP är .020mM och .032mM.
denna Kinemage övning består av två kinemage scener som illustrerar några av de allosteriskt inducerade konformationsförändringar som uppstår i PFK från Bacillus stearothermophilus.
konformationella förändringar i en Dimerisk enhet av PFK
denna kinemage visar de två underenheterna i tetramer vars gränssnitt Innehåller två aktiva platser. (KineMage stöds för närvarande inte)den första vyn, 1: PFK dimer, visar de två underenheterna i deras r-tillståndskonformation som representeras av deras Ca-ryggrad med underenhet 1 i rosa nyans och underenhet 2 i rosa. Två sidokedjor i varje underenhet visas, de av Glu 161 (röd) och Arg 162(cyan), som är en del av F6P-bindningsstället i T-och R-tillstånden, srespektivt (se nedan). En F6P (hotpink) och en ADP (grön; ”ADP-aktiv”) är bundna på den aktiva platsen för varje underenhet. En ytterligare ADP (gul; ”ADP-allo”) är bunden i en separat så kallad allosterisk plats för varje underenhet. ADP: erna har vardera en associerad Mg2+, som representeras här av en boll av samma färg som ADP som den binder till.
klicka på knappen ”animera” för att växla dimeren mellan dess r-och T-tillstånd. I sitt t-tillstånd är underenhet 1 bluetint och underenhet 2 är skyblue. Sidokedjorna i Glu 161 och Arg 162 i båda underenheterna är röda och cyan som tidigare (endast CA-och Cb-atomerna i Arg 162-sidokedjan i underenhet 1 observeras i Röntgenstrukturen i t-tillståndet; de av underenhet 2 observeras alla). T-tillståndsenzymet binder inhibitorn 2-fosfoglykolat (guld; ”PGC”), en icke-fysiologisk analog av det glykolytiska mellanliggande fosfoenolpyruvatet (PEP). Observera att bindningsstället för PGC i t-tillståndet överlappar ADP: s allosteriska bindningsställe i r-tillståndet (”ADP-allo”) och därmed deras bindning är ömsesidigt uteslutande. De T-Statliga aktiva platserna, som inte innehåller F6P, är markerade med” ghost”F6Ps (grå;” F6P-plats”), som har samma positioner som F6Ps i r-tillståndsenzymet.
den andra vyn, 2: Allo / Act-platser, är en närbild av den övre delen av den första vyn som visar både den aktiva platsen och den allosteriska platsen i denna region. Observera att den aktiva platsen är belägen vid gränssnittet mellan två underenheter och att den allosteriska platsen interagerar direkt med den aktiva platsen på den intilliggande underenheten. Jämför r-tillstånds-och t-tillståndskonformationerna genom att visa båda samtidigt eller klicka på ”animera”. Kan du identifiera MG2 + – Jonen associerad med var och en av ADP: erna bundna till enzymet i r-tillståndet? Vilka ADP-atomer koordinerar dessa MG2 + joner?
fosfatgruppen av PGC binder till den allosteriska platsen i t-tillståndet i mycket nästan samma position som betafosfatgruppen av ”ADP-allo” binder till r-tillståndsallosteriska platsen; båda fosfatgrupperna binder till sidokedjorna av samma tre rester (2 arg och 1 Lys; visas inte).
i högaktivitetstillståndet r bildar den positivt laddade sidokedjan Arg 162 en vätebunden saltbrygga med den negativt laddade 6-fosfatgruppen F6P (vita streckade linjer), en interaktion som förmodligen stabiliserar r-tillståndet relativt t-tillståndet och är därför delvis ansvarig för F6PS homotropa effekt.
de stora konformationella förändringarna i en underenhet av PFK.
denna KINEMAGE visar dessa segment nära den allosteriska platsen (rester 53-60 visas inte här). Liksom i KINEMAGE 1 representeras polypeptiden av dess Ca-kedja med R-Tillståndsunderenheter 1 och 2 i redtint och rosa, och T-Tillståndsunderenheter 1 och 2 i bluetint och skyblue. (KineMage stöds för närvarande inte)KINEMAGE 2 kommer upp i vy 1: Den allosteriska platsen, i r-tillståndet som visar fosfatgruppen av F6P (hotpink) bunden i enzymets aktiva plats i en vätebunden saltbro (streckade vita linjer) med sidokedjan Arg 162 (cyan). En ADP (gul; ”ADP-allo”) upptar den intilliggande allosteriska platsen. Klicka en gång på” animera ” för att växla till t-tillståndet. Detta ersätter ADP i r-tillståndet allosteriskt ställe med inhibitorn och PEP analog PGC (guld). F6P upptar inte längre den aktiva platsen men dess position i r-tillståndet indikeras av ”ghost” F6P (grå; visad genom att klicka på ”F6P-webbplats”).
vad händer med det centrala polypeptidhelikala segmentet (rester 149-164) i r till T-övergången? Vad gör detta med de relativa positionerna för den negativt laddade Glu 161 och den positivt laddade Arg 162? Klicka på ”F6P-webbplats”. Vilket inflytande skulle frånvaron av den positiva laddningen av Arg 162 ha på bindningen av F6P? Förklarar detta, åtminstone delvis, varför T state PFK har låg affinitet för F6P? Gå till visa 2: Närbild, för en närbild av F6P-sidechain-interaktionerna. Centrera molekylerna genom att välja ”pickcenter” från menyn ”Verktyg” och klicka på atomen du vill vara i mitten. Skjut reglaget ”zoom” för att förstora vyn.
Platsstyrd mutagenes
vid en tidpunkt ansågs den negativa laddningen av Glu 161 ha en negativ effekt på F6P-bindning i t-tillståndet. Den här tanken har inte stödts av platsstyrda mutagenesexperiment. Flera mutanta pfks har gjorts, inklusive R162A, E161A och R162A/E161A. r162a-mutationen orsakade en 30-faldig minskning av F6P-bindningen. E161a-mutationen hade emellertid liten effekt på PEP: s förmåga att hämma F6P-bindning.
sjukdom
ärftlig erytrocyt PFK-brist är associerad med myopati och hemolys (Tarui-sjukdom).
3D-strukturer av PFK
fosfofruktokinas 3D-strukturer
Leave a Reply