gränser i farmakologi
introduktion
liposomer är en typ av nanokarrier som har undersökts allmänt för läkemedelsleveransändamål. De består av fosfolipidbilayers som omsluter ett distinkt vattenhaltigt utrymme, vilket möjliggör inkapsling av både hydrofila och hydrofoba föreningar (Metselaar och Storm, 2005). Liposomer kan stabilisera terapeutiska föreningar och övervinna hinder för cellulärt och vävnadsupptag (Ding et al., 2006; Hua och Wu, 2013). Detta gör det möjligt för dem att förbättra inriktningen av föreningar till sjukdomsplatser och därmed minska ackumuleringen i icke-målorgan (Bakker-Woudenberg et al., 1994; Mastrobattista et al., 1999; Hua, 2013; Hua et al., 2015; Sercombe et al., 2015; Zununi Vahed et al., 2017). Det finns fyra huvudtyper av liposomer baserat på deras ytegenskaper – konventionella liposomer, pegylerade liposomer, ligandinriktade liposomer och theranostiska liposomer (Figur 1; Sercombe et al., 2015). Ligandinriktade liposomer ger potentialen för platsspecifik leverans av läkemedel till vissa vävnader eller organ som selektivt uttrycker den riktade liganden (Willis och Forssen, 1998; Bendas, 2001; Sawant och Torchilin, 2012), medan pegylerade liposomer ger steriskt hinder för att förbättra cirkulationshalveringstiden för leveranssystemet efter systemisk administrering (Torchilin, 1994; Wang et al., 2015). Liposomer som innehåller en kombination av de olika leveransplattformarna kan ytterligare förbättra leveransen av inkapslade föreningar, beroende på administreringsväg och sjukdomsställe.
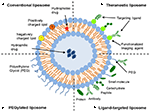
figur 1. Schematisk representation av de olika typerna av liposomala läkemedelsleveranssystem – (a) konventionell liposom, (B) pegylerad liposom, (C) Ligandinriktad liposom och (D) Theranostisk liposom (Sercombe et al., 2015).efter tillverkningsprocessen kännetecknas liposomer för att säkerställa homogenitet över ett antal parametrar, inklusive läkemedelsinkapsling, ligandkonjugering, lipidkomposition, ytladdning och morfologiska egenskaper (t.ex. storlek, form och antal lameller) (Kuntsche et al., 2011). Dessa egenskaper är viktiga eftersom de kan ha stor inverkan på liposomernas beteende både in vitro och in vivo (Sawant och Torchilin, 2012; Sercombe et al., 2015). Erkännande och clearance av liposomer av kroppens försvar, inklusive retikuloendotelialsystemet (RES) och adsorption av opsoniner med efterföljande upptag av det mononukleära fagocytiska systemet, är viktiga bidragsgivare till clearance och nedbrytning av liposomer (Senior, 1987; Cullis et al., 1998; Ishida et al., 2001). Därför är det viktigt att kunna bestämma de fysikalisk-kemiska egenskaperna hos tillverkade liposomer för att optimera en formulering för ytterligare translationell utvärdering.
en viktig aspekt i den fysikalisk-kemiska bedömningen av liposomer visualiserar nanopartiklarnas morfologi med mikroskopi. Det finns ett antal tekniker tillgängliga för att avbilda liposomer och andra nanopartiklar som i stort sett kan kategoriseras i ljus -, elektron-eller atomkraftmikroskopi (Bibi et al., 2011). Varje teknik har sina egna fördelar och begränsningar, vilket bör beaktas vid utvärdering av studier på nanopartikelbaserade läkemedelsleveranssystem (Tabell 1). Denna översyn kommer att utvärdera varje bildteknik som används för att bedöma de morfologiska egenskaperna hos liposomer.

tabell 1. Sammanfattning av nuvarande bildtekniker för att karakterisera liposommorfologi.
ljusmikroskopi
ljus eller optisk mikroskopi avser Mikroskop som använder synligt ljus och ett arrangemang av linser för att förstora ett synfält (Murphy och Davidson, 2012c). Grundläggande ljusmikroskopi i sig kan inte ge omfattande information om lipid-dubbelskiktet jämfört med detaljerna som erbjuds av andra mikroskopitekniker. Det kan emellertid användas för att snabbt få en bild av vesiklar med hjälp av grundläggande laboratorieutrustning (Bibi et al., 2011). Denna teknik kan vara särskilt användbar när man samlar in allmän information om storlek, form, homogenitet och grad av aggregering av ett liposomprov (Nallamothu et al., 2006). Ljusmikroskop har en ultimat upplösning av 250 nm (styrd av den minsta diffraktionsbegränsade spotstorleken som kan uppnås av instrumentet) och är som sådan vanligtvis oförmögna att tillhandahålla detaljerad information om strukturerna hos små unilamellära vesiklar (SUV) och blåsans lamellaritet (Bibi et al., 2011). I allmänhet kan ljusmikroskopi endast ge betydande information om jätte unilamellära vesiklar (GUVs), som kan sträcka sig från singel till hundratals mikrometer i diameter (Bagatolli, 2009). Inkorporering av fluorescerande sonder, polarisationstekniker och tillämpning av konfokal mikroskopi med hög upplösning kan ge mer information om blåsans 3D-struktur och lamellaritet (Bagatolli, 2009).
polarisationsmikroskopi
denna typ av ljusmikroskopi utnyttjar den unika förmågan hos polariserat ljus att interagera med polariserbara bindningar av ordnade molekyler (Murphy och Davidson, 2012d). Förbättrad ljusabsorption uppstår när molekylära dipoler i provet är inriktade med polarisationsvektorn för den infallande ljusvågen; vilket resulterar i fasskillnader mellan provtagningsljusstrålar, vilket i sin tur ger interferensberoende förändringar i amplitud i bildplanet (Murphy och Davidson, 2012d). Bildkontrast uppstår då inte bara från effekterna av störningar och diffraktion utan också på grund av närvaron av ordnade molekylära arrangemang (Murphy och Davidson, 2012d). Det kan användas för att studera formen och dynamiken hos många beställda cellulära strukturer, inklusive lipidbilayers av plasmamembran (Bibi et al., 2011; Murphy och Davidson, 2012d). Bilder kan erhållas i antingen monokrom eller färg. Denna teknik ger en alternativ metod för att visualisera liposomer, särskilt för att bekräfta bildandet av vesiklar. Det ger inte avgörande observationer angående blåsans dubbelskiktsegenskaper eller lamellaritet (Bibi et al., 2011). Dessutom begränsas polarisationsmikroskopi också av storleken på vesiklarna som kan visualiseras, med stora vesiklar i mikrometerområdet som har optimal klarhet. Denna teknik ger inte tydliga bilder av partiklar i nanometerområdet.
fluorescensmikroskopi
fluorescens eller ”epifluorescens” – mikroskopi är en speciell form av ljusmikroskopi som utnyttjar fluorokromas förmåga att avge ljus efter att ha exciterats med ljus av en viss våglängd (Murphy och Davidson, 2012b). Denna teknik används ofta i biofysik för att ge väsentlig information om membrankomponenternas struktur och dynamik (Bouvrais et al., 2010). I dessa studier införlivas fluorescerande sonder specifikt i membranet som undersöks, vilket möjliggör visualisering av strukturen. Ett stort utbud av fluorescerande färgämnen med olika kemiska och fotoniska egenskaper är kommersiellt tillgängliga, catering till en mängd olika forskningsfrågor. Till exempel kan vissa fluorescerande färgämnen föredra specifika membranmiljöer som uppvisar olika arrangemang och lateral packning (Bouvrais et al., 2010). Som sådan möjliggör fluorescensmikroskopi potentialen att samtidigt applicera flera sonder inom ett prov för att ge information om själva membranstrukturen. De fluorescerande sonderna kan placeras i det vattenhaltiga facket såväl som lipidbilayer av liposomer (Bibi et al., 2011). Detta arrangemang kan vara särskilt användbart när man tittar på Guv, där information kan erhållas angående formen, storleken och fluiditeten hos lipidblåsorna (Klymchenko et al., 2009; Bouvrais et al., 2010). Inkorporering av sonder, såsom rhodaminmärkta lipider, direkt i lipid-dubbelskiktet kan också möjliggöra visualisering av lamellariteten hos liposomer (Bibi et al., 2011).
nackdelen med fluorescerande mikroskopi är att tillsatsen av sonder och färgämnen till ett membransystem potentiellt kan störa egenskaperna hos det liposomala leveranssystemet (Bouvrais et al., 2010; Bibi et al., 2011; Murphy och Davidson, 2012b). Användningen av låga färgkoncentrationer (1 mol%) har emellertid visat sig ha minimal inverkan på membranets fysikaliska egenskaper (Bouvrais et al., 2010). Det är också viktigt att notera att valet av fluorescerande färgämne är ett kritiskt steg, eftersom vissa färgämnen kan inducera stora förändringar i värdmembranet och/eller orsaka experimentella artefakter, vilket resulterar i felaktig datatolkning (Bouvrais et al., 2010). Dessutom kan fotoinducerad lipidperoxidation också leda till domänbildning även i enkla färgsystem. Denna process kan resultera i bildandet av stora flottor och spontan fasettbildning (Bouvrais et al., 2010). Långvarig exponering för fluorescerande ljus kan också leda till blekning och förlust av fluorescensintensitet. Därför är valet av fluorescerande färgämne och utvecklingen av nya membranprober viktiga överväganden vid användning av fluorescensmikroskopi (Klymchenko et al., 2009).
konfokal mikroskopi
konfokal skanningsmikroskopi har varit ett framsteg inom området fluorescensmikroskopi. I stället för att belysa hela provet byggs en bild genom att skanna en (eller flera) fokuserade ljusstrålar över provet. Ljus som återvänder från det upplysta provet passerar genom en bländare som avvisar Out-of-focus-ljus ovanifrån och under intresseplanet; se till att endast bilder från ett litet skärpedjup erhålls, vilket förbättrar upplösningen utanför planet (Bibi et al., 2011; Murphy och Davidson, 2012a). Med hjälp av denna teknik samlas en ”z-stack” av bilder, med början från toppen av vesikeln följt av bilder tagna i definierade z-steg till botten av provet, vilket resulterar i en sammansatt 3D-bild av provet (Bibi et al., 2011; Murphy och Davidson, 2012a). Konfokal skanningsmikroskopi har blivit en mer attraktiv teknik över epifluorescerande ljusmikroskop på grund av dess överlägsna bildklarhet. När det gäller GUVs kan denna teknik visualisera lipidsystemens inre struktur, vilket ofta inte är möjligt med andra mikroskopimetoder (Ruozi et al., 2011; Mertins och Dimova, 2013). Till exempel kan separation av vatten-och lipidbilagerfasen tydligt visualiseras i större vesiklar (Mertins och Dimova, 2013). Konfokal mikroskopi är emellertid fortfarande diffraktionsbegränsad och kan därför inte producera högupplösta bilder av SUV eller oligolamellära liposomer (Ruozi et al., 2011).
Elektronmikroskopitekniker
elektronmikroskopi är en metod för visualisering av vesiklar under mycket hög förstoring (Henry, 2005). Det används ofta i karakteriseringen av lipidblåsor som elektronvåglängden (och därmed diffraktionsbegränsad upplösning), är många storleksordningar lägre än den för optisk mikroskopi och ger därför superupplösning för tydlig visualisering av små liposomer (Bibi et al., 2011; Ruozi et al., 2011). Denna teknik använder en stråle av elektroner fokuserade på provets yta av olika elektromagnetiska linser. Elektronerna sprids sedan av provet och fokuseras sedan om och förstoras av en ytterligare serie elektromagnetiska linser i bildkolonnen för att producera en projicerad bild (Henry, 2005). Det finns ett antal olika typer av elektronmikroskop, var och en kräver en annan provberedningsmetod.
Scanningelektronmikroskopi (SEM)
scanningelektronmikroskop (SEMs) använder en elektronstråle som skannas över eller över ett prov (snarare än genom ett prov) för att producera en förstorad bild av ett objekt (Adler och Schiemann, 1985). Alder et al. först försökte använda SEM för att karakterisera liposomer 1984 (Adler och Schiemann, 1985). De visade att användningen av frystorkningsmetoden för att förbereda liposomproverna för SEM resulterade i en stor andel synliga klumpar och crusted material (Adler och Schiemann, 1985). Nyare studier har visat att liposomstrukturen i sig kan drabbas av störningar på grund av de högvakuumförhållanden och färgningsprocesser som krävs för denna beredningsteknik (Ruozi et al., 2011). SEM används nu inte vanligt för att analysera liposomer eftersom det kräver att provet torkas eller fixeras före avbildning (Ruozi et al., 2011). SEM kan emellertid ge allmän information om den koncentriska strukturen hos de olika lipidskikten, samt ge detaljer om preparatets storlek och sfäriska morfologi (Nirale et al., 2009).
transmissionselektronmikroskopi (TEM)
transmissionselektronmikroskopi (TEM) är den mest använda avbildningsmetoden för utvärdering av strukturen hos nanopartiklar (Henry, 2005; Kuntsche et al., 2011). Det handlar om framställning av ett tunt prov (<100 nm tjockt) som placeras i en vakuumkammare. Elektronstrålen korsar provet, där det sedan fokuseras av objektivlinsen för att bilda en bild. TEM kan lätt avbilda mjukmaterialprover med en rumslig upplösning ner till långt under 1 nm i storlek (Henry, 2005; Kuntsche et al., 2011; Ruozi et al., 2011). Denna teknik kan vidare kategoriseras baserat på den använda provberedningsmetoden-i synnerhet negativ färgning, frysfraktur och kryogen TEM. Det kan ge information om ytmodifieringar av nanopartiklar eftersom det ger bättre kontrast och kontur av bilder än andra mikroskopitekniker. Till exempel visade konjugering av transferrin till ytan av dspc/kolesterol liposomer en partikelformig ytbeläggning med negativ fläck TEM, som var frånvarande i de okonjugerade liposompreparaten (Anabousi et al., 2005). I ett separat experiment tillsattes specifika antikroppar som höjdes mot humant transferrin före den negativa fläckproceduren för att bekräfta identiteten hos den partikelformiga ytbeläggningen (Anabousi et al., 2005). Därför ger TEM möjligheten att uppnå mycket förbättrad upplösning vid bedömning av konjugering av ligander till ytan av liposomer.
negativ färgningsteknik
i negativ fläck TEM innebär provberedning att en liten mängd hydratiserat prov placeras på ett rutnät. Eftersom blåsorna är i direkt kontakt med gallret kan deras orientering och morfologi påverkas, och därför bör detta beaktas (Bibi et al., 2011). Det är också nödvändigt att bädda in liposomerna i ett lämpligt elektrontätt material (t. ex., tungmetallsalter som uranylacetat eller fosfotungstiksyra) som ger hög kontrast, så vesiklar kan ses mot en mörkfärgad bakgrund (Ruozi et al., 2011). Den negativa färgningstekniken är relativt snabb och enkel; det har emellertid visat sig orsaka förändringar i den ursprungliga liposomstrukturen och kan leda till skapandet av ljusa och mörka fransar som kan misstas för lamellära strukturer (Bibi et al., 2011; Ruozi et al., 2011). Dessutom kan placering av provet under vakuum orsaka ytterligare uttorkning av provet, vilket igen kan orsaka förändringar i blåsans struktur (Bibi et al., 2011). Medan den negativa fläcken tem-tekniken kan ge mycket högre förstoring för avbildning av nanopartiklar, gör skadorna på liposomstrukturen det svårt att noggrant utvärdera provets morfologiska egenskaper. Därför krävs i allmänhet andra bildtekniker för att bekräfta resultaten.
Frysfrakturteknik
frysfrakturtekniken kräver ingen torkningsprocess och kan ge ytterligare information om nanopartiklarnas interna struktur (Kuntsche et al., 2011). Denna metod innebär att man placerar ett prov på ett tem-rutnät som är inklämt mellan två koppar-eller guldhållare (Severs, 2007). Provet förglasas via snabb frysning, typiskt med flytande propan eller flytande kväve, innan det bryts längs områden av provet med svaga molekylära interaktioner. Denna sprickyta kan etsas ytterligare och skuggas med ett tunt platina-eller kolskikt för att ge en ”negativ” kopia av frakturprovplanet (Severs, 2007; Kuntsche et al., 2011). Repliken rengörs sedan med ett organiskt lösningsmedel för att avlägsna alla rester före visualisering under ett tem-mikroskop. Eftersom dessa replikor är så stabila kan de lagras och ses senare (Kuntsche et al., 2011). Den stora fördelen med denna teknik är att replikerna noggrant återspeglar provets ursprungliga tillstånd och kan ge detaljerad information om 3D-strukturen hos vesiklarna och dubbelskiktsorganisationen (Bibi et al., 2011; Kuntsche et al., 2011). Denna information inkluderar multilamellär konstruktion och dubbelskiktsförpackning av multilamellära vesiklar. Denna teknik kan också bedöma aggregerad storlek och kan vara särskilt användbar för att undersöka interaktionen mellan katjoniska liposomer med DNA (Bibi et al., 2011). Artefakter kan emellertid fortfarande förekomma i provet under beredning på grund av otillräcklig frysningshastighet, återavsättning av lösningsmedelsmolekyler och/eller mekanisk stress (Severs, 2007; Kuntsche et al., 2011). Till exempel kan en” krusande effekt ” uppstå på SUV: erna i provet (Bibi et al., 2011). Detta är en vanlig dubbelskiktsdeformation som beror på en störning i övergångarna av acylkedjorna före frysning. Inkuberande vesiklar mellan förövergången och den faktiska övergångstemperaturen kan också orsaka krusningar (Bibi et al., 2011). Intressant kan detta användas för att ge information i lipidfasövergångarna som uppstår med den varierande naturen hos lipider som används för liposomala preparat (Bibi et al., 2011).
Kryogen TEM
Kryogen TEM (kryo-TEM) är en variation av TEM där tunna vattenhaltiga hydratiserade filmer som förglasas i flytande etan används före avbildning. Denna teknik möjliggör analys av liposomer i deras mest inhemska tillstånd och är ett värdefullt verktyg för att bestämma liposomernas storlek, form, inre struktur och lamellaritet (Weisman et al., 2004; Bibi et al., 2011; Kuntsche et al., 2011). Den stora fördelen med att snabbt frysa liposomprover är att minimera bildandet av iskristaller och bevara proteiner eller andra material (Bibi et al., 2011; Kuntsche et al., 2011). Detta är fördelaktigt där proteiner eller DNA har inkapslats inom nanopartiklarna (Weisman et al., 2004; Kuntsche et al., 2011). Cryo-TEM är den mest användbara formen av mikroskopi som för närvarande är tillgänglig för att studera liposomer, eftersom det undviker problem med kemisk fixering, uttorkning, skärning och färgning – som alla kan påverka vesiklarnas morfologi (Bibi et al., 2011). Upplösningsområdet är 5 till 500 nm, enligt definitionen av filmens tjocklek (Almgren et al., 2000). Flera begränsningar bör dock noteras med denna teknik, inklusive det faktum att endast en 2D-bild erhålls från 3D-objekt (som i allmänhet också gäller för de flesta andra mikroskopitekniker). För att övervinna denna begränsning är rekonstruktion av 3D-former från ett tillräckligt stort antal 2D-bilder av slumpmässigt orienterade icke-sfäriska partiklar möjlig (Orlova et al., 1999), samt att titta på provet i olika lutningsvinklar för att få information om 3D-form (Van Antwerpen och Gilkey, 1994). Kryogen elektrontomografi (cryo-ET) kan också användas istället för att uppnå 3D-bilder (Le Bihan et al., 2009). Cryo-TEM använder också lägre doser av elektroner, vilket innebär att det ofta har en lägre upplösning jämfört med andra metoder (Bibi et al., 2011; Kuntsche et al., 2011). Artefakter är fortfarande möjliga på grund av bildandet av en tunn film av amorf is och användningen av blotting på provet som applicerar skjuvkrafter under filmbildningen (Almgren et al., 2000; Bibi et al., 2011).
Miljöskanningelektronmikroskopi (ESEM)
Miljöskanningelektronmikroskopi (ESEM) är ett bildsystem som inte kräver användning av fixering, färgning eller frysning av vesiklar och kan tillåta avbildning av dynamiska förändringar av våta system utan tidigare provberedning (Muscariello et al., 2005; Ruozi et al., 2011). Huvuddragen hos ESEM är närvaron av vattenånga i mikroskopkammaren. Förmågan att upprätthålla en vattenhaltig atmosfär runt provet som kan vara delvis eller till och med helt hydratiserad möjliggörs genom användning av ett graderat vakuumsystem med flera bländare som gör att bildkammaren kan upprätthållas vid tryck upp till 55 hPa (Bibi et al., 2011; Ruozi et al., 2011). Den primära elektronstrålen kan generera sekundära elektroner som sedan stöter på ångmolekyler, vilket leder till en kaskadförstärkning av signalen innan den når detektorn. På grund av detta kräver ESEM inte provberedning (Muscariello et al., 2005). Denna teknik möjliggör variation i provmiljön genom en serie tryck -, temperatur-och gaskompositioner (Mohammed et al., 2004), vilket är användbart när man bestämmer hur miljöförändringar påverkar blåsorna. Detta är tillämpligt på nanopharmaceutical formulering och stabilitetsstudier (Bibi et al., 2011). ESEM har också använts för att analysera läkemedelsbelastning i dubbelskiktet av liposomer (Mohammed et al., 2004), samt bestämning av blåsans storlek och form. En begränsning av ESEM är att den inte kan ge detaljerad information om lamellaritet och intern arkitektur av nanoskala strukturer (Ruozi et al., 2011).
Atomic Force Microscopy (AFM)
Atomic force microscopy (AFM), även känd som scanning-force microscopy (SFM), är en typ av scanningsondmikroskopteknik. Det fungerar genom att köra en skarp spets fäst vid en cantilever och sensor över ytan av ett prov och mäta ytkrafterna mellan sonden och provet (Sitterberg et al., 2010). Eftersom cantilever löper längs provytan rör den sig upp och ner på grund av ytfunktionerna och cantilever avböjer i enlighet därmed. Denna avböjning kvantifieras vanligtvis med hjälp av en optisk sensor, med laserstrålen reflekterad på baksidan av cantilever på ljusdetektorn (Sitterberg et al., 2010). AFM behöver inte fungera i vakuum och kan fungera i omgivande luft eller under vätska; därför används det alltmer för att avbilda biologiska prover såväl som nanopartiklar (Liang et al., 2004A, B; Ruozi et al., 2005, 2009). AFM har enastående upplösning i ordningen av fraktioner av en nanometer och kan ge en 3D-bild av liposomer tillsammans med detaljer om morfologi, storleksfördelning, homogenitet och stabilitet (Liang et al., 2004A, B; Ruozi et al., 2005, 2007, 2009). Viktigt är att AFM kan användas för att karakterisera ytmodifieringarna av liposomer och detektera ligander (t.ex. antikroppar och polymerer) konjugerade vid liposomalmembranytan (Bendas et al., 1999; Moutardier et al., 2003; Anabousi et al., 2005; Liang et al., 2005). Till exempel Bendas et al. används AFM för att förstora den liposomala membrangränsen och kunde avbilda trimera strukturer, ungefär 8-10 nm i diameter, vilket representerade kopplingen av IgG-antikroppar mot liposomytan (Bendas et al., 1999). Resultaten visade att teknikens effektivitet var starkt beroende av den använda konjugeringsmetoden, med antikroppar konjugerade direkt till liposomalytan synliga med AFM (begränsad proteinmobilitet), i jämförelse med antikroppar fästa vid PEG-kedjor. Det var suggestivt att PEG-kedjorna orsakade hög proteinmobilitet och därför inte kunde skannas (Bendas et al., 1999). Omvänt visade Anabousi et al att införlivandet av pegylerade lipider i liposomerna inducerade en sterisk stabilisering med liposomer som upprätthåller en sfärisk form (Anabousi et al., 2005). AFM-bilder av ytan av okonjugerade liposomer var släta och inga strukturer kunde observeras, medan konjugering av transferrin till ytan av pegylerade liposomer visualiserades som små globulära strukturer (Anabousi et al., 2005). På liknande sätt tillverkade Moutardier et al liposomer med polymera kärnor (LSP) som bestod av läkemedel laddade i polymera partiklar som bildade kärnan i lipidblåsor (Moutardier et al., 2003). Bilder tagna med AFM visade närvaron av ett polymernätverk på den yttre ytan, vilket föreslog att kollagenpolymerkärnan utstrålade och bildade ett ytskikt på LSP (Moutardier et al., 2003). Förutom ytstrukturdetaljer kan AFM ge information om de mekaniska och kemiska egenskaperna hos en provyta genom kraftmätningar (Ruozi et al., 2007). Till exempel Mao et al. används denna teknik för att bedöma elasticitet och adhesiva egenskaper hos liposomer (Mao et al., 2004). En begränsning av AFM är behovet av att nanopartiklar adsorberas på stödytor, såsom glimmer eller kiselskivor. Adsorptionen av liposomer på ett fast substrat har potential att modifiera blåsans storlek och form och orsaka att de plattas ut. (Ruozi et al., 2007). Dessutom kan den periodiska kontakten hos sondspetsen dra liposomerna när den rör sig över vesiklarna i ett prov (Jass et al., 2000). Trots detta är AFM fortfarande ett användbart verktyg vid utvärderingen av liposomer.
slutsats
det finns ett brett utbud av Bildtekniker tillgängliga för utvärdering av liposomernas morfologi, där var och en har sina egna fördelar och nackdelar. Ljusmikroskopi kan ge allmänna detaljer om storleken och formen på större vesiklar och homogeniteten hos ett prov på ett relativt snabbt sätt. Omvänt är TEM den vanligaste tekniken för att undersöka liposomernas morfologi i mycket mer detalj; potentialen för strukturella förändringar för varje TEM-undertyp på grund av färgning och/eller exponering för vakuumförhållanden måste dock beaktas vid tolkningen av resultaten. ESEM är mest användbart vid bestämning av liposomala förändringar som svar på miljön, medan AFM framträder som en användbar metod i den morfologiska analysen av nanopartiklar och ger maximal upplösning av liposomalytan. Både AFM och TEM kan avbilda ligander konjugerade till ytan av liposomer och ge kompletterande information om ytmodifieringar. Sammantaget är valet av teknik beroende av vilka morfologiska egenskaper och detaljgrad som krävs. Dessutom är det viktigt att förstå de potentiella effekterna av provberedningsmetoden för varje bildteknik i urvalsprocessen.
Författarbidrag
utarbetande av manuskript: A-LR och SH. Revidera artikeln kritiskt för viktigt intellektuellt innehåll: SH, PD, JF, WP, AM, DS och AW.
intressekonflikt uttalande
författarna förklarar att forskningen genomfördes i avsaknad av kommersiella eller finansiella relationer som kan tolkas som en potentiell intressekonflikt.
erkännanden
författarna vill tacka Pharmacy Research Trust i New South Wales, Rebecca L. Cooper Medical Research Foundation, Gladys M. Brawn Fellowship, ausEE Research Foundation och University of Newcastle för att ge ekonomiskt stöd till vår forskning.
Adler, K. och Schiemann, J. (1985). Karakterisering av liposomer genom svepelektronmikroskopi och frysfrakturtekniken. Micron Microsc. Acta 16, 109-113. doi: 10.1016/0739-6260(85)90039-5
CrossRef fulltext / Google Scholar
Almgren, M., Edwards, K. och Karlsson, G. (2000). Cryo transmissionselektronmikroskopi av liposomer och relaterade strukturer. Kolloider Surfar. En Physicochem. Eng. ASP. 174, 3–21. doi: 10.1016 / S0927-7757 (00)00516-1
CrossRef fulltext / Google Scholar
Anabousi, S., Laue, M., Lehr, C. M., Bakowsky, U., och Ehrhardt, C. (2005). Bedömning av transferrinmodifiering av liposomer genom atomkraftmikroskopi och transmissionselektronmikroskopi. EUR. J. Pharm. Biopharm. 60, 295–303. doi: 10.1016/j.ejpb.2004.12.009
PubMed Abstrakt / CrossRef fulltext / Google Scholar
Bagatolli, La (2009). Membran och fluorescensmikroskopi. Recensioner i fluorescens 2007. New York, NY: Springer, 33-51. doi: 10.1007 / 978-0-387-88722-7_2
CrossRef fulltext / Google Scholar
Bakker-Woudenberg, I. A., Storm, G. och Woodle, M. C. (1994). Liposomer vid behandling av infektioner. J. Läkemedelsmål. 2, 363–371. doi: 10.3109 / 10611869408996811
PubMed Abstrakt / CrossRef fulltext / Google Scholar
Bendas, G. (2001). Immunoliposomer: ett lovande tillvägagångssätt för att rikta cancerterapi. BioDrugs 15, 215-224. doi: 10.2165 / 00063030-200115040-00002
CrossRef fulltext / Google Scholar
Bendas, G., Krause, A., Bakowsky, U., Vogel, J. och Rothe, U. (1999). Målbarhet av nya immunoliposomer framställda genom en ny antikroppskonjugeringsteknik. Int. J. Pharm. 181, 79–93. doi: 10.1016/S0378-5173(99)00002-2
PubMed Abstrakt | CrossRef fulltext | Google Scholar
Bibi, S., Kaur, R., Henriksen-Lacey, M., McNeil, S. E., Wilkhu, J., lattmann, E., et al. (2011). Mikroskopi avbildning av liposomer: från täckglas till miljö SEM. Int. J. Pharm. 417, 138–150. doi: 10.1016/j.ijpharm.2010.12.021
PubMed Abstrakt / CrossRef fulltext / Google Scholar
Bouvrais, H., Pott, T., Bagatolli, La, Ipsen, JH och Meleard, P. (2010). Inverkan av membranförankrade fluorescerande sonder på de mekaniska egenskaperna hos lipidbilayers. Biochim. Biophys. Acta 1798, 1333-1337. doi: 10.1016/j.bbamem.2010.03.026
PubMed Abstrakt | CrossRef fulltext/Google Scholar
Cullis, pr, Chonn, A. och Semple, S. C. (1998). Interaktioner mellan liposomer och lipidbaserade bärarsystem med blodproteiner: förhållande till clearance beteende in vivo. Adv. Drog Deliv. Rev. 32, 3-17. doi: 10.1016/S0169-409x(97)00128-2
PubMed Abstrakt | CrossRef fulltext | Google Scholar
Ding, B. S., Dziubla, T., Shuvaev, V. V., Muro, S. och Muzykantov, V. R. (2006). Avancerade läkemedelsleveranssystem som riktar sig mot det vaskulära endotelet. Mol. Interv. 6, 98–112. doi: 10.1124 / mi.6.2.7
PubMed Abstrakt / CrossRef fulltext / Google Scholar
Henry, C. R. (2005). Morfologi av stödda nanopartiklar. Prog. Surfa. Sci. 80, 92–116. doi: 10.1016/j.progsurf.2005.09.004
CrossRef fulltext / Google Scholar
Hua, S. (2013). Inriktningsställen för inflammation: intercellulär vidhäftningsmolekyl-1 som ett mål för nya inflammatoriska terapier. Front. Pharmacol. 4:127. doi: 10.3389 / fphar.2013.00127
PubMed Abstrakt / CrossRef fulltext / Google Scholar
Hua, S., Marks, E., Schneider, JJ och Keely, S. (2015). Framsteg i orala nano-leveranssystem för koloninriktad läkemedelsleverans vid inflammatorisk tarmsjukdom: selektiv inriktning mot sjuk kontra frisk vävnad. Nanomedicin 11, 1117-1132. doi: 10.1016 / j. nano.2015.02.018
PubMed Abstrakt / CrossRef fulltext / Google Scholar
Hua, S. och Wu, S. Y. (2013). Användningen av lipidbaserade nanokarrier för riktade smärtterapier. Front. Pharmacol. 4:143. doi: 10.3389 / fphar.2013.00143
PubMed Abstrakt / CrossRef fulltext / Google Scholar
Ishida, T., Harashima, H. och Kiwada, H. (2001). Interaktioner mellan liposomer och celler in vitro och in vivo: opsonins and receptors. Curr. Drug Metab. 2, 397–409. doi: 10.2174/1389200013338306
PubMed Abstract | CrossRef Full Text | Google Scholar
Jass, J., Tjarnhage, T., and Puu, G. (2000). From liposomes to supported, planar bilayer structures on hydrophilic and hydrophobic surfaces: an atomic force microscopy study. Biophys. J. 79, 3153–3163. doi: 10.1016/S0006-3495(00)76549-0
PubMed Abstract | CrossRef Full Text | Google Scholar
Klymchenko, A. S., Oncul, S., Didier, P., Schaub, E., Bagatolli, L., Duportail, G., et al. (2009). Visualisering av lipiddomäner i jätte unilamellära vesiklar med hjälp av en miljökänslig membransond baserad på 3-hydroxyflavon. Biochim. Biophys. Acta 1788, 495-499. doi: 10.1016/j.bbamem.2008.10.019
PubMed Abstrakt | CrossRef fulltext/Google Scholar
Kuntsche, J., Horst, JC och Bunjes, H. (2011). Kryogen transmissionselektronmikroskopi (kryo-TEM) för att studera morfologin hos kolloidala läkemedelsleveranssystem. Int. J. Pharm. 417, 120–137. doi: 10.1016/j.ijpharm.2011.02.001
PubMed Abstrakt / CrossRef fulltext / Google Scholar
Le Bihan, O., Bonnafous, P., Marak, L., Bickel, T., Trepout, S., Mornet, S., et al. (2009). Kryo-elektrontomografi av nanopartikeltransmigration till liposom. J. Struct. Biol. 168, 419–425. doi: 10.1016 / j. jsb.2009.07.006
PubMed Abstrakt | CrossRef fulltext/Google Scholar
Liang, X., Mao, G. och Ng, K. Y. (2004A). Mekaniska egenskaper och stabilitetsmätning av kolesterolinnehållande liposom på glimmer genom atomkraftmikroskopi. J. Kolloid Gränssnitt Sci. 278, 53–62.
PubMed Abstract / Google Scholar
Liang, X., Mao, G. och Ng, K. Y. (2005). Effekt av kedjelängder av PEO-PPO-PEO på liten unilamellär liposommorfologi och stabilitet: en AFM-undersökning. J. Kolloid Gränssnitt Sci. 285, 360–372. doi: 10.1016/j.jcis.2004.11.042
PubMed Abstrakt | CrossRef fulltext/Google Scholar
Liang, X., Mao, G. och Simon Ng, K. Y. (2004b). Sondera små unilamellära eggpc vesiklar på glimmer yta genom atomkraft mikroskopi. Kolloider Surfar. B Biointerfaces 34, 41-51.
PubMed Abstract / Google Scholar
Mao, G., Liang, X. Och Ng, K. Y. S. (2004). Encyklopedi av nanovetenskap och nanoteknik. New York, NY: Marcel Dekker.
Google Scholar
Mastrobattista, E., Koning, G. A. och Storm, G. (1999). Immunoliposomer för målinriktad leverans av antitumörläkemedel. Adv. Drog Deliv. Rev. 40, 103-127. doi: 10.1016 / S0169-409X (99)00043-5
CrossRef fulltext / Google Scholar
Mertins, O., och Dimova, R. (2013). Insikter om interaktioner mellan chitosan och fosfolipidblåsor. Del II: membran förstyvning och porbildning. Langmuir 29, 14552-14559. doi: 10.1021 / la4032199
PubMed Abstrakt | CrossRef fulltext/Google Scholar
Metselaar, JM och Storm, G. (2005). Liposomer vid behandling av inflammatoriska störningar. Expert Opin. Drog Deliv. 2, 465–476. doi: 10.1517 / 17425247.2.3.465
PubMed Abstrakt | CrossRef fulltext/Google Scholar
Mohammed, A. R., Weston, N., Coombes, A. G., Fitzgerald, M. och Perrie, Y. (2004). Liposomformulering av dåligt vattenlösliga läkemedel: optimering av läkemedelsbelastning och esem-analys av stabilitet. Int. J. Pharm. 285, 23–34. doi: 10.1016/j.ijpharm.2004.07.010
PubMed Abstrakt / CrossRef fulltext / Google Scholar
Moutardier, V., Tosini, F., Vlieghe, P., Cara, L., Delpero, Jr och Clerc, T. (2003). Kolloidala läkemedel mot cancer biotillgänglighet i orala administrationsmodeller. Int. J. Pharm. 260, 23–38. doi: 10.1016 / S0378-5173 (03) 00231-x
PubMed Abstrakt | CrossRef fulltext | Google Scholar
Murphy, D. B. Och Davidson, M. W. (2012A). Konfokal Laserskanningsmikroskopi. Grunderna för ljusmikroskopi och elektronisk bildbehandling, 2: a Edn. Hoboken, NJ: John Wiley & söner, 265-305. doi: 10.1002 / 9781118382905. ch13
CrossRef fulltext / Google Scholar
Murphy, D. B. Och Davidson, M. W. (2012b). Fluorescensmikroskopi. Grunderna för ljusmikroskopi och elektronisk bildbehandling. Weinheim: John Wiley & söner, 199-231. doi: 10.1002 / 9781118382905. ch11
CrossRef fulltext / Google Scholar
Murphy, D. B. Och Davidson, M. W. (2012c). Grunderna för ljusmikroskopi och elektronisk bildbehandling. Hoboken, NJ: John Wiley & söner, 1-19. doi: 10.1002 / 9781118382905
CrossRef fulltext / Google Scholar
Murphy, D. B. Och Davidson, M. W. (2012d). Polarisationsmikroskopi. Grunderna för ljusmikroskopi och elektronisk bildbehandling. Hoboken, NJ: John Wiley& söner, 153-171. doi: 10.1002 / 9781118382905. ch9
CrossRef fulltext / Google Scholar
Muscariello, L., Rosso, F., Marino, G., Giordano, A., Barbarisi, M., Cafiero, G., et al. (2005). En kritisk översikt över esem-tillämpningar inom det biologiska området. J. Cell. Fysiol. 205, 328–334. doi: 10.1002 / jcp.20444
PubMed Abstrakt / CrossRef fulltext / Google Scholar
Nallamothu, R., Trä, G. C., Pattillo, C. B., Scott, R. C., Kiani, M. F., Moore, B. M., et al. (2006). Ett tumörvaskulaturinriktat liposomleveranssystem för combretastatin A4: design, karakterisering och in vitro-utvärdering. AAPS PharmSciTech 7: E32. doi: 10.1208 / pt070232
PubMed Abstrakt | CrossRef fulltext/Google Scholar
Nirale, Nm, Vidhate, rd och Nagarsenker, ms (2009). Flutikasonpropionat liposomer för lungleverans. Indiska J. Pharm. Sci. 71, 709–711.
Google Scholar
Orlova, E. V., Sherman, MB, Chiu, W., Mowri, H., Smith, L. C. och Gotto, A. M. Jr. (1999). Three-dimensional structure of low density lipoproteins by electron cryomicroscopy. Proc. Natl. Acad. Sci. U.S.A. 96, 8420–8425. doi: 10.1073/pnas.96.15.8420
CrossRef Full Text | Google Scholar
Ruozi, B., Belletti, D., Tombesi, A., Tosi, G., Bondioli, L., Forni, F., et al. (2011). AFM, ESEM, TEM, and CLSM in liposomal characterization: a comparative study. Int. J. Nanomedicine 6, 557–563. doi: 10.2147/IJN.S14615
PubMed Abstract | CrossRef Full Text | Google Scholar
Ruozi, B., Tosi, G., Forni, F., Fresta, M. och Vandelli, M. A. (2005). Atomkraftmikroskopi och fotonkorrelationsspektroskopi: två tekniker för snabb karakterisering av liposomer. EUR. J. Pharm. Sci. 25, 81–89. doi: 10.1016/j.ejps.2005.01.020
PubMed Abstrakt | CrossRef fulltext/Google Scholar
Ruozi, B., Tosi, G., Leo, E. och Vandelli, ma (2007). Tillämpning av atomkraftmikroskopi för att karakterisera liposomer som läkemedels-och genbärare. Talanta 73, 12-22. doi: 10.1016 / j. talanta.2007.03.031
PubMed Abstrakt / CrossRef fulltext / Google Scholar
Ruozi, B., Tosi, G., Tonelli, M., Bondioli, L., Mucci, A., Forni, F., et al. (2009). AFM-fasavbildning av mjuka hydratiserade prover: ett mångsidigt verktyg för att slutföra den kemiska-fysiska studien av liposomer. J. Liposom Res. 19, 59-67. doi: 10.1080 / 08982100802584071
PubMed Abstrakt / CrossRef fulltext / Google Scholar
Sawant, rr och Torchilin, VP (2012). Utmaningar i utvecklingen av riktade liposomala terapier. AAPS J. 14, 303-315. doi: 10.1208 / s12248-012-9330-0
PubMed Abstrakt / CrossRef fulltext / Google Scholar
Senior, J. H. (1987). Öde och beteende hos liposomer in vivo: en översyn av kontrollerande faktorer. Crit. Rev. Ther. Drogbärare Syst. 3, 123–193.
PubMed Abstract / Google Scholar
Sercombe, L., Veerati, T., Moheimani, F., Wu, S. Y., Sood, A. K. och Hua, S. (2015). Framsteg och utmaningar av liposomassisterad läkemedelsleverans. Front. Pharmacol. 6:286. doi: 10.3389 / fphar.2015.00286
CrossRef Full Text | Google Scholar
Severs, N. J. (2007). Freeze-fracture electron microscopy. Nat. Protoc. 2, 547–576. doi: 10.1038/nprot.2007.55
PubMed Abstract | CrossRef Full Text | Google Scholar
Sitterberg, J., Ozcetin, A., Ehrhardt, C., and Bakowsky, U. (2010). Utilising atomic force microscopy for the characterisation of nanoscale drug delivery systems. Eur. J. Pharm. Biopharm. 74, 2–13. doi: 10.1016/j.ejpb.2009.09.005
PubMed Abstrakt / CrossRef fulltext / Google Scholar
Torchilin, V. P. (1994). Immunoliposomer och pegylerade immunoliposomer: möjlig användning för riktad leverans av avbildningsmedel. Immunometoder 4, 244-258. doi: 10.1006 / immu.1994.1027
PubMed Abstrakt | CrossRef fulltext/Google Scholar
Van Antwerpen, R. och Gilkey, J. C. (1994). Kryo-elektronmikroskopi avslöjar human lipoproteins understruktur med låg densitet. J. Lipid Res. 35, 2223-2231.
PubMed Abstract | Google Scholar
Wang, X., Song, Y., Su, Y., Tian, Q., Li, B., Quan, J., et al. (2015). Are PEGylated liposomes better than conventional liposomes? A special case for vincristine. Drug Deliv. 29, 1–9. doi: 10.3109/10717544.2015.1027015
PubMed Abstract | CrossRef Full Text | Google Scholar
Weisman, S., Hirsch-Lerner, D., Barenholz, Y., and Talmon, Y. (2004). Nanostructure of cationic lipid-oligonucleotide complexes. Biophys. J. 87, 609–614. doi: 10.1529/biophysj.103.033480
PubMed Abstrakt / CrossRef fulltext / Google Scholar
Willis, M. och Forssen, E. (1998). Ligandinriktade liposomer. Adv. Drog Deliv. Rev. 29, 249-271. doi: 10.1016 / S0169-409X (97) 00083-5
CrossRef fulltext | Google Scholar
Zununi Vahed, S., Salehi, R., Davaran, S. och Sharifi, S. (2017). Liposombaserade läkemedelssamleveranssystem i cancerceller. Mater. Sci. Eng. C Mater. Biol. Appl. 71, 1327–1341. doi: 10.1016 / j. msec.2016.11.073
PubMed Abstract | CrossRef Full Text | Google Scholar
Leave a Reply