gränser i onkologi
introduktion
cirka 25% av de tidiga bröstcancerpatienterna upplever fortfarande lokal återfall och utvecklar avlägsna metastaser efter aktiv behandling (1), och nästan 10% av patienterna befinner sig i stadium IV-sjukdom vid initial diagnos i den utvecklade världen, som kallas de novo metastatisk bröstcancer (MBC) (2). Trots behandlingsförflyttningar förblir MBC obotlig och upp till 70-80% av MBC-patienterna dör av cancer inom 5 år (2). Som ett resultat av heterogeniteten hos MBC utvecklas flera prognostiska modeller baserade på prognostiska faktorer eller poäng för att förutsäga deras kliniska resultat och direkta kliniker för att fatta lämpliga terapeutiska beslut (3-5). Dessutom finns det också en mängd prognostiska modeller för bröstcancer med hjärnmetastas (BCBM) för kliniker att exakt förutsäga överlevnad hos dessa patienter (6, 7).
bröstcancer kan metastasera var som helst i kroppen men metastaserar främst till lunga, ben, lever, icke-axillära lymfkörtlar och hjärna (8). I synnerhet är levermetastas (LM) inte bara en vanlig metastatisk plats utan också förknippad med signifikant ökad dödsrisk som liknar hjärnmetastas, en oproportionerligt högre dödlighet jämfört med lung-eller benmetastaser (5, 8). Eftersom graderad prognostisk bedömning (GPA) är allmänt accepterad hos bcbm-patienter, stimulerar de ovan nämnda prognostiska modellerna oss att föreslå en praktisk modell för BCLM (3-7). Vårt mål var att konstruera en pålitlig och användarvänlig prognostisk modell för BCLM och att utvärdera dess överensstämmelse och noggrannhet genom att validera den både internt och externt. Den prognostiska modellen kan hjälpa kliniker att uppskatta dödsrisken för BCLM-patienter och välja optimal behandling.
patienter och metoder
urval av patienter
den aktuella studien godkändes av FUSCC: s oberoende etikutskott. På varandra följande MBC-patienter diagnostiserade vid FUSCC från januari 2007 till December 2018 identifierades (n = 9 062). Kriterierna för stödberättigande var följande: (1) histologiskt bekräftad bröstcancer, (2) kvinnliga patienter, (3) levern som den första platsen för metastatisk sjukdom i antingen de novo metastatisk eller återkommande bröstcancer, och (4) fullständiga och detaljerade register. Patienter med bilateral bröstcancer, andra invasiva neoplasmer eller okänd uppföljning uteslöts. Slutligen valdes 1 022 berättigade patienter ut för vidare analys. De fullständiga stegen för val visas i Figur S1.
studera variabler och urval av gränsvärden
Information samlades in på följande kliniska patologiska variabler: ålder, molekylära subtyper, tidigare behandlingsinformation (kirurgi och systemisk kemoterapi), MFI, platser med extrahepatisk metastas (hjärna, lunga, ben och lymfkörtlar), egenskaper hos levermetastas (distribution, antal, maximal diameter), hemoglobin (HB), leverfunktionstester och överlevnadstid. Molekylära subtyper inkluderade hormonreceptor (HR) och human epidermal tillväxtfaktorreceptor 2 (HER2) status. Vi definierade MFI som intervallet mellan datumet för diagnos av primär bröstcancer och datumet för första avlägsna metastaser. Gränsvärdena för MFI som användes i denna studie var 3 och 24 månader enligt referens (9). Därför kan patienter delas in i tre grupper: patienter med de novo MBC (MFI < 3 månader), patienter med kort MFI (24 månader i 24 månader) och patienter med lång MFI > 24 månader. Avlägsen lymfkörtelmetastas definierades som metastas av ipsilaterala axillära, supraklavikulära, infraklavikulära eller inre bröstlymfkörtlar. Diagnosen av LM baserades på radiografisk avbildning eller patologiska bevis. Egenskaper för levermetastas utvärderades med hjälp av abdominal datortomografi (CT), magnetisk resonansavbildning (MRI) eller kirurgiska resektionsprover. Leverfunktionstester analyserades också i den aktuella studien, inklusive totalt bilirubin, alaninaminotransferas (alat), aspartataminotransferas (AST), alkaliskt fosfatas (ALP), laktatdehydrogenas (LDH) och förhållandet mellan sackios och glutamyltransferas och albumin (GAR). Blodprover togs för laboratorietester inom 1 vecka efter diagnosen LM. Klassificeringar av distribution, antal eller maximal diameter av levermetastaser och LDH baserades på andra studier (10-13). Gränsvärdena för HB, totalt bilirubin, alat, ASAT och ALP bestämdes enligt de gemensamma Terminologikriterierna för biverkningar (CTCAE) eftersom måttliga eller grad II-avvikelser i hemoglobinnivåer eller leverfunktion kan påverka terapeutiska val (14). Värdet av GAR definierades som ett enkelt förhållande mellan serumy-glutamyltransferas (GGT, U/L) – nivån och serumalbumin (ALB g/L) – nivån. OS från tiden för metastas mättes från datumet för diagnos av LM till döds av någon orsak. Den sista uppföljningstiden var November 2019 med en median uppföljningstid på 18,63 månader. Om patienterna förlorades för uppföljning censurerades den sista dagen av uppföljningen.
statistisk analys
patienterna delades in i utbildningen (2007-2016, n = 715) och validering (2016-2018, n = 307) satt i ett förhållande av 7:3. Det optimala cutoff-värdet för GAR valdes genom beräkningen av Youden index och receiver operating characteristic curve (ROC) analys (figur S2). Pearson chi-squared test eller Fishers exakta test användes för att göra en jämförelse mellan kategoriska variabler. Cox proportionella faror regressionsmodeller med bakåtvalsmetoden användes för multivariat analys och för att beräkna riskförhållanden. Regressionskoefficienterna beräknades genom multivariat regressionsanalys och multiplicerades sedan med 10 och avrundades för att representera slutliga prognostiska poäng. Bootstrapping användes för intern validering. Sedan användes tidsberoende Roc-kurvor och kalibreringsdiagram för att bedöma diskriminering och kalibrering av denna prognostiska modell i valideringsuppsättningen. Gränsvärdena för riskgrupper bestämdes av X-tile-tomter (15). Överlevnadsanalys utfördes med användning av Kaplan-Meier överlevnadskurvor, och log-rank-tester användes för att jämföra överlevnadskurvor. Alla p-värden var dubbelsidiga och värden på P < 0,05 ansågs statistiskt signifikanta. Statistisk analys utfördes med hjälp av SPSS-programvara (SPSS 20, Chicago, IL, USA) och r-programvaruversion 4.0.1.
resultat
egenskaper och samband med Riskstratifiering
totalt 1 022 patienter som valts ut i denna studie delades in i utbildning (n = 715) och validering (n = 307) uppsättningar. En beskrivning av kliniska patologiska egenskaper ges i Tabell 1 och tabell S1. I träningsgruppen diagnostiserades 126 patienter (17, 6%) med de novo MBC och 589 patienter (82, 4%) med återkommande MBC, varav 297 patienter (50, 4%) hade en kort MFI och 292 patienter (49, 6%) hade en lång MFI. Medianåldern vid diagnos av LM var 50 (intervall 21-87) år med 617 patienter (86.3%) yngre än 60 år. Av dessa patienter var andelen HR-positiva och HER2-positiva patienter 62,2 respektive 38,0%. Bland återkommande MBC-patienter genomgick nästan alla patienter operation på den primära tumören (584, 99,2%) och fick (neo)adjuvant kemoterapi (569, 96,6%). Mönster av avlägsen metastas visade att den vanligaste platsen för extrahepatisk metastas var ben (42,7%) följt av avlägsna lymfkörtlar (36,1%), lunga (25,6%) och hjärna (2,9%). Levermetastas kännetecknades av diffus fördelning och små knölar, varav majoriteten var multipla (metastasering av 3 metastaser, 77,3%) men små knölar (3 cm, 59,4%) och involverade höger och vänster lober (74,4%). I det tidiga skedet av LM försämrades leverfunktionen i varierande grad men i allmänhet mild. Ökningen av LDH (36,1%) och GAR (35,9%) verkade vara känsliga leverdysfunktionsindikatorer och måttliga eller högre avvikelser i HB (2,9%), totalt bilirubin (2,7%), alat (3,6%), ASAT (9,5%) och ALP (3,9%) nivåer var ovanliga enligt CTCAE. Jämfört med lågriskgruppen presenterade mellan – och högriskgruppen en högre frekvens av HR och HER2 negativitet, en kort MFI, extrahepatisk metastas, levermetastas tumörbelastning och abnormiteter i hemoglobinnivåer eller leverfunktion (Alla Ps 0,001), vilket tyder på att dessa faktorer kan påverka prognosen för BCLM.
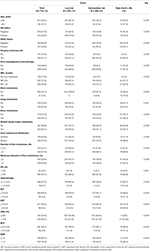
tabell 1. Baslinjeegenskaper och dess förhållande till riskstratifiering av träningsuppsättning.
prognostisk modell och validering
i den multivariata Cox-regressionsmodellen associerades molekylära subtyper (HR-och HER2-status), MFI, platser med extrahepatisk metastas (hjärn -, lung-och benmetastas) och leverfunktionstester (totalt bilirubin, LDH och GAR) med OS (Tabell 2). Specifikt ökade dödsrisken för HR–negativa (HR 1,740, 95% CI 1,424–2,127, P < 0,001) och HER2-negativa (HR 1,615, 95% CI 1,316-1,983, p < 0,001) patienter jämfört med HR eller HER2 positiva motsvarigheter. Längden av MFI hade också en signifikant inverkan på överlevnaden hos BCLM–patienter, och därför förkortades överlevnaden hos patienter med en lång MFI (HR 1.612, 95% CI 1.195–2.174, P < 0.001) jämfört med patienter med de novo MBC och patienter med en kort MFI (HR 2.563, 95% CI 1.904-3.449, p < 0.001) hade mer än dubbelt så stor risk för dödsfall i förhållande till dem. Dessutom var närvaron av extrahepatisk metastas (hjärn -, lung-och benmetastas) och onormal leverfunktion (totalt bilirubin, LDH och GAR) alla korrelerade med en ogynnsam prognostisk inverkan på OS. Denna prognostiska modell hade området under kurvan (AUC) för tidsberoende ROC vid 1 års OS med 0,78 i träningsuppsättningen och 0,80 i valideringsuppsättningen, vilket indikerar att denna modell hade en bra diskriminering (Figur 1). Bootstrapping-metoden användes för att bekräfta stabiliteten hos vår prognostiska modell i träningsuppsättningen, och de slutliga resultaten var ganska robusta (tabell S2). Kalibreringskurvorna för den prognostiska modellen för 1 år och 3 år OS i träningsuppsättningen samt 1 år OS i valideringsuppsättningen visade sin goda överensstämmelse (Figur 2).

tabell 2. Multivariat Cox regressionsmodell (träningsuppsättning).
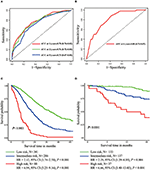
Figur 1. Tidsberoende Roc-kurvor för den prognostiska modellen i träningsuppsättningen (a) och valideringsuppsättningen (B). Total överlevnad från metastas av de tre prognostiska grupperna i utbildningen (C) och valideringsuppsättningen (D).
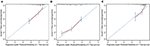
Figur 2. Kalibreringskurvan för att förutsäga patientens överlevnad vid 1 år (a) och 3 år (b) i träningsuppsättningen och vid 1 år (C) i valideringsuppsättningen.
Riskstratifiering och överlevnad

tabell 3. Beräkning av poäng-och cutoff-punkter för de prognostiska grupperna.
diskussion
i föreliggande analys av 1 022 patienter behandlade i vår institution från 2007 till 2018 har vi visat att molekylära subtyper (HR-och HER2-status), MFI, platser för extrahepatisk metastas (hjärn -, lung-och benmetastas), leverfunktionstester (totalt bilirubin, LDH och GAR) var oberoende prognostiska faktorer för BCLM patienter. Därför konstruerades en prognostisk modell för BCLM-patienter med prognostiska faktorer.
När det gäller molekylära subtyper kan HR-positiva indikera att bröstcancertillväxt och proliferation fortfarande regleras av hormoner, kallade hormonberoende tumörer. Samtidigt har endokrin terapi fördelar inklusive få biverkningar och långvariga effekter, vilket ofta kan ge långsiktiga överlevnadsfördelar för HR-positiva patienter. Därför har HR-positivt betraktats som en signifikant faktor som tyder på en gynnsam prognos vid tidig och metastatisk bröstcancer (1, 3-5, 8-10, 16). Även om HER2-förstärkning och överuttryck anses vara en prediktor för en risk för avlägsen metastas och bröstcancerrelaterad död, har senare utvecklade anti–HER2-medel anmärkningsvärt förbättrat överlevnaden hos HER2-positiva bröstcancerpatienter (2, 9, 17). I en tid med målinriktad terapi fann en studie i sydöstra Nederländerna att dödlighetsrisken för HER2-negativa patienter ökade med 44% (95% CI 1,13–1,83, P = 0,003) jämfört med HER2-positiva patienter (9). I vår studie ökade dödsrisken för HR-negativa och HER2-negativa patienter jämfört med HR-eller HER2-positiva motsvarigheter, i överensstämmelse med dessa observationer. Patienter med en kort MFI, vanligtvis definierad som 24 månader, hade en sämre prognos (3, 5, 9). Vidare verkade de novo MBC-patienter ha en signifikant bättre prognos jämfört med återkommande MBC-patienter, även om denna skillnad gradvis minskades med förlängningen av sjukdomsfritt intervall (DFI) eller MFI (9, 18, 19). Lobbezoo et al. fann att patienter med MFI 24 månader hade betydligt kortare överlevnadstid (9,1 vs. 29.4 månader, P < 0,001) än de med de novo stadium IV-sjukdomar, men patienter med längre MFI (>24 månader) hade en liknande prognos (27,9 mot 29,4 månader, P = 0,73) (9). Den möjliga orsaken till detta fenomen är att patienter med återkommande MBC som tidigare genomgått systematisk behandling kan vara mer resistenta mot kemoterapi än terapinaiva patienter med de novo MBC, men ytterligare undersökning är motiverad (9, 18, 19). Denna studie bekräftade att överlevnadstiden för patienter med en lång MFI förkortades jämfört med de novo MBC med patienter med en kort MFI som gav ett betydligt sämre resultat.
MBC-överlevnad skilde sig signifikant beroende på metastatiska platser och patienter med visceral metastas var associerade med en ökad risk för dödlighet jämfört med de med icke-visceral metastas (3-5, 9, 18). Dessutom hade närvaron av hjärnmetastas en större inverkan på överlevnad än någon annan metastatisk plats (3, 5, 9, 18). Det var inte förvånande att flera metastaser hade ett mer ogynnsamt inflytande på prognosen (3, 5, 9, 17, 18). I denna analys kan extrahepatisk metastas, förutom avlägsen lymfkörtelmetastas, leda till förkortad överlevnad, förmodligen eftersom levermetastas var den kritiskt livshotande faktorn jämfört med lymfkörtelmetastas.
det bör noteras att patienter med högre bilirubinnivåer hade mycket lägre risk för flera sjukdomar delvis via dess antioxidant och antiinflammatoriska egenskaper (20). En ny studie rapporterade också att en nästan 40% minskning av dödsrisken visades bland tidiga bröstcancerpatienter med högre total bilirubinnivå (21). Hyperbilirubinemi var emellertid associerad med dålig prognos bland BCLM-patienter (22). Det är möjligt att, till skillnad från relativt högre totalt bilirubin bland icke-metastatiska bröstcancerpatienter, kan ett förhöjt bilirubin 1, 5 gånger mer än den övre gränsen för normal (ULN) bland BCLM-patienter förutsäga allvarlig leverskada och därmed bidra till läkemedelsavbrott eller hepatisk encefalopati.
Warburg-effekten Driver cancerceller att bero på aerob glykolys även när syretillförseln är tillräcklig, vilket är kännetecknet för cancermetabolism i motsats till normala vävnader (23). LDH spelar en oumbärlig roll i glykolys på grund av dess förmåga att omvandla pyruvat till laktat under anaeroba förhållanden (24). Avreglerade nivåer av LDH kan återspegla högre tumörbörda, sämre behandlingssvar och prognos, som tidigare rapporterats i flera tumörer (21, 24-26). En metaanalys på prognostisk effekt av LDH hos bröstcancerpatienter visade att högre LDH-nivåer resulterade i otillfredsställande OS och progressionsfri överlevnad, vilket inkluderade 11 studier med 6 102 patienter (27).
GGT, den huvudsakliga endogena antioxidanten, gör föregångare aminosyror assimilerade och involverar i glutationsyntes (28). GGT i tumörer gör det möjligt för celler att snabbt fylla på glutation efter att ha fått prooxidant anticancerbehandling och är därför korrelerad med läkemedelsresistens och dålig överlevnad (29). Intressant, Fentiman et al. rapporterade att ett signifikant positivt samband identifierades mellan förhöjd GGT och bröstcancerrisk (30). ALB syntetiseras av levern fungerar som en antioxidant, transportör av näringsämnen, och har Deltagande i signalvägar på grund av dess unika strukturella egenskaper (31). Hypoalbuminemi förekommer vanligtvis hos avancerade cancerpatienter och tillskrivs olika mekanismer, inklusive nedsatt leversyntes, ökad katabolism och kakexi (21, 31). Hypoalbuminemi är en oberoende indikator på dålig prognos för olika tumörer (21, 22, 32, 33). Till skillnad från minskade serumalbuminnivåer tenderar GGT-nivåer i serum att vara förhöjda när leverfunktionen försämras. Därför kan GAR baserat på ovanstående två parametrar ha fördelen att reflektera leverreserv förmåga och förutsäga prognosen (32, 33). I den aktuella studien var onormal leverfunktion (totalt bilirubin, LDH och GAR) alla korrelerade med en ogynnsam prognostisk inverkan på OS.
efter analys av prognosen för 123 BCLM-patienter, Duan et al. fann att patienter med tre eller flera levermetastaser bar 2.26 gånger ökad risk för dödsfall i förhållande till patienter med <3 levermetastaser i multivariat analys (10). Egenskaper hos levermetastas i denna studie verkade dock inte göra någon skillnad. Det finns två potentiella skäl som bidrar till denna skillnad. Först och främst var distribution, antal och maximal diameter av levermetastaser signifikant olika i de tre riskgrupperna, vilket indikerar att risken för dödlighet ökade med expansionen av levermetastas i univariat analys. Efteråt var onormal leverfunktion nära relaterad till tumörbelastningen av levermetastas, vilket justerade rollen för dessa faktorer i multivariat analys.
det har gjorts många studier på prognostiska faktorer i inställningen av BCLM. En analys av 145 BCLM-patienter visade att hypoalbuminemi, äldre ålder och er-negativitet var oberoende prediktorer för dålig överlevnad (22). En grekisk registeranalys erhöll liknande resultat, där HR-positivitet, låg histologisk kvalitet, frånvaro av extrahepatisk metastas och god prestationsstatus var signifikanta prognostiska faktorer för gynnsam prognos i univariat analys (34). En ny populationsbaserad studie inklusive mer än 4000 patienter med de novo BCLM har identifierat demografiska och socioekonomiska faktorer, patologisk grad, totalt antal extrahepatiska metastaser, behandling och molekylär subtyp som parametrar som påverkar total överlevnad signifikant (17). Regierer et al. utvecklat en prognostisk poäng för MBC baserat på HR-status, MFI och metastaser för att förutsäga deras prognos och individualisera optimal behandling, som validerades internt och externt (5). Tyvärr ingick inte HER2-status i den prognostiska poängen och begränsade därför dess tillämplighet. Den modifierade Bröst-GPA för bcbm-patienter som integrerar fyra enkla kliniska parametrar hade en omedelbar roll för att förutsäga deras överlevnad, men var inte tillämplig för BCLM-patienter (7). Så vitt vi vet finns det ingen prognostisk modell som integrerar dessa prognostiska faktorer för BCLM-patienter, så vår modell är pragmatisk.
det fanns också vissa begränsningar i denna forskning. Först resulterade en enda center och retrospektiv studie oundvikligen i urvalsbias även om vår prognostiska modell validerades internt och externt. För det andra utesluts patienter som utvecklade levermetastas senare i sjukdomsförloppet så att vi inte kunde utvärdera dessa patienter. För det tredje var detaljerad information om prestationsstatus och behandling inte tillgänglig i denna studie.
slutsatser
trots dessa begränsningar kan denna forskning ge en enkel och pålitlig prognostisk modell. Den största fördelen med Vår studie är införlivandet av parametrar som är lättillgängliga i klinisk praxis på grundval av det stora urvalet av BCLM-patienter. Bortsett från utsökt klassificering av tumörer enligt nästa generations sekvenseringsmetoder kan vår modell hjälpa till att identifiera undergrupper med olika prognoser och vägleda efterföljande terapi.
datatillgänglighet uttalande
de ursprungliga bidragen som presenteras i studien ingår i artikeln/kompletterande Material, ytterligare förfrågningar kan riktas till motsvarande författare/s.
etik uttalande
föreliggande studie godkändes av FUSCC: s oberoende etikutskott. Patienterna / deltagarna gav sitt skriftliga informerade samtycke till att delta i denna studie.
Författarbidrag
lj föreslog studien. XZ och YG samlade in uppgifterna. LJ och LF analyserade data och skrev det första utkastet. ZW granskade manuskriptet kritiskt. Alla författare bidrog till artikeln och godkände den inlämnade versionen.
intressekonflikt
författarna förklarar att forskningen genomfördes i avsaknad av kommersiella eller finansiella relationer som kan tolkas som en potentiell intressekonflikt.
bekräftelser
Vi erkänner Lei Cheng för att Utföra dataanalys.
kompletterande Material
förkortningar
BCLM, bröstcancer med levermetastas; FUSCC, Fudan University Shanghai Cancer Center; ROC, mottagaroperativ karakteristisk kurva; MFI, metastatisk fritt intervall; HR, Hazard ratio; CI, konfidensintervall; OS, total överlevnad; MBC, metastatisk bröstcancer; BCBM, bröstcancer med hjärnmetastas; LM, levermetastas; GPA, graderad prognostisk bedömning; HB, hemoglobin; HR, hormonreceptor; HER2, human epidermal tillväxtfaktorreceptor 2; CT, datoriserad tomografi; MRI, magnetisk resonansavbildning; ALT, alaninaminotransferas; AST, aspartataminotransferas; ALP, alkaliskt fosfatas; LDH, laktatdehydrogenas; gar, förhållandet mellan SACKIOGLUTAMYLTRANSFERAS och albumin; GGT, Kubi-glutamyltransferas; ALB, albumin; CTCAE, gemensamma Terminologikriterier för biverkningar; ULN, övre normalgräns.
4. Jag är en av de mest kända i världen. Praktiskt prognostiskt index för patienter med metastatisk återkommande bröstcancer: retrospektiv analys av 2 322 patienter från Geicam Spanish El Alamo Register. Bröstcancer Res Behandla. (2010) 122:591–600. doi: 10.1007/s10549–009-0687–4
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Regierer AC, Wolters R, Ufen MP, Weigel A, Novopashenny I, Kohne CH, et al. An internally and externally validated prognostic score for metastatic breast cancer: analysis of 2269 patients. Ann Oncol. (2014) 25:633–8. doi: 10.1093/annonc/mdt539
PubMed Abstract | CrossRef Full Text
6. Marko NF, Xu Z, Gao T, Kattan MW, Weil RJ. Förutsäga överlevnad hos kvinnor med bröstcancer och hjärnmetastas: ett nomogram överträffar nuvarande överlevnadsprognosmodeller. Cancer. (2012) 118:3749–57. doi: 10.1002 / cncr.26716
PubMed Abstrakt / CrossRef fulltext / Google Scholar
7. Subbia IM, Lei X, Weinberg JS, Sulman EP, Chavez-MacGregor M, Tripathy D, et al. Validering och utveckling av en modifierad bröstgraderad prognostisk bedömning som ett verktyg för överlevnad hos patienter med bröstcancer och hjärnmetastaser. J Clin Oncol. (2015) 33:2239–45. doi: 10.1200/JCO.2014.58.8517
PubMed Abstrakt / CrossRef fulltext / Google Scholar
9. Det är en av de mest populära och mest populära spelen i världen. Prognos för metastatisk bröstcancer: finns det skillnader mellan patienter med de novo och återkommande metastatisk bröstcancer? Br J Cancer. (2015) 112:1445–51. doi: 10.1038/bjc.2015.127
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Duan XF, Dong NN, Zhang T, Li Q. The prognostic analysis of clinical breast cancer subtypes among patients with liver metastases from breast cancer. Int J Clin Oncol. (2013) 18:26–32. doi: 10.1007/s10147–011-0336-x
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Dueck AC, Mendoza TR, Mitchell SA, Reeve BB, Castro KM, Rogak LJ, et al. Giltighet och tillförlitlighet hos US National Cancer Institutes patientrapporterade Resultatversion av Common Terminology Criteria for Adverse Events (PRO-CTCAE). JAMA Oncol. (2015) 1:1051–9. doi: 10.1001 / jamaoncol.2015.2639
PubMed Abstrakt / CrossRef fulltext / Google Scholar
17. Xie J, Xu Z. en populationsbaserad studie om levermetastaser hos kvinnor med nydiagnostiserad bröstcancer. Cancer Epidemiol Biomarkörer Föregående. (2019) 28:283–92. doi: 10.1158/1055–9965.EPI-18–0591
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Dawood S, Broglio K, Ensor J, Hortobagyi GN, Giordano SH. Survival differences among women with de novo stage IV and relapsed breast cancer. Ann Oncol. (2010) 21:2169–74. doi: 10.1093/annonc/mdq220
PubMed Abstract | CrossRef Full Text
19. den Brok WD, Speers CH, Gondara L, Baxter E, Tyldesley SK, Lohrisch CA. Överlevnad med metastatisk bröstcancer baserat på initial presentation, de novo kontra återfall. Bröstcancer Res Behandla. (2017) 161:549–56. doi: 10.1007 / s10549–016-4080–9
PubMed Abstrakt / CrossRef fulltext / Google Scholar
20. Fujiwara R, Haag M, Schaeffeler E, Nies AT, Zanger UM, Schwab M. systemisk reglering av bilirubinhomeostas: potentiella fördelar med hyperbilirubinemi. Hepatologi. (2018) 67:1609–19. doi: 10.1002/hep.29599
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Liu X, Meng QH, Ye Y, Hildebrandt MAT, Gu J, Wu X. Prognostic significance of pretreatment serum levels of albumin, LDH and total bilirubin in patients with non-metastatic breast cancer. Carcinogenesis. (2015) 36:243–8. doi: 10.1093/carcin/bgu247
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Vander Heiden MG, Cantley LC, Thompson CB. Förstå Warburg-effekten: de metaboliska kraven för cellproliferation. Vetenskap. (2009) 324:1029–33. doi: 10.1126 / vetenskap.1160809
PubMed Abstrakt / CrossRef fulltext / Google Scholar
24. Mishra D, Banerjee D. Laktatdehydrogenaser som metaboliska kopplingar mellan tumör och stroma i tumörens mikromiljö. Cancer. (2019) 11:750. doi: 10.3390/cancers11060750
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Pelizzari G, Basile D, Zago S, Lisanti C, Bartoletti M, Bortot L, et al. Lactate dehydrogenase (ldh) response to first-line treatment predicts survival in metastatic breast cancer: first clues for a cost-effective and dynamic biomarker. Cancers. (2019) 11:1243. doi: 10.3390/cancers11091243
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Hopkins AM, Rowland A, McKinnon RA, Sorich MJ. Predictors of long-term disease control and survival for HER2-positive advanced breast cancer patients treated with pertuzumab, trastuzumab, and docetaxel. Front Oncol. (2019) 9:789. doi: 10.3389/fonc.2019.00789
PubMed Abstract | CrossRef Full Text | Google Scholar
34. Pentheroudakis G, Fountzilas G, Bafaloukos D, Koutsoukou V, Pectasides D, Skarlos D, et al. Metastatisk bröstcancer med levermetastaser: en registeranalys av kliniska patologiska, hanterings-och resultategenskaper hos 500 kvinnor. Bröstcancer Res Behandla. (2006) 97:237–44. doi: 10.1007 / s10549–005-9117–4
PubMed Abstrakt / CrossRef fulltext / Google Scholar
Leave a Reply