Halobetasol propionat salva
doseringsform: salva
medicinskt granskad av Drugs.com. Senast uppdaterad den 1 mars 2020.
- översikt
- biverkningar
- dosering
- Professional
- interaktioner
- mer
Halobetasol propionat salva beskrivning
Halobetasol propionat salva, 0,05% innehåller halobetasol propionat, en syntetisk kortikosteroid för lokal dermatologisk användning. Kortikosteroiderna utgör en klass av främst syntetiska steroider som används topiskt som ett antiinflammatoriskt och antipruritiskt medel.
kemiskt halobetasolpropionat är 21-kloro-6 ci, 9-difluoro-11 ci, 17-dihydroxi-16 ci-metylpregna-1, 4-dien-3-20-Dion, 17-propionat, C25H31ClF2O5. Den har följande strukturformel:
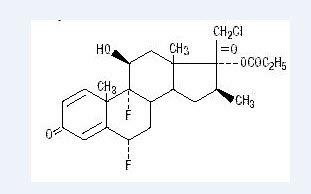
Halobetasolpropionat har molekylvikten 485. Det är ett vitt kristallint pulver olösligt i vatten.
varje gram Halobetasolpropionatsalva innehåller 0.5 mg/g halobetasolpropionat i en bas av aluminiumstearat, bivax, pentaerytritolkooat, petrolatum, propylenglykol, sorbitan sesquioleat och stearylcitrat.
Halobetasolpropionatsalva-klinisk farmakologi
liksom andra topikala kortikosteroider har halobetasolpropionat antiinflammatoriska, antipruritiska och vasokonstriktiva åtgärder. Mekanismen för den antiinflammatoriska aktiviteten hos de topiska kortikosteroiderna är i allmänhet oklart. Kortikosteroider tros emellertid verka genom induktion av fosfolipas A2-hämmande proteiner, kollektivt kallade lipokortiner. Det antas att dessa proteiner kontrollerar biosyntesen av potenta mediatorer av inflammation såsom prostaglandiner och leukotriener genom att hämma frisättningen av deras vanliga föregångare arakidonsyra. Arakidonsyra frigörs från membranfosfolipider med fosfolipas A2.
farmakokinetik
omfattningen av perkutan absorption av topikala kortikosteroider bestäms av många faktorer inklusive fordonet och epidermalbarriärens integritet. Ocklusiva förband med hydrokortison i upp till 24 timmar har inte visats öka penetrationen; ocklusion av hydrokortison i 96 timmar ökar emellertid markant penetrationen. Topikala kortikosteroider kan absorberas från normal intakt hud. Inflammation och / eller andra sjukdomsprocesser i huden kan öka perkutan absorption.
Human-och djurstudier indikerar att mindre än 6% av den applicerade dosen halobetasolpropionat kommer in i cirkulationen inom 96 timmar efter topisk administrering av Halobetasolpropionatsalvan.
studier utförda med Halobetasolpropionatsalva indikerar att det ligger i det superhöga potensintervallet jämfört med andra topikala kortikosteroider.
indikationer och användning för Halobetasolpropionatsalva
Halobetasolpropionatsalva är en kortikosteroid med hög styrka som indikeras för lindring av inflammatoriska och pruritiska manifestationer av kortikosteroidresponsiva dermatoser. Behandling efter två på varandra följande veckor rekommenderas inte, och den totala dosen bör inte överstiga 50 g/vecka på grund av potentialen för läkemedlet att undertrycka hypotalamus-hypofys-adrenal (HPA) – axeln. Användning till barn under 12 år rekommenderas inte.
som med andra högaktiva kortikosteroider ska behandlingen avbrytas när kontrollen har uppnåtts. Om ingen förbättring ses inom 2 veckor kan omprövning av diagnosen vara nödvändig.
kontraindikationer
Halobetasolpropionatsalva är kontraindicerad hos de patienter med överkänslighet mot någon av komponenterna i preparatet.
försiktighetsåtgärder
allmänt
systemisk absorption av topikala kortikosteroider kan ge reversibel hypotalamus – hypofys-adrenal (HPA) axelundertryckning med potential för glukokortikosteroidinsufficiens efter avbrytande av behandlingen. Manifestationer av Cushings syndrom, hyperglykemi och glukosuri kan också produceras hos vissa patienter genom systemisk absorption av topikala kortikosteroider under behandlingen.
patienter som applicerar en topisk steroid på en stor yta eller på områden under ocklusion bör utvärderas regelbundet för bevis på hPa-axelundertryckning. Detta kan göras genom att använda ACTH stimulering, A. M. plasma kortisol, och urin fri-kortisol tester. Patienter som får superpotenta kortikosteroider ska inte behandlas mer än 2 veckor åt gången och endast små områden ska behandlas samtidigt på grund av den ökade risken för hPa-suppression.
Halobetasolpropionatsalva producerade hPa-axelundertryckning när den användes i uppdelade doser vid 7 gram per dag i en vecka hos patienter med psoriasis. Dessa effekter var reversibla vid avbrytande av behandlingen.
om hPa-axelundertryckning noteras bör man försöka dra tillbaka läkemedlet, minska appliceringsfrekvensen eller ersätta en mindre potent kortikosteroid. Återhämtning av HPA-axelfunktionen är i allmänhet snabb vid avbrytande av topikala kortikosteroider. Sällan kan tecken och symtom på glukokortikosteroidinsufficiens uppstå som kräver kompletterande systemiska kortikosteroider. För information om systemiskt tillskott, se förskrivningsinformation för dessa produkter.
pediatriska patienter kan vara mer mottagliga för systemisk toxicitet från ekvivalenta doser på grund av deras större hudyta till kroppsmassförhållanden (se försiktighetsåtgärder: pediatrisk användning).
om irritation utvecklas ska Halobetasolpropionatsalva avbrytas och lämplig behandling sättas in. Allergisk kontaktdermatit med kortikosteroider diagnostiseras vanligtvis genom att observera misslyckande att läka snarare än att notera en klinisk exacerbation som med de flesta aktuella produkter som inte innehåller kortikosteroider. En sådan observation bör bekräftas med lämplig diagnostisk patch testning.
om samtidig hudinfektioner förekommer eller utvecklas ska ett lämpligt antifungalt eller antibakteriellt medel användas. Om ett gynnsamt svar inte uppstår omedelbart, bör användningen av Halobetasolpropionatsalva avbrytas tills infektionen har kontrollerats tillräckligt.
Halobetasolpropionatsalva ska inte användas vid behandling av rosacea eller perioral dermatit, och den ska inte användas i ansiktet, ljumsken eller i axillan.
information för patienter
patienter som använder topikala kortikosteroider ska få följande information och instruktioner:
- läkemedlet ska användas enligt instruktioner från läkaren. Det är endast för extern användning. Undvik kontakt med ögonen.
- läkemedlet ska inte användas för någon annan sjukdom än den för vilken den ordinerades.
- det behandlade hudområdet ska inte bandas, på annat sätt täckas eller lindas, så att det är ocklusivt om det inte instrueras av läkaren.
- patienter ska rapportera till sin läkare eventuella tecken på lokala biverkningar.\
laboratorietester
följande tester kan vara till hjälp vid utvärdering av patienter för hPa-axelundertryckning: ACTH-stimuleringstest; A. M. plasma kortisoltest; Urinfritt kortisoltest.
karcinogenes, mutagenes, nedsatt fertilitet
långtidsstudier på djur har inte utförts för att utvärdera halobetasolpropionats karcinogena potential. Positiva mutagenicitetseffekter observerades i två genotoxicitetsanalyser. Halobetasolpropionat var positivt i ett Mikronukleustest av kinesisk hamster och i en mutationsanalys av muslymfom in vitro.
studier på råtta efter oral administrering vid dosnivåer upp till 50 mcg/kg/dag indikerade ingen nedsatt fertilitet eller allmän reproduktionsförmåga.
i andra genotoxicitetstester visade sig halobetasolpropionat inte vara genotoxiskt i Ames / Salmonellaanalysen, i systerkromatidutbytestestet i somatiska celler i kinesisk hamster, i kromosomavvikelsestudier av germinala och somatiska celler hos gnagare och i ett däggdjursfläcktest för att bestämma punktmutationer.
graviditet
teratogena effekter: graviditetskategori C
kortikosteroider har visat sig vara teratogena hos försöksdjur när de administreras systemiskt i relativt låga dosnivåer. Vissa kortikosteroider har visat sig vara teratogena efter dermal applicering hos laboratoriedjur.
Halobetasolpropionat har visat sig vara teratogent hos SPF-råttor och kaniner av chinchilla-typ när de ges systemiskt under dräktigheten i doser på 0,04 till 0,1 mg/kg hos råttor och 0,01 mg/kg hos kaniner. Dessa doser är ungefär 13, 33 respektive 3 gånger, den humana topiska dosen av Halobetasolpropionatsalva. Halobetasolpropionat var embryotoxiskt hos kaniner men inte hos råttor.
kluven gom observerades hos både råttor och kaniner. Omphalocele sågs hos råttor, men inte hos kaniner.
det finns inga adekvata och välkontrollerade studier av den teratogena potentialen hos halobetasolpropionat hos gravida kvinnor. Halobetasolpropionatsalva ska endast användas under graviditet om den potentiella nyttan motiverar den potentiella risken för fostret.
ammande mödrar
systemiskt administrerade kortikosteroider förekommer i bröstmjölk och kan undertrycka tillväxt, störa endogen kortikosteroidproduktion eller orsaka andra ogynnsamma effekter. Det är inte känt om topisk administrering av kortikosteroider kan leda till tillräcklig systemisk absorption för att producera detekterbara mängder i bröstmjölk. Eftersom många läkemedel utsöndras i bröstmjölk, bör försiktighet iakttas när Halobetasolpropionatsalva administreras till en ammande kvinna.
pediatrisk användning
säkerhet och effektivitet av Halobetasolpropionatsalva hos barn har inte fastställts och användning hos barn under 12 år rekommenderas inte. På grund av ett högre förhållande mellan hudytan och kroppsmassan löper pediatriska patienter större risk än vuxna med hPa-axelundertryckning och Cushings syndrom när de behandlas med topikala kortikosteroider. De har därför också större risk för binjurinsufficiens under eller efter avbrytande av behandlingen. Biverkningar inklusive striae har rapporterats vid olämplig användning av topikala kortikosteroider hos spädbarn och barn.
hPa-axelundertryckning, Cushings syndrom, linjär tillväxthämning, försenad viktökning och intrakraniell hypertoni har rapporterats hos barn som får topikala kortikosteroider. Manifestationer av adrenal suppression hos barn inkluderar låga plasmakortisolnivåer och frånvaro av svar på ACTH-stimulering. Manifestationer av intrakraniell hypertoni inkluderar utbuktande fontaneller, huvudvärk och bilateralt papilledema.
geriatrisk användning
av 850 patienter behandlade med Halobetasolpropionatsalva i kliniska studier var 21% 61 år och äldre och 6% 71 år och äldre. Inga övergripande skillnader i säkerhet eller effektivitet observerades mellan dessa patienter och yngre patienter; och annan rapporterad klinisk erfarenhet har inte identifierat skillnader i svar mellan äldre och yngre patienter, men större känslighet hos vissa äldre individer kan inte uteslutas.
biverkningar
i kontrollerade kliniska prövningar inkluderade de vanligaste biverkningarna som rapporterades för Halobetasolpropionatsalva sveda eller sveda hos 1,6% av patienterna. Mindre frekvent rapporterade biverkningar var pustulering, erytem, hudatrofi, leukoderma, akne, klåda, sekundär infektion, telangiektasi, urtikaria, torr hud, miliaria, parestesi och utslag.
följande ytterligare lokala biverkningar rapporteras sällan med topikala kortikosteroider, och de kan förekomma oftare med kortikosteroider med hög potens, såsom Halobetasolpropionatsalva. Dessa reaktioner listas i en ungefärlig minskande förekomstordning: follikulit, hypertrichos, akneiformutbrott, hypopigmentering, perioral dermatit, allergisk kontaktdermatit, sekundär infektion, striae och miliaria.
för att rapportera misstänkta biverkningar, kontakta Teligent Pharma, Inc. vid 1-856-697-1441, eller FDA vid 1-800-FDA-1088 eller www.fda.gov / medwatch.
överdosering
topiskt applicerad kan Halobetasolpropionatsalva absorberas i tillräckliga mängder för att ge systemiska effekter (se försiktighetsåtgärder)H
Halobetasolpropionatsalva dosering och administrering
applicera ett tunt lager Halobetasolpropionatsalva på den drabbade huden en eller två gånger dagligen, enligt anvisningar från din läkare, och gnugga in försiktigt och fullständigt.
Halobetasol propionat salva är en superhög potens topisk kortikosteroid; därför bör behandlingen begränsas till två veckor och mängder större än 50 g/vecka ska inte användas. Liksom med andra kortikosteroider bör behandlingen avbrytas när kontrollen uppnås. Om ingen förbättring ses inom 2 veckor kan omprövning av diagnosen vara nödvändig.
Halobetasolpropionatsalva ska inte användas med ocklusiva förband.
hur levereras Halobetasolpropionatsalva
Halobetasolpropionatsalva, 0,05% levereras i följande rörstorlekar:
50 g (NDC 63739-998-67)
förvaring
förvara Halobetasolpropionatsalva mellan 15 C och 30 C (59 F och 86 f).
Tillverkad av:
Teligent Pharma, Inc.
Buena, NJ 08310
distribueras av:
McKesson Corporation
dba Sky Packaging
4971 Southridge Blvd., Svit 101
Memphis, TN 38141
PI-073-00
C101430 Rev 02/2020
PAKETETIKETT.HUVUDDISPLAYPANEL 50 gram kartong
NDC 63739-998-67
Halobetasolpropionat
salva, 0,05%
endast för lokal användning.
ej för användning i ögonen.
netto Wt. 50 grams
Rx Only

| HALOBETASOL PROPIONATE Halobetasol Propionate Ointment |
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
Labeler – McKesson Corporation (140529962)
Registrant – Teligent Pharma, Inc. (011036910)
| Establishment | |||
| Name | Address | ID/FEI | Operations |
| Teligent Pharma, Inc. | 011036910 | manufacture(63739-998) | |
Frequently asked questions
- Halobetasol vs. clobetasol – how do they compare?
- kan detta användas för poison ivy?
- kan det användas i hårbotten?
mer om halobetasol topikal
- biverkningar
- under graviditet eller amning
- doseringsinformation
- läkemedelsinteraktioner
- jämför alternativ
- prissättning & kuponger
- 25 recensioner
- läkemedelsklass: topical steroids
Consumer resources
- Patient Information
- Halobetasol Topical application (Advanced Reading)
Professional resources
- Prescribing Information
- Halobetasol (FDA)
- Halobetasol Cream (FDA)
- Halobetasol Foam (FDA)
Other brands Ultravate, Lexette, Bryhali, Halonate
Related treatment guides
- Plaque Psoriasis
- Eczema
- Psoriasis
- Atopic Dermatitis
- Granuloma Annulare
- Dermatitis
Medical Disclaimer
Leave a Reply