organisk kemi II

experimentellt observeras emellertid att det finns en signifikant barriär mot rotation kring C2-C3-bindningen och att hela molekylen är plan. Dessutom är C2-C3-bindningen 148 pm lång, kortare än en typisk kol-kol-enkelbindning (cirka 154 pm), men längre än en typisk dubbelbindning (cirka 134 pm).
Molekylär orbitalteori redogör för dessa observationer med begreppet delokaliserade pi-bindningar. I denna bild kombinerar de fyra 2P-atomorbitalerna matematiskt för att bilda fyra pi-molekylära orbitaler med ökande energi. Två av dessa-bindningspi-orbitalerna – är lägre i energi än P – atomorbitalerna från vilka de bildas, medan två – de antibonding pi* orbitalerna-är högre i energi.

den lägsta energimolekylära orbitalen, pi1, har endast konstruktiv interaktion och nollnoder. Högre i energi, men fortfarande lägre än de isolerade p – orbitalerna, har pi2-orbitalen en nod men två konstruktiva interaktioner-så det är fortfarande en bindningsbana övergripande. Om man tittar på de två antibonding orbitalerna har pi3* två noder och en konstruktiv interaktion, medan pi4* har tre noder och noll konstruktiva interaktioner.
med aufbau-principen placeras de fyra elektronerna från de isolerade 2PZ-atomorbitalerna i bindningen pi1 och pi2 MO. Eftersom pi1 innefattar konstruktiv interaktion mellan C2 och C3 finns det en grad i 1,3-butadienmolekylen av pi-bindningsinteraktion mellan dessa två kol, som står för dess kortare längd och barriären för rotation. Valensbindningsbilden av 1,3-butadien visar de två pi-bindningarna som isolerade från varandra, med varje par pi-elektroner fast i sin egen pi-bindning. Molekylär orbitalteori förutspår (exakt) att de fyra pi-elektronerna i viss utsträckning är delokaliserade eller ’spridda ut’ över hela pi-systemet.

1,3-butadien är det enklaste exemplet på ett system med konjugerade pi-bindningar. För att betraktas som konjugerad måste två eller flera pi – bindningar separeras med endast en enda bindning-med andra ord kan det inte finnas ett mellanliggande sp3-hybridiserat kol, eftersom detta skulle bryta upp det överlappande systemet med parallella p-orbitaler. I föreningen nedan konjugeras exempelvis C1-C2-och C3-C4-dubbelbindningarna, medan C6-C7-dubbelbindningen isoleras från de andra två pi-bindningarna med sp3-hybridiserad C5.

ett mycket viktigt begrepp att tänka på är att det finns en inneboende termodynamisk stabilitet associerad med konjugering. Denna stabilitet kan mätas experimentellt genom att jämföra värmen av hydrogenering av två olika Diener. (Hydrogenering är en reaktionstyp som vi kommer att lära oss mycket mer om i kapitel 15: i huvudsak är det processen att tillsätta en vätemolekyl – två protoner och två elektroner – till en p-bindning). När de två konjugerade dubbelbindningarna av 1,3-pentadien hydrogeneras för att producera pentan frigörs cirka 225 kJ per mol bildad pentan. Jämför det med de cirka 250 kJ/mol som släpptes när de två isolerade dubbelbindningarna i 1,4-pentadien hydreras och bildar också pentan.
bildandet av syntetiska polymerer från Diener såsom 1,3-butadien och isopren diskuteras i avsnitt 18.5. Syntetiska polymerer är stora molekyler som består av mindre upprepande enheter. Du är förmodligen något bekant med ett antal av dessa polymerer; till exempel polyeten, polypropen, polystyren och poly(vinylklorid).

figur 13.6: energidiagram för hydrogenering av 1,3-butadien (inte skala).
eftersom hydrogeneringen av 1,3-butadien frigör mindre än den förutsagda mängden energi, måste energiinnehållet i 1,3-butadien vara lägre än vad vi kanske hade förväntat oss. Med andra ord är 1,3-butadien stabilare än dess formel antyder.
den konjugerade dienen är lägre i energi: med andra ord är den mer stabil. I allmänhet är konjugerade pi-bindningar mer stabila än isolerade pi-bindningar.
Här är ett energidiagram som jämför olika typer av bindningar med deras värme av hydrogenering (per mol) för att visa relativ stabilitet hos varje molekyl (1 kcal = 4,18 kJ). (Ju lägre värme av hydrogenering (per pi-bindning), desto stabilare är strukturen.)
stabiliseringen av Diener genom konjugering är mindre dramatisk än den aromatiska stabiliseringen av bensen. Likväl kan liknande resonans-och molekylära orbitalbeskrivningar av konjugation skrivas.
syntes av Diener
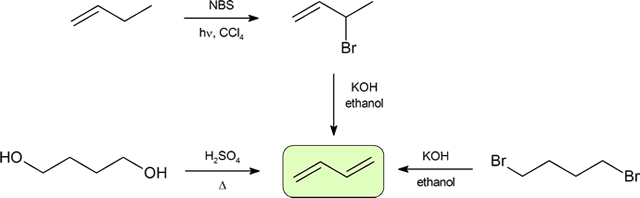
de två vanligaste sätten att syntetisera konjugerade Diener är dehydrering av alkoholer och dehydrohalogenering av organohalider, vilka infördes vid framställning av alkener (avsnitt 9.9). Följande schema illustrerar några av vägarna för att förbereda en konjugerad Dien.
konjugerade pi-system kan involvera syre-och kväveatomer såväl som kol. I metabolismen av fettmolekyler involverar några av nyckelreaktionerna alkener som är konjugerade till karbonylgrupper.

mo-teorin är mycket användbar för att förklara varför organiska molekyler som innehåller utökade system av konjugerade pi-bindningar ofta har distinkta färger. betakaroten, föreningen som är ansvarig för den orange färgen på morötter, har ett utökat system med 11 konjugerade pi-bindningar.

övningar
övning 2.9: Identifiera alla konjugerade och isolerade dubbelbindningar i strukturerna nedan. För varje konjugerat pi-system anger du antalet överlappande p-orbitaler och hur många pi-elektroner som delas mellan dem.
övning 2.10: identifiera alla isolerade och konjugerade pi-bindningar i lykopen, den rödfärgade föreningen i tomater. Hur många pi-elektroner finns i det konjugerade pi-systemet?

Leave a Reply