Viral latens: ner men inte ut
När du föreställer dig virus som gömmer sig från ditt immunsystem, kanske du tänker på herpes simplex-viruset, ansvarigt för kalla sår och könsherpes, eller varicella-zoster-viruset, vilket orsakar bältros. Dessa virus kan kvarstå i årtionden i ett viloläge som kallas latens och undvika upptäckt av vårt immunsystem (Kennedy et al., 2015). Latenta virus kan ibland vakna och börja replikera en gång till, orsaka symtom och sprida infektion (Lieberman, 2016).
det humana immunbristviruset (HIV) är på samma sätt en master escape artist. Det bildar en latent reservoar tidigt i infektion, vilket gör att viruset kan undvika immunsystemet och överleva på lång sikt. Människor som lever med HIV tar dagliga mediciner som kallas antiretroviral kombinationsbehandling (eller ART) för att förhindra att viruset replikeras. Konst är dock inte ett botemedel, eftersom det inte riktar sig mot virus som redan är latenta. Dessa läkemedel ges därför under en individs livstid: att stoppa behandlingen, även i några veckor, gör det möjligt för latenta virus att återaktivera och återuppväcka aktiv infektion. Människor med HIV kan förvänta sig att ha långa, hälsosamma liv på grund av konst, men latenta virus kommer alltid att finnas i kroppen.
att hitta ett botemedel mot HIV kräver att man kan eliminera eller kontrollera den latenta virala reservoaren. Vissa viktiga frågor måste dock fortfarande tas upp för att uppnå detta mål. Hur, när och var etablerar HIV latens? Vad är storleken på den latenta reservoaren, och det bästa sättet att mäta det? Vad utlöser latenta virus att återaktivera? Nu, i eLife, Miles Davenport, Brandon Keele och kollegor från University of New South Wales och Frederick National Laboratory for Cancer Research – inklusive Mykola Pinkevych som första författare – rapporterar när den latenta reservoaren är etablerad i en icke-mänsklig primatmodell av HIV och hur mycket av reservoaren kan återaktiveras (Pinkevych et al., 2019).
i denna studie infekterade teamet rhesus makaker med simian immunbristvirus (SIV), ett prekursorvirus som är endemiskt hos afrikanska apor och genetiskt liknar HIV (Williams och Burdo, 2009). Vid någon tidpunkt under 20-talet hoppade SIV från icke-mänskliga primater till människor; denna överföringshändelse över arter, i kombination med snabb utveckling, gjorde det möjligt för viruset att effektivt spridas hos människor och skapa den pågående HIV-pandemin (Keele et al., 2006).
Pinkevych et al. började med att infektera rhesus makaker med en konstruerad SIV innehållande över 10,000 unika randomiserade sekvenser av DNA; en gång sekvenserad tillåter dessa streckkoder att enskilda virus identifieras (Fennessey et al., 2017). Aporna behandlades sedan med antiretroviral behandling 4, 10 eller 27 dagar efter infektion. Dessa intervaller simulerar akut (4 dagar), tidigt (10 dagar) eller sent ingripande (27 dagar) med konst hos människor. Drogerna gavs i ungefär ett år, och viruset undertrycktes fullständigt hos alla djur. Behandlingen stoppades sedan och det latenta viruset fick återaktiveras. Med hjälp av genetisk sekvensering och matematisk modellering bestämde laget storleken på den latenta reservoaren för SIV och hur den skulle återaktiveras.
i aporna blockerade inte behandlingen fyra dagar efter infektion bildandet av den latenta reservoaren, men minskade dess storlek med ungefär 100 gånger jämfört med senare ART-initiering. På samma sätt har människor som börjar konst inom några dagar efter att ha förvärvat HIV en extremt liten reservoar jämfört med dem som börjar behandling senare (Luzuriaga et al., 2015; Henrich et al., 2017). Trots dessa stora skillnader i den totala reservoarstorleken, när ART stoppades, återaktiverades de latenta virusen med liknande hastigheter hos akuta, tidiga och senbehandlade djur (figur 1). Pinkevych et al. därför drar slutsatsen att majoriteten av virus som har potential att återaktivera etablerar latens tidigt efter infektion.
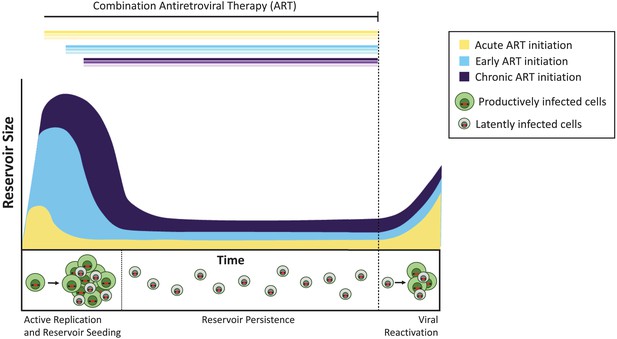
tidpunkten för antiretroviral terapi påverkar storleken på den latenta reservoaren.
utan behandling skapar celler infekterade med aktivt replikerande virus (produktivt infekterade celler; visas i grönt) infektiösa virus. En minoritet av infekterade celler innehåller virus som kan kvarstå på obestämd tid som en latent reservoar (latent infekterade celler; visas i grått), och dessa virus kan potentiellt återaktiveras vid ett senare tillfälle. Behandling som administreras under den akuta infektionsfasen (det vill säga inom dagar eller veckor efter primär infektion; gul kurva) resulterar i en mindre latent reservoar än när behandlingen initieras tidigt (inom sex månader efter infektion, ljusblå) eller under kronisk infektion (mer än 6 månader sedan infektion, violett). Om behandlingen avbryts (streckad linje) återaktiveras viruset från dessa reservoarer på liknande nivåer för att återuppväcka aktiv infektion och återfrö den latenta reservoaren.
för att undersöka varför tidpunkten för behandlingen inte tycktes påverka reaktiveringshastigheten mätte laget nivån av genetiska mutationer i latenta virus. Om virus ackumuleras mer skadliga mutationer ju längre de aktivt replikerar i kroppen, skulle detta föreslå att djur som får försenad ART kan bära en större andel latenta virus som är defekta och inte kan återuppväckas. Teamet fann dock att majoriteten av virusen (mer än 80%) var genetiskt intakta över alla djur, oavsett när behandlingen började. Detta är helt annorlunda än vad som händer med HIV-infektion hos människor, där de flesta av de latenta virusen innehåller stora genetiska mutationer och deletioner, vilket bara lämnar en liten fraktion (mellan 2% och 11%) som kan reaktiveras (Ho et al., 2013; Bruner et al., 2019).
en ny studie, som utvärderade dynamiken i HIV-reservoaren hos människor på stabil konst, identifierade en annan skillnad mellan denna SIV-modell och HIV-latens hos människor. Trots pågående konst kan latent HIV ibland spontant återaktiveras och virusen blir detekterbara i blodet under en kort stund. Hos människor är dessa virala ’blips’ fylogenetiskt kopplade till en virusreservoar etablerad inte bara vid initial infektion, men över år av obehandlad infektion (Jones et al., 2018). Orsakerna till dessa skillnader är inte väl förstådda och representerar viktiga områden för pågående forskning.
trots skillnader mellan icke-mänskliga primatmodeller och mänsklig HIV-infektion, arbetet av Pinkevych et al. bekräftar att viral latens upprättas extremt tidigt efter infektion. Dessa resultat indikerar att antiretroviral behandling bör påbörjas så snart som möjligt för att kontrollera HIV-infektion och minska latent reservoarstorlek. Mycket är fortfarande okänt om hur HIV-latens etableras och upprätthålls, särskilt under behandling; SIV-modeller kommer dock att förbli ett viktigt verktyg för att förstå hur man kan utrota den latenta reservoaren.
Leave a Reply