Frontiers in Neuroanatomy
Einführung
Die ophthalmische postherpetische Neuralgie (PHN) ist eine behindernde und umfassend untersuchte neuropathische Schmerzerkrankung, die durch Herpes zoster verursacht wird und mindestens 3 Monate lang in Bereichen anhält oder auftritt, die von der ophthalmischen Abteilung des Trigeminusnervs (IHS-Klassifikation, 2013).1
Studien zur Beurteilung der kutanen Innervation in Hautbiopsien haben neue Erkenntnisse über die Mechanismen geliefert, die neuropathischen Schmerzen bei verschiedenen Erkrankungen zugrunde liegen (Sommer und Lauria, 2007). Die Hautbiopsie ist ein minimalinvasives Diagnosewerkzeug zur Beurteilung von Nervenfasern in der menschlichen Epidermis und Dermis. Die epidermale Innervation besteht hauptsächlich aus unmyelinisierten C-Faserterminals mit relativ wenigen kleinen myelinisierten Aδ-Fasern, die ihre Myelinscheide verlieren und als unmyelinisierte freie Nervenenden in die Epidermis gelangen. Umgekehrt besteht die dermale Innervation hauptsächlich aus großen myelinisierten Aß-Fasern, die Äste zu dermalen Blutkörperchen und Haarfollikeln senden (Nolano et al., 2003, 2013).Die meisten morphometrischen Studien verwendeten Hellfeld-Immunhistochemie mit Protein-Genprodukt (PGP) 9.5-Immunfärbung und bewerteten die epidermale Innervation allein. Ein Ansatz, der auf Immunfluoreszenz und konfokaler Mikroskopie mit doppelter und dreifacher Immunfärbung mit einem umfangreichen Antikörperpanel einschließlich des panneuronalen Markers PGP 9 basiert.5, der Basalmembranmarker, Kollagen IV (ColIV) und Antikörper für verschiedene myelinisierte und nicht myelinisierte Nervenfaserpopulationen, haben sich als eindeutige Informationen über sensorische und autonome Nervenfasern erwiesen und möglicherweise die Innervation der Haut genauer beurteilt (Doppler et al., 2012; Nolano et al., 2013).Obwohl frühere Hautbiopsiestudien einen schweren Verlust der epidermalen Nervenfaser (ENF) in den betroffenen thorakalen Dermatomen von Patienten mit PHN gezeigt haben (Oaklander, 2001; Petersen et al., 2010) untersuchten sie weder die ophthalmische PHN direkt, noch unterschieden sie epidermale unmyelinisierte und dermale myelinisierte Fasern oder detaillierten die Beteiligung autonomer Nervenfasern genau. Diese Informationen könnten die pathophysiologischen Mechanismen, die PHN zugrunde liegen, genauer definieren und so möglicherweise die Art und Weise verbessern, wie wir diese außergewöhnlich arzneimittelresistente neuropathische Schmerzerkrankung diagnostizieren und heilen.
Fortsetzung unseres Forschungsinteresses an den Mechanismen, die neuropathischen Schmerzen bei peripheren Nervenerkrankungen zugrunde liegen (Truini et al., 2014) einschließlich PHN (Truini et al., 2008), in dieser klinischen und morphometrischen Studie wollten wir untersuchen, wie die ophthalmische PHN myelinisierte und unmyelinisierte sensorische und autonome Hautnervenfasern beeinflusst. Dazu nahmen wir 2 mm supraorbitale Stanzhautbiopsien von der betroffenen Seite und der nicht betroffenen Spiegelseite bei zehn Patienten mit ophthalmischem PHN. Wir verarbeiteten die Hautproben mit indirekter Immunfluoreszenz, untersuchten die Proben durch konfokale Mikroskopie, unterschieden epidermale unmyelinisierte und dermale myelinisierte Innervation und beschrieben die Beteiligung autonomer Nervenfasern.
Materialien und Methoden
Wir haben 10 Patienten (3 F, 7 M; 74,5 ± 4,4 Jahre) mit ophthalmischem PHN in die Abteilung für Neurologie der Universität Sapienza, Rom, aufgenommen. Ophthalmisches PHN wurde gemäß den diagnostischen Kriterien der International Headache Society diagnostiziert: Schmerzen, die mindestens 3 Monate lang in dem von der Augenabteilung des Trigeminusnervs versorgten Bereich anhalten oder wiederkehren und durch Herpes zoster verursacht werden. Ausschlusskriterien waren kognitive Beeinträchtigungen, andere Erkrankungen des zentralen und peripheren Nervensystems. Kein Patient wurde mit topischen Schmerzmitteln behandelt (d.h., Lidocain und Capsaicin).
Das Institutional Review Board der Abteilung für Neurologie, Policlinico Umberto I, Rom, genehmigte die Studie und die Patienten gaben ihre Einverständniserklärung ab.
Klinische und neurophysiologische Beurteilung
Alle Teilnehmer wurden einer allgemeinen Untersuchung und einer neurologischen Untersuchung unterzogen, mit vollständigen sensorischen Tests einschließlich negativer (taktiler, nadelstichiger und thermischer Hypästhesie) und positiver Symptome (anhaltender spontaner Schmerz, paroxysmaler Schmerz) und Anzeichen (mechanisch dynamische Allodynie und Nadelstichhyperalgesie). Das Vorhandensein und der Schweregrad negativer Symptome wurden durch Vergleich der betroffenen Seite mit dem Spiegelbild auf der gesunden Seite beurteilt. Die Schwere der verschiedenen Schmerztypen (d. H. anhaltender spontaner Schmerz, paroxysmaler Schmerz, mechanisch-dynamische Allodynie, Nadelstichhyperalgesie) wurde auf einer numerischen Bewertungsskala von 0-10 bewertet (NRS; 0 = keine Empfindung, 10 = schlimmstmöglicher Schmerz).
Bei allen Patienten wurde der Aß-myelinisierte faservermittelte Blinkreflex mit Methoden gemäß den Empfehlungen der International Federation of Clinical Neurophysiology Guidelines (Deuschl und Eisen, 1999) aufgezeichnet. Um die Aδ- und C-Faserfunktion zu untersuchen, zeichneten wir Laser-evozierte Potentiale nach einer zuvor berichteten Technik auf (Truini et al., 2008).
Hautbiopsie
Zwei-mm-Punch-Hautbiopsien wurden unmittelbar über der Augenbraue von der betroffenen und nicht betroffenen Spiegelseite entnommen. Die Wunde heilte in wenigen Tagen ohne sichtbare Narbe ab (Abbildung 1). Hautproben wurden mit immunhistochemischen Techniken verarbeitet, wie zuvor beschrieben (Nolano et al., 2013). Die Proben wurden über Nacht in Zamboni-Lösung fixiert, in 20%iger Saccharose in phosphatgepufferter Kochsalzlösung kryoprotektiert und auf einem Gefriermikrotom (Leica 2000R, Deutschland) in 50 µm dicke Schnitte geschnitten. Frei schwebende Abschnitte wurden für die indirekte Immunfluoreszenz unter Verwendung eines Antikörperpanels verarbeitet, um sensorische, autonome Hautinnervations- und Gefäßstrukturen, einschließlich PGP9.5, Calcitonin-Gen-verwandtes Peptid (CGRP), Substanz P (SubP) und vasoaktive intestinale Peptid (VIP) Antikörper (Tabelle 1). Digitale Bilder wurden mit Nicht-Laser-Konfokal-Mikroskopie (CARV Confocal System) aufgenommen; ATTO Biosciences, USA und Apotome confocal system; Zeiss, Deutschland).
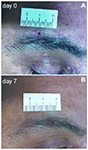
Abbildung 1. Zwei-mm-supraorbitale Stanzhautbiopsie. (A) Foto eines Patienten mit postherpetischer Neuralgie (PHN), das die 2-mm-Hautwunde unmittelbar nach dem Schlag zeigt. (B) Nach 1 Woche ist die Narbe kaum sichtbar.

Tabelle 1. Abkürzung, Quelle und Verdünnung von immunhistochemischen Markern.
Die ENF-Dichte wurde in den 2-mm-Hautstempelbiopsieproben durch Anwendung der Neurolucida-Software (MicroBrightField Bioscience, USA) auf vier konfokale Bilder der 20 × z-Serie (2 µm × 16-Inkremente) bewertet, die aus vier zufällig ausgewählten Abschnitten für jede Probe erhalten wurden. Dermale myelinisierte Nervenfasern wurden unter Verwendung von Anti-Myelin-Basisprotein-Antikörpern in der gesamten dermalen Oberfläche einschließlich einer Tiefe von 1 mm von der Basalmembran in drei zufälligen Abschnitten für jede Probe quantifiziert, nach zuvor veröffentlichtem Verfahren (Nolano et al., 2013). Ein kalibriertes Gitter (2 × 1 mm) mit einer Reihe von sieben äquidistanten parallelen Linien wurde auf ein digitales nicht konfokales 5 × 5-Vergrößerungsbild von Myelin-Basisprotein-gefärbten Abschnitten aufgebracht. Alle Abschnitte zwischen myelinisierten Fasern und den Gitterlinien wurden gezählt. Die dermale myelinisierte Nervenfaserdichte wurde berechnet als die Anzahl der Fasern, die das Gitter pro Hautfläche abfangen (Abschnitte pro mm2). Ein einzelner Bediener quantifizierte blind Hautnervenfasern in jeder Probe. VIP-ir Die sudomotorische Nervenlängendichte (nm / mm3) wurde unter Verwendung des Nervenverfolgungsmoduls Autoneuron, einem Teil der Neurolucida-Software, berechnet, wie zuvor beschrieben (Provitera et al., 2014). Zur Beurteilung peptiderger Fasern (SubP, CGRP und VIP-ir) im subepidermalen Nervenplexus wurde innerhalb von 100 µm von der Basalmembran ein semiquantitatives Scoring durchgeführt (0 = Fehlen von Fasern, 1 = seltene Fasersegmente, kürzer als 10 µm, 2 = wenige Fasern, die weitgehend denervierte Dermis bevölkern, 3 = normal, mehrere Fasern, die den größten Teil des subepidermalen Nervenplexus bedecken).
Die Befunde der Hautbiopsie bei den 10 Patienten wurden mit einer übereinstimmenden Stichprobe von 10 gesunden Probanden verglichen (epidermale Nervenfaserdichte: 18,9 ± 3,7/mm, dermale myelinisierte Faserdichte: 6,7 ± 1,4/mm; Nolano et al., 2013).
Statistische Analyse
Alle Daten werden als Mittelwert ± SD ausgedrückt. Die Normalverteilung der epidermalen und dermalen myelinisierten Faserdichte wurde unter Verwendung des D’Agostino- und Pearson-Omnibus-Normalitätstests bewertet. Der Wilcoxon Matched-Pair-Test wurde zum Vergleich neurophysiologischer und Hautbiopsievariablen zwischen nicht betroffenen und betroffenen Seiten verwendet. Der Mann-Whitney-Test wurde zum Vergleich von Hautbiopsievariablen zwischen PHN-Patienten und normalen Kontrollen verwendet. Korrelationen zwischen der ENF-Dichte und der PHN-Dauer wurden mit dem Pearson-r-Korrelationskoeffizienten berechnet. P-Werte kleiner oder gleich 0,05 wurden als statistisch signifikant angesehen.
Ergebnisse
Bei der klinischen Untersuchung klagten alle zehn Patienten über sensorische Defizite mit allen sensorischen Modalitäten und berichteten über anhaltende spontane Schmerzen (NRS: 4,3 ± 1,4); fünf Patienten klagten auch über mechanisch-dynamische Allodynie (NRS: 3,5 ± 0,7).
Neurophysiologische Tests zeigten schwere Anomalien bei allen getesteten Variablen. Bei allen Patienten löste ein faservermittelter Blinkreflex, der die betroffene Seite stimulierte, abnormale (verzögerte oder fehlende) Reaktionen aus. Laser-Wahrnehmungsschwellen waren höher und Aδ- und C-Laser evozierte Potentialamplituden niedriger nach Stimulierung der betroffenen Seite als nach Stimulierung der nicht betroffenen Seite (p < 0.05, Wilcoxon-Test). Bei 2 der 10 Patienten fehlten laser-evozierte Potentiale im Zusammenhang mit der C-Faser-Stimulation auch auf der nicht betroffenen Seite (Tabelle 2).

Tabelle 2. Abkürzung, Quelle und Verdünnung von immunhistochemischen Markern.
Die konfokale Immunfluoreszenzanalyse zeigte, dass sich die Innervation der Haut in den supraorbitalen Punch-Hautbiopsien von Patienten mit PHN auffallend zwischen der nicht betroffenen (Abbildungen 2A, C, E) und der betroffenen Seite (Abbildungen 2B, D, F) unterschied. Während Hautbiopsieproben von der nicht betroffenen Seite eine ziemlich dichte und regelmäßige Innervation aufwiesen, erschien die Epidermis auf der betroffenen Seite schlecht und ungleichmäßig innerviert mit Clustern und langen Bahnen ohne Nervenfasern (Abbildungen 2A–D). Die semiquantitative Analyse zeigte, dass der subepidermale Plexus schlecht und gestört wirkte und im Vergleich zur nicht betroffenen Seite weniger (p < 0, 001) CGRP (1, 4 ± 0, 8 vs. 2, 5 ± 0, 5), SubP (1, 1 ± 0, 6 vs. 2, 3 ± 0, 7) und VIP (1, 0 ± 0, 7 vs. 2, 2 ± 0, 8) ) Nervenfasern. Haarfollikel erschienen schlecht innerviert mit wenigen unmyelinisierten und myelinisierten Fasern (Abbildungen 2F, E). Der epidermale und dermale myelinisierte Faserverlust variierte von mittelschwer bis schwer und 3 der 10 Patienten hatten eine vollständige Hautdenervierung. Die wenigen überlebenden epidermalen Axone wurden zwischen den Bereichen der denervierten Epidermis gruppiert. Myelinisierte Fasern zeigten mehrere morphologische Anomalien, wie Fragmentierung, häufiges Auftreten einer längeren Knotenlänge als normal (7 µm oder länger; Nolano et al., 2003) und Kaliberunregelmäßigkeiten mit Vergrößerung und Schrumpfung (Durchmesseränderung über 100%) innerhalb desselben Internodiums. Diese Merkmale wurden auf der nicht betroffenen Seite selten beobachtet. Im Gegensatz zur sensorischen Innervation schienen beide Komponenten, adrenerge und cholinerge, der autonomen Innervation der dermalen Anhänge relativ erhalten zu sein (Abbildung 3). Die nicht betroffenen und betroffenen Seiten zeigten zahlreiche cholinerge (VIP-ir) sudomotorische (Abbildungen 3C, D) und adrenerge (DbH-ir) pilomotorische (Abbildungen 3E, F) Fasern. Die cholinerge sudomotorische Nervenfaserdichte unterschied sich nicht zwischen den betroffenen (1,9 ± 0.7 nm/mm3) und unbeeinflusste Seite (2,0 ± 0,5 nm/mm3).
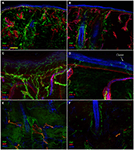
Abbildung 2. Innervation der Haut. Konfokale Bilder, die die Innervation der Haut in der nicht betroffenen (A, C, E) und betroffenen Seite (B, D, F) bei einem repräsentativen Patienten mit PHN zeigen. Ein schwerer Verlust der epidermalen und dermalen Nervenfasern ist in Hautbiopsien von der betroffenen Seite sichtbar (B vs. A). Die Epidermis auf der betroffenen Seite zeigt einen langen Trakt ohne Nervenfasern und Nervenfasercluster (D vs. C). Auffallender unmyelinisierter und myelinisierter Nervenfaserverlust um Haarfollikel (F vs. E). Stäbe: 100 µm in (A, B, E, F); 25 µm in (C, D).
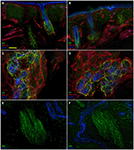
Abbildung 3. Autonome Innervation der Haut. Konfokale Bilder zeigen autonome Innervation der dermalen Anhänge in der betroffenen (A, C, E) und nicht betroffenen Seite (B, D, F). Die obere Dermis um die Haarfollikel auf der betroffenen Seite enthält weniger vasoaktive intestinale peptid-immunreaktive (VIP-IR) Fasern als der gleiche Hautbereich auf der nicht betroffenen Seite (A vs. B), während VIP-ir sudomotorische und DbH-ir pilomotorische Innervation ist gut ausgestattet (D und F vs. C und E). Gitter: 100 µm in (A, B); 50 µm in (C, D), 25 µm in (E, F).
Die quantitative Analyse (basierend auf der Analyse der Immunreaktivität von PGP9.5 und Myelin-Basisprotein (MBP)) der Hautbiopsieproben zeigte auf der betroffenen Seite eine signifikant niedrigere epidermale und dermale myelinisierte Faserdichte als auf der nicht betroffenen Seite (3,1 ± 3,3 und 2,1 ± 2,8 vs. 17,2 ± 8,9 und 6,6 ± 5,0 / mm2; p < 0,01, Tabelle 2). Das Verhältnis zwischen epidermalen und dermalen myelinisierten Nervenfasern war auf der betroffenen Seite signifikant niedriger als auf der nicht betroffenen Seite (1,1 ± 1,0 vs. 4.3 ± 5,3; p < 0,01).
Obwohl die ENF-Dichte mit der PHN-Dauer zunahm, erreichte diese Korrelation keine statistische Signifikanz (r: 0,5574, p = 0,09; Abbildung 4).
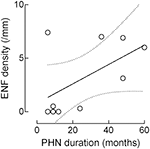
Abbildung 4. Korrelation zwischen epidermaler Nervenfaser (ENF) Dichte und PHN-Dauer. Obwohl die ENF-Dichte mit der PHN-Dauer zunahm, verfehlte diese Korrelation die statistische Signifikanz (epidermale Nervenfaser: r: 0,5574, p = 0,09).
Die Mittelwerte für unmyelinisierte und myelinisierte Nervenfaserdichten auf der nicht betroffenen Seite unterschieden sich nicht von den Kontrollen (epidermale Nervenfaserdichte: 17,2 ± 8,9 /mm vs. 18,9 ± 3,7/mm; dermale myelinisierte Faserdichte: 6,6 ± 5,0/mm vs. 6,7 ± 1,4/mm; p > 0.3, nach Mann-Whitney-Test). Bei den beiden Patienten mit abnormalen C-Faser-vermittelten laser-evozierten Potentialen zeigte die Hautbiopsie jedoch einen epidermalen und einen dermalen myelinisierten Nervenfaserverlust auch auf der nicht betroffenen Seite (0,8 und 3,6 / mm in der nicht betroffenen und 0,0 und 0.3/mm in der betroffenen Seite).
Diskussion
Unsere klinische und morphometrische Studie, die die Innervation der Haut in supraorbitalen Punch-Hautbiopsien mit indirekter Immunfluoreszenz und konfokaler Mikroskopie untersucht, liefert neue Informationen darüber, dass die ophthalmische PHN zwar sowohl epidermale als auch dermale myelinisierte Nervenfasern betrifft, jedoch vorwiegend nicht myelinisierte Nervenfasern schädigt und die autonome Hautinnervation schont.
Die klinische Untersuchung zeigte, dass alle Patienten eine taktile, nadelstichige und warme Hypästhesie hatten. Dementsprechend waren alle drei neurophysiologischen Variablen, die wir aufgezeichnet haben (der Aß-faservermittelte Blinkreflex, Aδ- und C-Laser-evozierte Potentiale) abnormal. Während die klinische Beurteilung und neurophysiologische Tests sowohl myelinisierte als auch nicht myelinisierte Faserschäden zeigten, ergab die Beurteilung der Hautbiopsie, dass sich die PHN-bedingten Schäden an der Hautinnervation in myelinisierten und nicht myelinisierten Fasern unterschieden. Insbesondere deutet das niedrigere unmyelinisierte / myelinisierte Verhältnis auf der betroffenen Seite als auf der nicht betroffenen Spiegelseite auf einen vorherrschenden epidermalen unmyelinisierten Nervenfaserverlust hin. Dieser neue morphometrische Befund stimmt mit früheren Studien überein, die die epidermale Innervation allein untersuchten und einen variablen unmyelinisierten Faserverlust zeigten (Oaklander, 2001; Petersen et al., 2010; Reda et al., 2013). Die vorherrschende unmyelinisierte Nervenfaserbeteiligung, die wir bei Patienten mit PHN beschreiben, passt zu ihren typischerweise anhaltenden Schmerzen. Diese Art von Schmerz spiegelt wahrscheinlich sekundäre neuroplastische Veränderungen und spontane Hyperaktivität in den anatomisch denervierten nozizeptiven Neuronen zweiter Ordnung wider (Truini et al., 2013). Aufgrund der geringen Stichprobe konnten wir mögliche Zusammenhänge zwischen Schmerzen und klinischen, neurophysiologischen und morphologischen Anomalien nicht zuverlässig untersuchen. Diese Frage verdient Untersuchung in einer weiteren Studie Einschreibung mehr Patienten.
In dieser Hautbiopsiestudie mit indirekter Immunfluoreszenz und konfokaler Mikroskopie liefern wir bisher nicht gemeldete detaillierte Informationen zur autonomen Innervation der Haut bei Patienten mit ophthalmischem PHN. Während die autonome Innervation der Schweißdrüsen und der Muskeln des Erector pilorum verschont blieb, beobachteten wir eine schlechte Repräsentation von VIP-IR-Fasern in der oberen Dermis, um Gefäße und Haarfollikel, wo es auch eine schlechte Repräsentation von CGRP und SubP gab. Einige dieser Fasern modulieren die Haarfollikelfunktion und die vasomotorische Kontrolle des Gesichts und können vom sensorischen Trigeminusnerv stammen (Izumi, 1995, 1999). Dieser Ursprung könnte ihre Beteiligung an PHN erklären, während die unbeteiligten sudomotorischen und pilomotorischen VIP-IR-Nervenfasern wahrscheinlich von den oberen zervikalen Sympathikusganglien und von kranialen parasympathischen Nerven stammen, die PHN intakt lässt. Angesichts der Tatsache, dass viele Studien darauf hindeuten, dass das autonome Nervensystem an der Entwicklung von Schmerzen beteiligt sein könnte (Fields et al., 1998) könnte die hier beschriebene autonome Nervenfasersparung die vorgeschlagene indirekte Kopplung zwischen intakten sympathischen postganglionären und geschädigten primären afferenten unmyelinisierten Neuronen unterstützen (Drummond et al., 2014).Bei unseren Patienten mit ophthalmischem PHN zeigten Hautbiopsiebefunde, dass die wenigen überlebenden Axone auf der betroffenen Seite zwischen den Bereichen der denervierten Epidermis gruppiert waren und dass die ENF-Dichte tendenziell mit der Krankheitsdauer zunahm. Diese Beobachtung lässt vermuten, dass die Haut im Laufe der Zeit einen Nervenumbau erfahren könnte. Diese Veränderungen könnten stattfinden, wenn die überlebenden Axone Kollateralen sprießen, um das denervierte Gebiet zu besetzen. Diese anatomische Umgestaltung kann auch eine funktionelle Verbesserung bewirken. Zugegebenermaßen spricht unsere Hypothese, die auf eine partielle Reinnervation im Laufe der Zeit bei Patienten mit ophthalmischem PHN hindeutet, gegen pivotale Studien zur Naturgeschichte des thorakalen PHN (Petersen et al., 2010; Reda et al., 2013). Diese Studien mit funktionellen Maßnahmen und Hautbiopsie schließen daraus, dass auch bei 7,7 Jahren nur eine bescheidene Wiederherstellung der sensorischen Funktion und keine anatomische Erholung trotz Schmerzauflösung bei der Mehrheit der Patienten. Insbesondere die Studie von Reda und Kollegen zeigte, dass, obwohl Schmerzen und die meisten Maßnahmen der sensorischen Funktion, sensorische Symptome und Capsaicin-Reaktion weiterhin einen Trend zur Verbesserung während einer langfristigen Follow-up, viele Probanden immer noch sensorische Anomalien erfahren. Obwohl wir nicht ausschließen können, dass die Zuverlässigkeit unserer Ergebnisse durch die kleine Stichprobe von Patienten beeinflusst werden könnte, Ob das Trigeminus-System, ein eigenartiges Gebiet, ist prädisponierter für die Reinnervation der Haut als andere Körperbereiche bleibt eine interessante Frage für zukünftige Forschung.
Die mittlere epidermale und dermale myelinisierte Faserdichte und ihr Verhältnis auf der nicht betroffenen Spiegelseite unterschieden sich nicht von den Kontrollen. Bei zwei der zehn von uns untersuchten Patienten fehlten jedoch C-Faser-bezogene laser-evozierte Potentiale nach Stimulierung der nicht betroffenen Seite und beide Patienten hatten einen leichten epidermalen Faserverlust, der jedoch bei der nicht betroffenen Seite weniger schwerwiegend war als bei der betroffenen Seite. Dieser Befund steht im Einklang mit früheren klinischen, neurophysiologischen und Hautbiopsiestudien, die bilaterale Nervenfaserschäden zeigten, und stützt die Hypothese, dass PHN gelegentlich eine leichte, subklinische Beteiligung des sensorischen afferenten Signalwegs auf der nicht betroffenen Seite verursachen kann (Haanpää et al., 1997; Oaklander et al., 1998; Truini et al., 2008).Unsere Hautbiopsie-Studie, die zeigt, dass die ophthalmische PHN die epidermalen und dermalen myelinisierten Fasern differentiell beeinflusst und die autonome Hautinnervation schont, liefert neue Informationen zum Verständnis der Mechanismen, die diesem behindernden Zustand zugrunde liegen.
Autorenbeiträge
Interessenkonflikterklärung
Die Autoren erklären, dass die Forschung in Abwesenheit von kommerziellen oder finanziellen Beziehungen durchgeführt wurde, die als potenzieller Interessenkonflikt ausgelegt werden könnten.
Fußnoten
- ^ http://www.ihs-classification.org/_downloads/mixed/International-Headache-Classification-III-ICHD-III-2013-Beta.pdf
Deuschl, G. und Eisen, A. (1999). Reflexe mit langer Latenz nach elektrischer Nervenstimulation. Die internationale Föderation für klinische Neurophysiologie. Elektroenzephalogr. Clin. In: Neurophysiol. Suppl. 52, 263–268.
PubMed Abstract / Google Scholar
Oaklander, A. L. (2001). Die Dichte der verbleibenden Nervenenden in der menschlichen Haut mit und ohne postherpetische Neuralgie nach Gürtelrose. Schmerz 92, 139-145. doi: 10.1016/s0304-3959(00)00481-4
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Leave a Reply