Frontiers in Neuroanatomy
wprowadzenie
oftalmic postherpetic neuralgia (PHN) jest zaburzającym i szeroko badanym stanem bólu neuropatycznego spowodowanym półpaścem i utrzymującym się lub powracającym przez co najmniej 3 miesiące w obszarach zaopatrzonych w okulistyczny oddział nerwu trójdzielnego (Klasyfikacja IHS, 2013).1
badania oceniające unerwienie skóry w próbkach biopsji skóry dostarczyły nowego wglądu w mechanizmy leżące u podstaw bólu neuropatycznego w kilku stanach (Sommer and Lauria, 2007). Biopsja skóry jest małoinwazyjnym narzędziem diagnostycznym służącym do oceny włókien nerwowych w ludzkim naskórku i skórze właściwej. Unerwienie naskórka składa się głównie z niemielinizowanych końcówek włókien C, przy stosunkowo niewielkiej liczbie mielinizowanych włókien Aδ, które tracą osłonkę mielinową i docierają do naskórka jako niemielinizowane wolne zakończenia nerwowe. Odwrotnie, unerwienie skóry składa się głównie z dużych mielinizowanych włókien Aß, które wysyłają gałęzie do ciałek skóry i mieszków włosowych(Nolano et al., 2003, 2013).
większość badań morfometrycznych wykorzystywała immunohistochemię jasnego pola z produktem genów białkowych (PGP) 9,5 i oceniała samo unerwienie naskórka. Podejście oparte na immunofluorescencji i mikroskopii konfokalnej z wykorzystaniem podwójnej i potrójnej immunostaining z obszernym panelem przeciwciał, w tym markera pan-neuronalnego PGP 9.5, marker błony podstawnej, kolagen IV (ColIV) i przeciwciała dla różnych mielinizowanych i niemielinizowanych populacji włókien nerwowych, okazały się dostarczać wyraźnych informacji na temat czuciowych i autonomicznych włókien nerwowych i ewentualnie dokładniej Oceniać unerwienie skóry (Doppler et al., 2012; Nolano et al., 2013).
chociaż wcześniejsze badania biopsji skóry wykazały ciężką utratę włókien nerwowych naskórka (ENF) w dotkniętych dermatomach klatki piersiowej u pacjentów z PHN (Oaklander, 2001; Petersen et al., 2010), nie badali bezpośrednio okulistycznego PHN, ani nie rozróżniali naskórkowych, niemielinizowanych i mielinizowanych włókien skórnych, ani dokładnie szczegółowo opisywali zaangażowanie autonomicznych włókien nerwowych. Posiadanie tych informacji może dokładniej zdefiniować mechanizmy patofizjologiczne leżące u podstaw PHN, co może poprawić sposób diagnozowania i leczenia tego wyjątkowo lekoopornego stanu bólu neuropatycznego.
kontynuując nasze zainteresowania badawcze nad mechanizmami leżącymi u podstaw bólu neuropatycznego w chorobach nerwów obwodowych (Truini et al., 2014), w tym PHN (Truini et al., 2008), w tym badaniu klinicznym i morfometrycznym, którego celem było zbadanie, w jaki sposób okulistyczny PHN wpływa na mielinizowane i niemielinizowane czuciowe i autonomiczne włókna nerwowe skóry. Aby to zrobić, wykonaliśmy biopsje skóry nadoczodołowej o grubości 2 mm od strony dotkniętej chorobą i od strony nienaruszonego lustra u dziesięciu pacjentów z PHN oftalmicznym. Zbadaliśmy próbki skóry z immunofluorescencją pośrednią, zbadaliśmy próbki za pomocą mikroskopii konfokalnej, rozróżniliśmy unerwienie naskórka i unerwienie mielinizowane skóry oraz opisaliśmy zaangażowanie autonomicznych włókien nerwowych.
materiały i metody
zapisaliśmy 10 pacjentów (3 F, 7 M; 74,5 ± 4,4 lat) z okulistycznym PHN na oddział neurologii Uniwersytetu Sapienza w Rzymie. Ophthalmic PHN diagnozowano zgodnie z kryteriami diagnostycznymi International Headache Society: ból utrzymujący się lub powracający przez co najmniej 3 miesiące w obszarze dostarczonym przez okulistyczny podział nerwu trójdzielnego i spowodowany półpaścem. Kryteriami wykluczenia były zaburzenia funkcji poznawczych, inne choroby ośrodkowego i obwodowego układu nerwowego. Żaden pacjent nie był leczony miejscowo lekami przeciwbólowymi (tj., lidokaina i kapsaicyna).
Komisja Rewizyjna zakładu Neurologii Policlinico Umberto I w Rzymie zatwierdziła badanie, a pacjenci wyrazili świadomą zgodę.
ocena kliniczna i Neurofizjologiczna
wszyscy uczestnicy przeszli badanie ogólne i neurologiczne, z pełnym testem sensorycznym, w tym negatywne (dotykowe, opryszczkowe i termiczne hipoestezje) i pozytywne objawy (ciągły ból spontaniczny, ból napadowy) i objawy (mechaniczna dynamiczna allodynia i hiperalgezja). Obecność i nasilenie objawów negatywnych oceniano poprzez porównanie strony dotkniętej chorobą z odbiciem lustrzanym po stronie zdrowej. Nasilenie różnych rodzajów bólu (tj. ciągły ból spontaniczny, ból napadowy, mechaniczna dynamiczna allodynia, hiperalgezja) oceniono na 0-10 numerycznej skali ocen (NRS; 0 = Brak odczucia, 10 = najgorszy możliwy ból).
u wszystkich pacjentów zarejestrowaliśmy odruch mrugania za pośrednictwem mielinizowanego włókna aß, stosując metody zgodne z zaleceniami Międzynarodowej Federacji wytycznych dotyczących Neurofizjologii klinicznej (Deuschl i Eisen, 1999). W celu zbadania funkcji włókien Aδ i C zarejestrowaliśmy potencjały wywołane laserem, zgodnie z wcześniej opisaną techniką (Truini et al., 2008).
biopsja skóry
biopsje skóry po dwóch mm wykonano bezpośrednio nad brwią od strony chorego i nienaruszonego lustra. Rana zagoiła się w ciągu kilku dni bez widocznej blizny (ryc. 1). Próbki skóry przetwarzano technikami immunohistochemicznymi, jak wcześniej opisano (Nolano et al., 2013). Próbki utrwalano przez noc w roztworze Zamboni, krioprotekowano w 20% sacharozie w roztworze soli fizjologicznej buforowanej fosforanem i pocięto na odcinki o grubości 50 µm na zamrażającym mikrotomie (Leica 2000r, Niemcy). Sekcje swobodnie pływające przetwarzano w celu uzyskania pośredniej immunofluorescencji przy użyciu panelu przeciwciałowego do barwienia czuciowych, autonomicznych unerwień skóry i struktur naczyniowych, w tym PGP9.5, peptydu związanego z genem kalcytoniny (CGRP), substancji P (SubP) i wazoaktywnych peptydów jelitowych (VIP) (Tabela 1). Obrazy cyfrowe uzyskano za pomocą Nie laserowej mikroskopii konfokalnej (carv confocal system; ATTO Biosciences, USA i apotome confocal system; Zeiss, Niemcy).
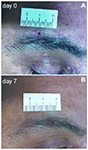
Rysunek 1. Biopsja nadoczodołowa. (A) zdjęcie pacjenta z neuralgią pooperacyjną (PHN) pokazujące 2-mm ranę skórną bezpośrednio po uderzeniu. B) po 1 tygodniu blizna jest słabo widoczna.

Tabela 1. Skrót, źródło i rozcieńczenie markerów immunohistochemicznych.
gęstość ENF oceniano w próbkach biopsji skin punch o grubości 2 mm, stosując oprogramowanie Neurolucida (MicroBrightField Bioscience, USA) do czterech obrazów konfokalnych serii 20× z (przyrost 2 µm × 16), uzyskanych z czterech losowo wybranych sekcji dla każdej próbki. Mielinizowane włókna nerwowe skóry oznaczano ilościowo za pomocą przeciwciał przeciwko białku zasadowemu anty-mielinowemu na całej powierzchni skóry, w tym na głębokości 1 mm od błony podstawnej, w trzech losowych sekcjach dla każdej próbki, zgodnie z wcześniej opublikowaną procedurą (Nolano et al., 2013). Skalibrowana Siatka (2 × 1 mm) z serią siedmiu równoległych linii w równej odległości została zastosowana na cyfrowym, niefokalnym obrazie o powiększeniu 5× oryginalnego powiększenia fragmentów zabarwionych białkiem mielinowym. Policzono wszystkie Przechwyty pomiędzy mielinizowanymi włóknami a liniami siatki. Gęstość mielinizowanych włókien nerwowych skóry obliczono jako liczbę włókien przechwytujących siatkę na obszar skóry (przechwytujących na mm2). Pojedynczy operator ślepo ilościowe włókna nerwowe skóry w każdej próbce. VIP-ir sudomotor nerve length density (nm / mm3)obliczono przy użyciu modułu śledzenia nerwów Autoneeron, będącego częścią oprogramowania Neurolucida , jak opisano wcześniej (Provitera et al., 2014). W celu oceny włókien peptydergicznych (SubP, CGRP i VIP-ir) w podepidermalnym splocie nerwowym, w odległości 100 µm od błony podstawnej, zastosowano punktację półprzezroczystą (0 = Brak włókien, 1 = rzadkie segmenty włókien, krótsze niż 10 µm, 2 = kilka włókien, wypełniających w dużej mierze denerwowaną skórę właściwą, 3 = Normalny, kilka włókien pokrywających większość podepidermalnego splotu nerwowego).
wyniki biopsji skóry u 10 pacjentów porównano z dopasowaną próbką 10 zdrowych osób (gęstość włókien nerwowych naskórka: 18,9 ± 3,7/mm, gęstość włókien mielinizowanych skóry: 6,7 ± 1,4/mm; Nolano i wsp., 2013).
Analiza statystyczna
wszystkie dane są wyrażone jako średnia ± SD. Prawidłowy rozkład gęstości mielinizowanych włókien naskórkowych i skórnych oceniano za pomocą testu normalności D ’ Agostino i Pearson omnibus. Test par dopasowanych Wilcoxona był używany do porównywania zmiennych neurofizjologicznych i biopsji skóry między stronami, które nie uległy zmianie i nie uległy zmianie. Test Manna Whitneya wykorzystano do porównania zmiennych biopsji skóry pomiędzy pacjentami z PHN i prawidłowymi kontrolami. Korelacje między gęstością ENF a czasem trwania PHN obliczono za pomocą współczynnika korelacji R Pearsona. Wartości P mniejsze lub równe 0, 05 uznano za wskazujące na istotność statystyczną.
wyniki
podczas badania klinicznego wszyscy dziesięciu pacjentów skarżyli się na deficyty sensoryczne obejmujące wszystkie cechy sensoryczne i zgłaszali ciągły spontaniczny ból (NRS: 4,3 ± 1,4); pięciu pacjentów skarżyło się również na mechaniczną dynamiczną allodynię (NRS: 3,5 ± 0,7).
badania neurofizjologiczne wykazały poważne nieprawidłowości dotyczące wszystkich badanych zmiennych. U wszystkich pacjentów aß-błonnik pośredniczy odruch mrugania, stymulowanie chorej strony, wywołane nieprawidłowe (opóźnione lub nieobecne) odpowiedzi. Progi percepcji laserowej były wyższe, a amplitudy potencjałów wywołane przez laser Aδ i C były niższe po stymulacji strony dotkniętej chorobą niż po stymulacji strony nienaruszonej (p < 0,05, test Wilcoxona). U 2 z 10 pacjentów potencjały wywołane laserem związane ze stymulacją włókien C były nieobecne również po stronie nienaruszonej (Tabela 2).

Tabela 2. Skrót, źródło i rozcieńczenie markerów immunohistochemicznych.
Analiza immunofluorescencji Konfokalnej wykazała,że unerwienie skóry w biopsjach skóry uderzeniowej nadoczodołowej od pacjentów z PHN różniło się uderzająco między nieuszkodzonymi (Fig.2A,C,E) i dotkniętymi stronami (Fig. 2b,D, F). Podczas gdy próbki biopsji skóry z nienaruszonej strony wykazywały dość gęste i regularne unerwienie, naskórek w dotkniętej stronie wydawał się słabo i nierównomiernie unerwiony skupiskami i długimi ciągami pozbawionymi włókien nerwowych (Fig. 2A-D). Analiza Semiquantitative wykazała, że splot subepidermalny wydawał się słaby i obłąkany i, w porównaniu do strony nienaruszonej, zawierał mniej (p < 0,001) CGRP (1,4 ± 0,8 vs.2,5 ± 0,5), SubP (1,1 ± 0,6 vs. 2,3 ± 0,7) i VIP (1,0 ± 0,7 vs. 2,2 ± 0,5). 0.8) immunoreaktywne (ir) włókna nerwowe. Mieszki włosowe okazały się słabo unerwione z kilkoma niemielinizowanymi i mielinizowanymi włóknami (Fig.2F,E). Utrata mielinizowanych włókien naskórkowych i skórnych wahała się od umiarkowanej do ciężkiej, a 3 z 10 pacjentów miało całkowite odbarwienie skóry. Kilka ocalałych aksonów naskórka było skupionych pomiędzy obszarami denerved naskórka. Mielinizowane włókna wykazywały kilka nieprawidłowości morfologicznych, takich jak fragmentacja, częste występowanie dłuższej niż normalnie długości węzła (7 µm lub dłuższej; Nolano et al., 2003) oraz nieregularności kalibru z powiększeniem i skurczem (zmiana średnicy ponad 100%) w obrębie tej samej międzywęźli. Cechy te rzadko obserwowano po stronie nienaruszonej. W przeciwieństwie do unerwienia czuciowego, oba składniki, adrenergiczne i cholinergiczne, unerwienia autonomicznego do załączników skórnych okazały się względnie zachowane (ryc. 3). Nienaruszone i uszkodzone strony wykazywały liczne włókna cholinergiczne (VIP-IR) sudomotoryczne (ryc. 3C,D) i adrenergiczne (DbH-ir) pilomotoryczne (ryc. 3e,F). Cholinergiczna gęstość sudomotorycznych włókien nerwowych nie różniła się między dotkniętymi (1,9 ± 0.7 nm/mm3) i strona nienaruszona (2,0 ± 0,5 nm/mm3).
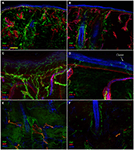
Rysunek 2. Unerwienie skóry. Obrazy konfokalne pokazujące unerwienie skóry w nienaruszonej (A,C,E) i dotkniętej stronie (B,D, F) U reprezentatywnego pacjenta z PHN. Ciężka utrata włókien nerwowych naskórka i skóry jest widoczna w próbkach biopsji skóry z dotkniętej strony (B vs. A). Naskórek w dotkniętej stronie wykazuje długi przewód pozbawiony włókien nerwowych i klastrów włókien nerwowych (d vs. C). Uderzające niemielinizowane i mielinizowane wypadanie włókien nerwowych wokół mieszków włosowych (F vs. E). Pręty: 100 µm w (A, B, E, F); 25 µm w (C,D).
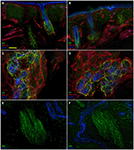
Rysunek 3. Autonomiczne unerwienie skóry. Obrazy konfokalne pokazujące autonomiczne unerwienie skóry w dotkniętych (A, C, E)i nienaruszonych stronach (B,D,F). Górna skóra właściwa wokół mieszków włosowych w dotkniętej stronie zawiera mniej wazoaktywnych włókien immunoreaktywnych peptydów jelitowych (VIP-IR) niż ten sam obszar skóry w nienaruszonej stronie (a VS.B), podczas gdy unerwienie PILOMOTORYCZNE VIP-IR i DbH-IR jest dobrze wyposażone (D i F vs. C i E). Bary: 100 µm w (A,B); 50 µm w (C,D), 25 µm W (E,F).
Analiza ilościowa (w oparciu o analizę PGP9.5 i immunoreaktywności białka zasadowego mieliny (MBP)) próbek biopsji skóry wykazała znacznie mniejszą gęstość mielinizowanych włókien naskórkowych i skórnych po stronie dotkniętej chorobą niż po stronie nienaruszonej (3, 1 ± 3, 3 i 2, 1 ± 2, 8 vs.17, 2 ± 8, 9 i 6, 6 ± 5, 0/mm2; p< 0.01, tabela 2). Stosunek między mielinizowanymi włóknami nerwowymi naskórka i skóry był znacznie niższy u dotkniętych niż po stronie nienaruszonej (1,1 ± 1,0 vs.4.3 ± 5,3; p < 0,01).
chociaż gęstość ENF wzrastała wraz z czasem trwania PHN, korelacja ta nie osiągnęła istotności statystycznej (r: 0,5574, P = 0,09; rycina 4).
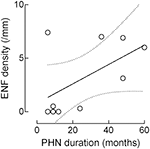
Rysunek 4. Korelacja między gęstością naskórkowego włókna nerwowego (ENF) a czasem trwania PHN. Chociaż gęstość ENF zwiększała się wraz z czasem trwania PHN, korelacja ta nie miała znaczenia statystycznego (naskórkowe włókno nerwowe: r: 0,5574, p = 0,09).
średnie wartości gęstości niemielinizowanych i mielinizowanych włókien nerwowych po stronie nienaruszonej nie różniły się od wartości kontrolnych (gęstość włókien nerwowych naskórka: 17,2 ± 8,9/mm vs.18,9 ± 3,7/mm; gęstość włókien mielinizowanych skóry: 6,6 ± 5,0/mm vs. 6,7 ± 1,4/mm; p > 0.3, by Mann-Whitney test). Jednak u dwóch pacjentów z nieprawidłowym potencjałem wywołanym laserem za pośrednictwem włókien C, biopsja skóry wykazała naskórkową i skórną mielinizowaną utratę włókien nerwowych również po stronie nienaruszonej (0,8 i 3,6/mm w nienaruszonej oraz 0,0 i 0.3 / mm po stronie dotkniętej chorobą).
dyskusja
nasze badanie kliniczne i morfometryczne, oceniające unerwienie skóry w biopsjach skóry z nadoczodołowym uderzeniem za pomocą pośredniej immunofluorescencji i mikroskopii konfokalnej, dostarcza nowych informacji określających, że chociaż okulistyczny PHN wpływa zarówno na naskórkowe, niemielinizowane, jak i mielinizowane włókna nerwowe skóry, to głównie uszkadza niemielinizowane włókna nerwowe i oszczędza autonomiczne unerwienie skóry.
badanie kliniczne wykazało, że wszyscy pacjenci mieli dotyk, pinprick i ciepłą hipoestezję. W związku z tym wszystkie trzy zmienne neurofizjologiczne, które zarejestrowaliśmy (odruch mrugania pośredniczony przez włókna aß, potencjały wywołane laserem Aδ i C) były nieprawidłowe. Podczas gdy ocena kliniczna i testy neurofizjologiczne wykazały zarówno mielinizowane, jak i niemielinizowane uszkodzenia włókien, ocena biopsji skóry wykazała, że związane z PHN uszkodzenia unerwienia skóry różniły się w mielinizowanych i niemielinizowanych włóknach. Mówiąc dokładniej, niższy współczynnik niemielinizacji / mielinizacji w dotkniętej stronie niż w niezmienionej stronie lustra sugeruje dominującą utratę włókien nerwowych naskórka. To nowe odkrycie morfometryczne zgadza się z wcześniejszymi badaniami, które badały samo unerwienie naskórka i wykazały zmienną utratę włókien niemielinizowanych (Oaklander, 2001; Petersen et al., 2010; Reda i in., 2013). Dominujący niemielinizowany udział włókien nerwowych, który opisujemy u pacjentów z PHN, pasuje do ich typowo trwającego bólu. Ten rodzaj bólu prawdopodobnie odzwierciedla wtórne zmiany neuroplastyczne i spontaniczną nadpobudliwość w anatomicznie denervowanych neuronach nocyceptywnych drugiego rzędu (Truini et al., 2013). Ze względu na niewielką próbkę badaną nie mogliśmy wiarygodnie zbadać możliwych korelacji między bólem a nieprawidłowościami klinicznymi, neurofizjologicznymi i morfologicznymi. To pytanie zasługuje na zbadanie w kolejnym badaniu obejmującym więcej pacjentów.
w tym badaniu biopsji skóry, przy użyciu pośredniej immunofluorescencji i mikroskopii konfokalnej, dostarczamy wcześniej nieraportowane szczegółowe informacje na temat unerwienia autonomicznego skóry u pacjentów z okulistycznym PHN. Podczas gdy oszczędzono autonomiczne unerwienie gruczołów potowych i mięśni erector pilorum, zaobserwowaliśmy słabą reprezentację włókien VIP-IR w górnej skórze właściwej, wokół naczyń i mieszków włosowych, gdzie również słaba reprezentacja CGRP i SubP. Niektóre z tych włókien modulują funkcję mieszków włosowych i kontrolę naczynioruchową twarzy i mogą pochodzić z czuciowego nerwu trójdzielnego (Izumi, 1995, 1999). To pochodzenie może wyjaśniać ich udział w PHN, podczas gdy niezaangażowane włókna nerwowe sudomotoryczne i pilomotoryczne VIP-IR prawdopodobnie pochodzą z wyższych zwojów współczulnych szyjki macicy i z nerwów przywspółczulnych czaszki, które PHN pozostawia nienaruszone. Biorąc pod uwagę, że wiele badań sugeruje, że autonomiczny układ nerwowy może uczestniczyć w rozwoju bólu (Fields et al., 1998), autonomiczne oszczędzanie włókien nerwowych, które opisujemy tutaj, może wspierać proponowane pośrednie sprzężenie między nienaruszonymi współczulnymi postganglionicznymi i uszkodzonymi pierwotnymi aferentnymi, niemielinizowanymi neuronami (Drummond et al., 2014).
u naszych pacjentów z okulistycznym PHN wyniki biopsji skóry wykazały, że kilka ocalałych aksonów w dotkniętej stronie było skupionych między obszarami denervated naskórka i że gęstość ENF miała tendencję do zwiększania się wraz z czasem trwania choroby. Ta obserwacja prowadzi nas do domysłów, że skóra może ulec przebudowie nerwów w czasie. Zmiany te mogą mieć miejsce, gdy ocalałe aksony wyrastają z zabezpieczeń, próbując zająć denerwowane terytorium. Ta anatomiczna przebudowa może również przynieść pewną poprawę funkcjonalną. Co prawda, nasza hipoteza sugerująca częściową reinerwację w czasie u pacjentów z okulistycznym PHN argumentuje przeciwko kluczowym badaniom zajmującym się historią naturalną thoracic PHN(Petersen et al., 2010; Reda i in., 2013). Badania te z wykorzystaniem środków funkcjonalnych i biopsji skóry wskazują, że nawet w wieku 7,7 lat następuje jedynie nieznaczne odzyskanie funkcji sensorycznych i brak regeneracji anatomicznej pomimo ustąpienia bólu u większości pacjentów. W szczególności badanie przeprowadzone przez Redę i współpracowników wykazało, że chociaż ból i większość miar funkcji sensorycznych, objawy sensoryczne i odpowiedź kapsaicyny kontynuowały tendencję do poprawy podczas długotrwałej obserwacji, wielu pacjentów nadal doświadczało zaburzeń sensorycznych. Chociaż nie możemy wykluczyć, że na wiarygodność naszych wyników może mieć wpływ niewielka próbka pacjentów, to czy układ trójdzielny, osobliwy obszar, jest bardziej predysponowany do reinerwacji skóry niż inne obszary ciała, pozostaje ciekawym pytaniem do przyszłych badań.
średnia gęstość włókien mielinizowanych naskórka i skóry oraz ich stosunek w nienaruszonej stronie lustra nie różniły się od kontroli. Jednak u dwóch z dziesięciu pacjentów, których badaliśmy, potencjały wywołane laserem związane z włóknem C były nieobecne po stymulowaniu nienaruszonej strony, a obaj pacjenci mieli łagodną utratę włókien naskórkowych, choć mniej poważną w nienaruszonej stronie niż w dotkniętej stronie. To odkrycie jest zgodne z wcześniejszymi badaniami klinicznymi, neurofizjologicznymi i biopsją skóry wykazującymi obustronne uszkodzenie włókien nerwowych i wspiera hipotezę, że PHN może czasami powodować łagodne, subkliniczne zaangażowanie SENSORYCZNEGO szlaku aferentnego po stronie nienaruszonej (Haanpää et al., 1997; Oaklander et al., 1998; Truini et al., 2008).
nasze badanie biopsji skóry pokazujące, że okulistyczny PHN w różny sposób wpływa na mielinizowane włókna naskórkowe i skórne i oszczędza unerwienie skóry autonomicznej, dostarcza nowych informacji do zrozumienia mechanizmów leżących u podstaw tego schorzenia.
wkład autora
Oświadczenie o konflikcie interesów
autorzy oświadczają, że badania zostały przeprowadzone przy braku jakichkolwiek relacji handlowych lub finansowych, które mogłyby być interpretowane jako potencjalny konflikt interesów.
Przypisy
- ^ http://www.ihs-classification.org/_downloads/mixed/International-Headache-Classification-III-ICHD-III-2013-Beta.pdf
Deuschl, G., and Eisen, A. (1999). Odruchy z długim opóźnieniem po elektrycznej stymulacji nerwów. Międzynarodowa Federacja neurofizjologii klinicznej. Elektroencefalogr. Clin. Neurofizjol. Suppl. 52, 263–268.
PubMed Abstrakt | Google Scholar
Oaklander, A. L. (2001). Gęstość pozostałych zakończeń nerwowych w skórze człowieka z i bez neuralgii po półpaścu. Ból 92, 139-145. doi: 10.1016/S0304-3959(00)00481-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Leave a Reply