ero yksittäisten kaksois-ja Kolmoissidosten välillä
tärkein ero-yksi-vs kaksois-vs Kolmoissidokset
kemialliset sidokset pitävät molekyylin atomit yhdessä muodostamalla kahden atomin elektronien ja ytimien väliset voimat. Kemiallisia reaktioita hallitaan muodostamalla tai katkaisemalla kemiallisia sidoksia. On olemassa erilaisia sidoksia, kuten kovalenttisia, ionisia, van der Waalin jne. Sidosten Ominaisuudet vaihtelevat eri seikkojen, kuten molekyylin luonteen, kiinteän tyypin (kiteinen tai amorfinen) jne.mukaan. Kovalenttiset sidokset muodostuvat jakamalla kaksi tai useampia elektroneja. Atomien välisen jaetun elektronin määrä määrää sidosten määrän; onko se yksi -, kaksin-tai kolminkertainen. Näin ollen yksi -, kaksois-ja kolmoissidokset ovat kovalenttisia sidoksia. Tärkein ero yhden kaksois-ja kolmoissidoksen välillä on jaettujen elektronien määrä. Jos jaettu luku on yksi elektronipari, sidos on yksittäinen sidos, kun taas jos kaksi atomia yhdistyy kahdella parilla (neljä elektronia), se muodostaa kaksoissidoksen. Kolmoissidokset muodostuvat jakamalla kolme paria (kuusi atomia) elektroneja. Näitä jakavia elektroneja kutsutaan yleisesti valenssielektroneiksi. Tässä artikkelissa tarkastellaan,
1. Mikä on yksittäinen Bond?
– määritelmä, ominaisuudet, esimerkit
2. Mikä on kaksoissidos?
– määritelmä, ominaisuudet, esimerkit
3. Mikä on kolmoissidos?
– määritelmä, ominaisuudet, esimerkit
4. Mitä eroa on yhden kaksois-ja Kolmoissidosten välillä?
mikä on yksittäinen sidos
yksittäinen sidos muodostuu jakamalla yksi valenssielektronipari kahden vierekkäisen atomin kesken. Yksittäinen sidos on kovalenttisen sidoksen yksinkertaisin muoto, jossa jokaisesta atomista saadaan yksi valenssielektroni. Nämä valenssielektronit sijaitsevat atomien uloimmassa kuoressa. Tässä negatiivisesti varautuneita jaettuja elektroneja vetävät atomien positiivisesti varautuneet ytimet. Nämä vetävät voimat pitävät atomit koossa. Tämä järjestely tunnetaan yhtenä joukkovelkakirjana. Molekyylit, joissa on yksi sidos, ovat vähemmän reaktiivisia toisin kuin molekyylit, joissa on useita sidoksia. Lisäksi ne ovat monisidoksia heikompia ja niiden sidosten pituudet ovat korkeampia, koska atomien välinen vetävä voima on pieni verrattuna monisidoksiin. Yksi sidos merkitään vain yhdellä viivalla; esim: C C. alkaanit kuten metaani, etaani, propaani ovat joitakin esimerkkejä yhdisteistä, joissa on yksi sidos.
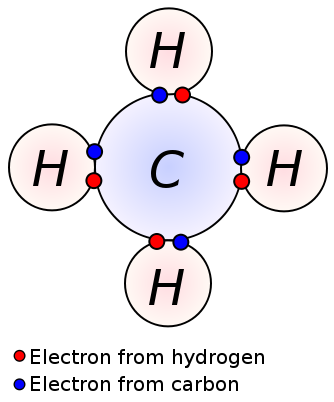
metaani
mikä on kaksoissidos
kaksoissidos muodostuu jakamalla kaksi paria atomien uloimmalla kiertoradalla sijaitsevia valenssielektroneja. Kaksoissidoksia sisältävät yhdisteet ovat hyvin reaktiivisia kuin yksisidoksiset yhdisteet, mutta vähemmän reaktiivisia kuin kolmoissidoksia sisältävät yhdisteet. Kaksoissidoksia merkitään kahdella rinnakkaisella viivalla; esim: C=C. Joitakin esimerkkejä kaksoissidoksia sisältävistä yhdisteistä ovat alkeenit kuten eteeni, Propeeni, karbonyyliyhdisteet (C=O), atsoyhdisteet (N=n), imiinit (C=n) ja sulfoksidit (s=O).
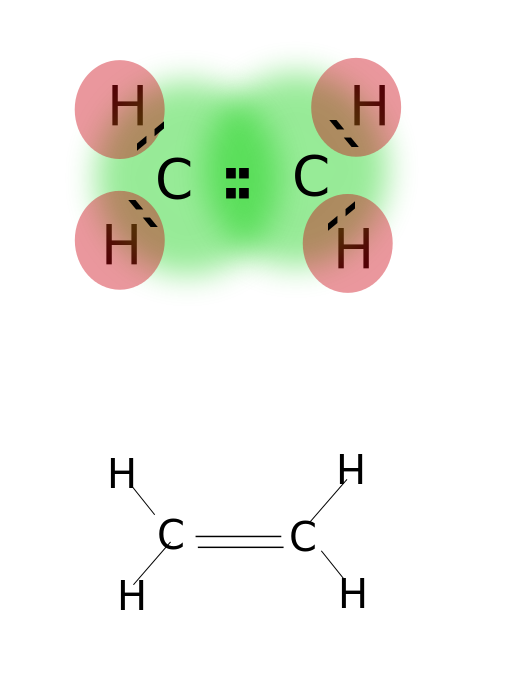
eteeni
mikä on kolmoissidos
kun kahdella atomilla on kolme paria valenssielektroneja (kuusi valenssielektronia), vakiintuneita sidoksia kutsutaan kolmoissidoksiksi. Kolmoissidokset ovat vahvimpia ja reaktiivisimpia kovalenttisia sidoksia. Yksi-ja kaksoissidoksiin verrattuna kolmoissidoksilla on pienin sidoksen pituus johtuen suuremmasta vetovoimasta kahden atomin välillä. Kolmoissidosta merkitään kolmella rinnakkaisella juovalla kahden atomin välillä; ex: C≡C. joitakin esimerkkejä kolmoissidoksia sisältävistä yhdisteistä ovat typpikaasu (N≡N), syanidi-ioni (C≡n), asetyleeni (CH≡CH) ja hiilimonoksidi (C≡O).
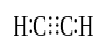
asetyleeni
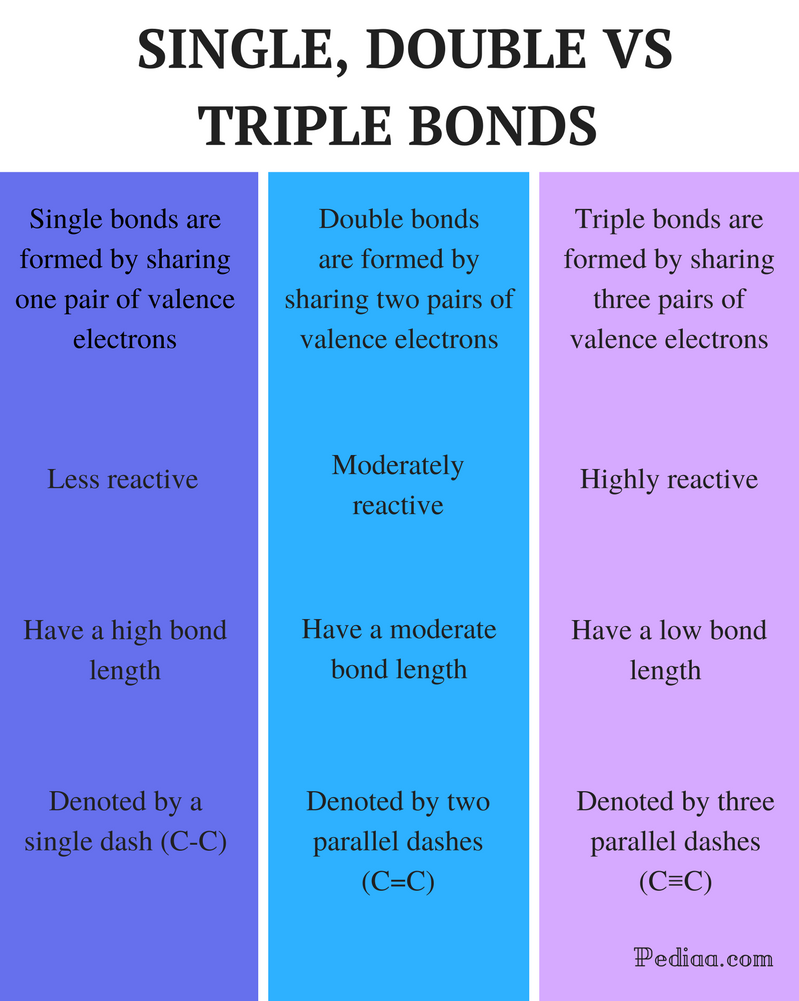
yhden kaksois-ja kolmoissidoksen ero
määritelmä:
yhden kaksois-ja kolmoissidoksen ero: Yksi sidos muodostuu jakamalla yksi valenssielektronipari.
kaksoissidos: kaksoissidos muodostuu jakamalla kaksi paria valenssielektroneja.
kolmoissidos: kolmoissidos muodostuu jakamalla kolme paria valenssielektroneja.
reaktiivisuus:
Yksisidos: yksittäiset sidokset ovat vähemmän reaktiivisia.
kaksoissidos: kaksoissidokset ovat kohtalaisen reaktiivisia.
kolmoissidos: Kolmoissidokset ovat hyvin reaktiivisia.
joukkovelkakirjalainan pituus:
Single Bond: yksittäisillä joukkovelkakirjalainoilla on suuri joukkovelkakirjalainan pituus.
kaksoissidos: Kaksoissidoksilla on kohtalainen sidoksen pituus.
kolmoissidos: Kolmoissidoksilla on alhainen sidoslujuus.
merkitään:
Single Bond: yksittäisiä joukkovelkakirjoja merkitään yhdellä viivalla (C-C).
kaksoissidos: kaksoissidoksia merkitään kahdella rinnakkaisella viivalla (C=C).
kolmoissidos: kolmoissidoksia merkitään kolmella rinnakkaisella viivalla (C≡C).
esimerkkejä:
yksittäinen sidos: esimerkkejä ovat alkaanit kuten metaani, etaani, propaani, butaani jne.
kaksoissidos: esimerkkejä ovat eteeni, Propeeni, karbonyyliyhdisteet (C=O), atsoyhdisteet (N=n), imiinit (C=N) ja sulfoksidit (s=O).
kolmoissidos: Esimerkkejä ovat typpikaasu (N≡N), syanidi-ioni (C≡n), asetyleeni (CH≡CH) ja hiilimonoksidi (C≡O).
![]()
Leave a Reply