Frontiers in Neuroanatomy
Introduction
La névralgie post-herpétique ophtalmique (NSP) est une affection douloureuse neuropathique invalidante et largement étudiée causée par le zona et persistante ou récurrente pendant au moins 3 mois dans les zones alimentées par la division ophtalmique du nerf trijumeau (Classification IHS, 2013).1
Des études évaluant l’innervation cutanée dans des échantillons de biopsie cutanée ont permis de mieux comprendre les mécanismes sous-jacents à la douleur neuropathique dans plusieurs conditions (Sommer et Lauria, 2007). La biopsie cutanée est un outil de diagnostic peu invasif utilisé pour évaluer les fibres nerveuses de l’épiderme et du derme humains. L’innervation épidermique se compose principalement de terminaisons de fibres C non myélinisées, avec relativement peu de petites fibres Aδ myélinisées qui perdent leur gaine de myéline et atteignent l’épiderme sous forme de terminaisons nerveuses libres non myélinisées. Inversement, l’innervation cutanée consiste principalement en de grandes fibres Aß myélinisées qui envoient des branches aux corpuscules dermiques et aux follicules pileux (Nolano et al., 2003, 2013).
La plupart des études morphométriques ont utilisé l’immunohistochimie à champ lumineux avec le produit de gène protéique (PGP) 9.5 immunocoloration et ont évalué l’innervation épidermique seule. Une approche basée sur l’immunofluorescence et la microscopie confocale utilisant une double et triple immunomarquage avec un panel étendu d’anticorps dont le marqueur pan-neuronal PGP 9.5, le marqueur de la membrane basale, le collagène IV (ColIV), et des anticorps pour diverses populations de fibres nerveuses myélinisées et non myélinisées, s’est avéré fournir des informations distinctes sur les fibres nerveuses sensorielles et autonomes, et peut-être évaluer plus précisément l’innervation de la peau (Doppler et al., 2012; Nolano et coll., 2013).
Bien que des études de biopsie cutanée antérieures aient montré une perte sévère de fibres nerveuses épidermiques (ENF) dans les dermatomes thoraciques affectés de patients atteints de PHN (Oaklander, 2001; Petersen et al., 2010), ils n’ont pas étudié directement le PHN ophtalmique, ni distingué les fibres épidermiques non myélinisées et les fibres myélinisées dermiques, ni détaillé avec précision l’implication des fibres nerveuses autonomes. Disposer de ces informations pourrait définir plus précisément les mécanismes physiopathologiques sous-jacents au NSP, améliorant ainsi peut-être la façon dont nous diagnostiquons et guérissons cette douleur neuropathique exceptionnellement résistante aux médicaments.
Poursuivre notre intérêt de recherche sur les mécanismes sous-jacents à la douleur neuropathique dans les maladies nerveuses périphériques (Truini et al., 2014), y compris PHN (Truini et al., 2008), dans cette étude clinique et morphométrique, nous avons cherché à étudier comment le PHN ophtalmique affecte les fibres nerveuses sensorielles et autonomes de la peau myélinisées et non myélinisées. Pour ce faire, nous avons prélevé des biopsies cutanées supra-orbitales de 2 mm du côté affecté et du côté du miroir non affecté chez dix patients atteints de PHN ophtalmique. Nous avons traité les échantillons de peau par immunofluorescence indirecte, examiné les échantillons par microscopie confocale, distingué l’innervation épidermique non myélinisée et myélinisée cutanée et décrit l’atteinte des fibres nerveuses autonomes.
Matériaux et méthodes
Nous avons inscrit 10 patients (3 F, 7 M; 74,5 ± 4,4 ans) avec PHN ophtalmique au Département de neurologie de l’Université Sapienza, Rome. Le PHN ophtalmique a été diagnostiqué conformément aux critères diagnostiques de l’International Headache Society: douleur persistante ou récurrente pendant au moins 3 mois dans la zone fournie par la division ophtalmique du nerf trijumeau, et causée par le zona. Les critères d’exclusion étaient les troubles cognitifs, d’autres maladies du système nerveux central et périphérique. Aucun patient n’a été traité avec des analgésiques topiques (p. ex., lidocaïne et capsaïcine).
Le Conseil d’examen institutionnel du Département de Neurologie, Policlinico Umerto I, Rome, a approuvé l’étude et les patients ont donné leur consentement éclairé.
Évaluation clinique et neurophysiologique
Tous les participants ont subi un examen général et un examen neurologique, avec des tests sensoriels complets comprenant des symptômes négatifs (hypoesthésie tactile, piqûre d’épingle et thermique) et positifs (douleur spontanée continue, douleur paroxystique) et des signes (allodynie dynamique mécanique et hyperalgésie piqûre d’épingle). La présence et la gravité des symptômes négatifs ont été évaluées en comparant le côté affecté avec l’image miroir du côté sain. La gravité des différents types de douleur (c.-à-d. douleur spontanée continue, douleur paroxystique, allodynie dynamique mécanique, hyperalgésie de piqûre d’épingle) a été évaluée sur une échelle numérique de 0 à 10 (NRS; 0 = pas de sensation, 10 = douleur la plus grave possible).
Chez tous les patients, nous avons enregistré le réflexe de clignement médié par des fibres myélinisées Aß, avec des méthodes respectant les recommandations des directives de la Fédération Internationale de Neurophysiologie clinique (Deuschl et Eisen, 1999). Pour étudier la fonction des fibres Aδ et C, nous avons enregistré des potentiels évoqués au laser, selon une technique précédemment rapportée (Truini et al., 2008).
Biopsie cutanée
Des biopsies cutanées de deux mm ont été prélevées immédiatement au-dessus du sourcil du côté du miroir affecté et non affecté. La plaie a guéri en quelques jours sans cicatrice visible (Figure 1). Des échantillons de peau ont été traités avec des techniques immunohistochimiques, comme décrit précédemment (Nolano et al., 2013). Des échantillons ont été fixés pendant une nuit dans une solution de Zamboni, cryoprotégés dans du saccharose à 20% dans une solution saline tamponnée au phosphate et découpés en sections de 50 µm d’épaisseur sur un microtome de congélation (Leica 2000R, Allemagne). Des sections flottantes ont été traitées pour l’immunofluorescence indirecte en utilisant un panel d’anticorps pour colorer l’innervation sensorielle et autonome de la peau et les structures vasculaires, y compris PGP9.5, le peptide lié au gène de la calcitonine (CGRP), la substance P (SubP) et les anticorps du peptide intestinal vasoactif (VIP) (tableau 1). Les images numériques ont été acquises en microscopie confocale non laser (système confocal CARV; ATTO Biosciences, États-Unis et système confocal Apotome; Zeiss, Allemagne).
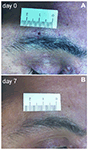
Figure 1. Biopsie cutanée à poinçon supraorbital de deux mm. (A) Photographie d’un patient atteint de névralgie post-herpétique (NSP) montrant la plaie cutanée de 2 mm immédiatement après le coup de poing. (B) Après 1 semaine, la cicatrice est à peine visible.

Tableau 1. Abréviation, source et dilution des marqueurs immunohistochimiques.
La densité ENF a été évaluée dans les échantillons de biopsie par perforation cutanée de 2 mm en appliquant le logiciel Neurolucida (MicroBrightField Bioscience, États-Unis) à quatre images confocales de la série 20× z (incréments de 2 µm × 16), obtenues à partir de quatre sections sélectionnées au hasard pour chaque échantillon. Les fibres nerveuses myélinisées dermiques ont été quantifiées à l’aide d’anticorps anti-protéines basiques de la myéline sur toute la surface dermique, y compris à 1 mm de profondeur de la membrane basale, en trois sections aléatoires pour chaque échantillon, selon la procédure publiée précédemment (Nolano et al., 2013). Une grille calibrée (2 × 1 mm) avec une série de sept lignes parallèles équidistantes a été appliquée sur une image numérique non confocale à grossissement original de 5× de sections colorées en protéines de base de la myéline. Toutes les interceptions entre les fibres myélinisées et les lignes de la grille ont été comptées. La densité des fibres nerveuses myélinisées dermiques a été calculée comme le nombre de fibres interceptant la grille par zone cutanée (interceptions par mm2). Un seul opérateur a quantifié aveuglément les fibres nerveuses de la peau dans chaque échantillon. La densité de longueur du nerf sudomoteur VIP-ir (nm / mm3) a été calculée à l’aide du module de traçage nerveux Autoneuron, une partie du logiciel Neurolucida, comme décrit précédemment (Provitera et al., 2014). Pour évaluer les fibres peptidergiques (SubP, CGRP et VIP-ir) dans le plexus neural sous-épidermique, à moins de 100 µm de la membrane basale, un score semi-quantitatif a été appliqué (0 = absence de fibres, 1 = segments de fibres rares, plus courts que 10 µm, 2 = peu de fibres, peuplant un derme largement dénervé, 3 = normal, plusieurs fibres recouvrant la majeure partie du plexus neural sous-épidermique).
Les résultats d’une biopsie cutanée chez les 10 patients ont été comparés à un échantillon apparié de 10 sujets sains (densité de fibres nerveuses épidermiques: 18,9 ± 3,7/mm, densité de fibres myélinisées dermiques: 6,7 ± 1,4/mm; Nolano et al., 2013).
Analyse statistique
Toutes les données sont exprimées en moyenne ± SD. La distribution normale de la densité des fibres myélinisées épidermiques et dermiques a été évaluée à l’aide du test de normalité omnibus D’Agostino et de Pearson. Le test de paires appariées de Wilcoxon a été utilisé pour comparer les variables neurophysiologiques et de biopsie cutanée entre les côtés non affectés et affectés. Le test de Mann Whitney a été utilisé pour comparer les variables de biopsie cutanée entre les patients atteints de NSP et les témoins normaux. Les corrélations entre la densité ENF et la durée du PHN ont été calculées avec le coefficient de corrélation r de Pearson. Les valeurs de P inférieures ou égales à 0,05 ont été considérées comme indiquant une signification statistique.
Résultats
À l’examen clinique, les dix patients se sont plaints de déficits sensoriels impliquant toutes les modalités sensorielles et ont signalé une douleur spontanée continue (NRS: 4,3 ± 1,4); cinq patients se sont également plaints d’une allodynie dynamique mécanique (NRS: 3,5 ± 0,7).
Les tests neurophysiologiques ont révélé des anomalies graves impliquant toutes les variables testées. Chez tous les patients, un réflexe de clignement médié par les fibres Aß, stimulant le côté affecté, a provoqué des réponses anormales (retardées ou absentes). Les seuils de perception laser étaient plus élevés et les amplitudes potentielles évoquées par les lasers Aδ et C étaient plus faibles après stimulation du côté affecté qu’après stimulation du côté non affecté (p < 0,05, test de Wilcoxon). Chez 2 des 10 patients, les potentiels évoqués au laser liés à la stimulation par la fibre C étaient absents également du côté non affecté (tableau 2).

Tableau 2. Abréviation, source et dilution des marqueurs immunohistochimiques.
L’analyse d’immunofluorescence confocale a montré que l’innervation cutanée dans les biopsies cutanées de perforation supraorbitale de patients atteints de NSP différait de manière frappante entre les côtés non affectés (Figures 2A, C, E) et affectés (Figures 2B, D, F). Alors que les échantillons de biopsie cutanée du côté non affecté présentaient une innervation assez dense et régulière, l’épiderme du côté affecté apparaissait mal et inégalement innervé avec des grappes et de longues voies dépourvues de fibres nerveuses (Figures 2A–D). L’analyse semi-quantitative a montré que le plexus sous-épidermique semblait pauvre et dérangé et, comparé au côté non affecté, contenait moins (p < 0,001) CGRP (1,4 ± 0,8 vs 2,5 ± 0,5), SubP (1,1 ± 0,6 vs 2,3 ± 0,7) et VIP (1,0 ± 0,7 vs 2,2 ± 0,8 ) fibres nerveuses immunoréactives (IR). Les follicules pileux sont apparus mal innervés avec peu de fibres non myélinisées et myélinisées (Figures 2F, E). La perte de fibres myélinisées épidermiques et dermiques variait de modérée à sévère et 3 des 10 patients présentaient une dénervation complète de la peau. Les quelques axones épidermiques survivants étaient regroupés entre des zones de l’épiderme dénervé. Les fibres myélinisées ont montré plusieurs anomalies morphologiques, telles que la fragmentation, l’apparition fréquente d’une longueur nodale plus longue que la normale (7 µm ou plus; Nolano et al., 2003), et des irrégularités de calibre avec élargissement et retrait (changement de diamètre supérieur à 100%) au sein d’un même entre-nœud. Ces caractéristiques ont rarement été observées du côté non affecté. Contrairement à l’innervation sensorielle, les deux composants, adrénergiques et cholinergiques, de l’innervation autonome des annexes dermiques sont apparus relativement préservés (Figure 3). Les côtés non affectés et affectés présentaient de nombreuses fibres cholinergiques (VIP-ir) sudomotrices (Figures 3C, D) et adrénergiques (DbH-ir) pilomotrices (Figures 3E, F). La densité des fibres nerveuses sudomotrices cholinergiques ne différait pas entre les personnes touchées (1,9 ± 0.7 nm/mm3) et côté non affecté (2,0 ± 0,5 nm/mm3).
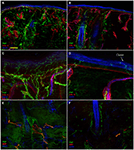
Figure 2. Innervation de la peau. Images confocales montrant une innervation cutanée du côté non affecté (A, C, E) et affecté (B, D, F) chez un patient représentatif atteint de NSP. Une perte sévère de fibres nerveuses épidermiques et dermiques est visible dans les échantillons de biopsie cutanée du côté affecté (B vs A). L’épiderme du côté affecté présente un long tractus dépourvu de fibres nerveuses et d’amas de fibres nerveuses (D vs C). Perte frappante de fibres nerveuses non myélinisées et myélinisées autour des follicules pileux (F vs E). Barres : 100 µm (A, B, E, F); 25 µm (C, D).
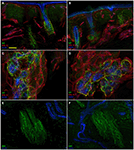
Figure 3. Innervation cutanée autonome. Images confocales montrant une innervation autonome des annexes dermiques du côté affecté (A, C, E) et non affecté (B, D, F). Le derme supérieur autour des follicules pileux du côté affecté contient moins de fibres peptide-immunoréactives intestinales vasoactives (VIP-IR) que la même zone cutanée du côté non affecté (A vs B), tandis que l’innervation pilomotrice VIP-ir et DbH-ir est bien dotée (D et F vs C et E). Bars: 100 µm en (A, B); 50 µm en (C, D), 25 µm en (E, F).
L’analyse quantitative (basée sur l’analyse de l’immunoréactivité de la protéine PGP9.5 et de la protéine de base de la myéline (MBP)) des échantillons de biopsie cutanée a montré une densité de fibres myélinisées épidermiques et dermiques significativement plus faible du côté affecté que du côté non affecté (3,1 ± 3,3 et 2,1 ± 2,8 contre 17,2 ± 8,9 et 6,6 ± 5,0 / mm2;p < 0.01, Tableau 2). Le rapport entre les fibres nerveuses myélinisées épidermiques et dermiques était significativement plus faible chez le côté affecté que chez le côté non affecté (1,1 ± 1,0 vs. 4.3 ± 5,3; p < 0,01).
Bien que la densité ENF augmente avec la durée du PHN, cette corrélation n’atteint pas la signification statistique (r : 0,5574, p = 0,09; Figure 4).
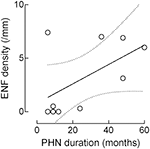
Figure 4. Corrélation entre la densité des fibres nerveuses épidermiques (ENF) et la durée du PHN. Bien que la densité ENF augmente avec la durée du PHN, cette corrélation manque de signification statistique (fibre nerveuse épidermique : r: 0,5574, p = 0,09).
Les valeurs moyennes des densités de fibres nerveuses non myélinisées et myélinisées du côté non affecté ne différaient pas des témoins (densité de fibres nerveuses épidermiques: 17,2 ± 8,9/mm vs 18,9 ± 3,7/mm; densité de fibres myélinisées cutanées: 6,6 ± 5,0/mm vs 6,7 ± 1,4/mm; p > 0.3, par test de Mann-Whitney). Cependant, chez les deux patients présentant des potentiels évoqués au laser anormaux médiés par la fibre C, une biopsie cutanée a montré une perte de fibres nerveuses myélinisées épidermiques et dermiques également du côté non affecté (0,8 et 3,6 / mm chez le côté non affecté et 0,0 et 0.3/mm du côté affecté).
Discussion
Notre étude clinique et morphométrique, évaluant l’innervation de la peau dans des biopsies cutanées supra-orbitales avec immunofluorescence indirecte et microscopie confocale, fournit de nouvelles informations précisant que, bien que le PHN ophtalmique affecte à la fois les fibres nerveuses non myélinisées épidermiques et myélinisées cutanées, il endommage principalement les fibres nerveuses non myélinisées et épargne l’innervation cutanée autonome.
L’examen clinique a montré que tous les patients présentaient une hypoesthésie tactile, une piqûre d’épingle et une hypoesthésie chaude. En conséquence, les trois variables neurophysiologiques que nous avons enregistrées (le réflexe de clignotement médié par la fibre Aß, les potentiels évoqués par les lasers Aδ et C) étaient anormaux. Alors que l’évaluation clinique et les tests neurophysiologiques ont montré des dommages aux fibres myélinisées et non myélinisées, l’évaluation par biopsie cutanée a précisé que les dommages liés au PHN à l’innervation cutanée différaient dans les fibres myélinisées et non myélinisées. Plus précisément, le rapport non myélinisé / myélinisé plus faible du côté affecté que du côté non affecté du miroir suggère une perte prédominante de fibres nerveuses non myélinisées épidermiques. Cette nouvelle découverte morphométrique est en accord avec les études précédentes qui ont étudié l’innervation épidermique seule et ont montré une perte variable de fibres non myélinisées (Oaklander, 2001; Petersen et al., 2010; Reda et coll., 2013). L’atteinte prédominante des fibres nerveuses non myélinisées que nous décrivons chez les patients atteints de NSP correspond à leur douleur généralement persistante. Ce type de douleur reflète probablement des modifications neuroplastiques secondaires et une hyperactivité spontanée dans les neurones nociceptifs du second ordre dénervés anatomiquement (Truini et al., 2013). En raison du petit échantillon de l’étude, nous n’avons pas pu étudier de manière fiable les corrélations possibles entre la douleur et les anomalies cliniques, neurophysiologiques et morphologiques. Cette question mérite d’être étudiée dans une autre étude recrutant plus de patients.
Dans cette étude de biopsie cutanée, utilisant l’immunofluorescence indirecte et la microscopie confocale, nous fournissons des informations détaillées non rapportées précédemment sur l’innervation autonome de la peau chez les patients atteints de PHN ophtalmique. Alors que l’innervation autonome des glandes sudoripares et des muscles érecteurs du pilorum a été épargnée, nous avons observé une mauvaise représentation des fibres VIP-IR dans le derme supérieur, autour des vaisseaux et des follicules pileux, où il y avait également une mauvaise représentation du CGRP et du SubP. Certaines de ces fibres modulent la fonction du follicule pileux et le contrôle vasomoteur facial, et peuvent provenir du nerf trijumeau sensoriel (Izumi, 1995, 1999). Cette origine peut expliquer leur implication dans le PHN alors que les fibres nerveuses VIP-IR sudomotrices et pilomotrices non impliquées proviennent probablement des ganglions sympathiques cervicaux supérieurs et des nerfs parasympathiques crâniens que le PHN laisse intacts. Étant donné que de nombreuses études suggèrent que le système nerveux autonome pourrait participer au développement de la douleur (Fields et al., 1998), la fibre nerveuse autonome épargnée que nous décrivons ici pourrait soutenir le couplage indirect proposé entre les neurones sympathiques postganglionnaires intacts et les neurones afférents primaires non myélinisés endommagés (Drummond et al., 2014).
Chez nos patients atteints d’une biopsie cutanée par PHN ophtalmique, les résultats ont montré que les quelques axones survivants du côté affecté étaient regroupés entre les zones de l’épiderme dénervé et que la densité ENF avait tendance à augmenter avec la durée de la maladie. Cette observation nous amène à conjecturer que la peau pourrait subir un remodelage nerveux au fil du temps. Ces changements pourraient avoir lieu lorsque les axones survivants poussent des collatéraux dans le but d’occuper le territoire dénervé. Ce remodelage anatomique peut également apporter une certaine amélioration fonctionnelle. Certes, notre hypothèse suggérant une réinnervation partielle dans le temps chez des patients atteints de NSP ophtalmique s’oppose à des études pivots portant sur l’histoire naturelle de la NSP thoracique (Petersen et al., 2010; Reda et coll., 2013). Ces études utilisant des mesures fonctionnelles et une biopsie cutanée concluent que même à 7,7 ans, il n’y a qu’une récupération modeste de la fonction sensorielle et aucune récupération anatomique malgré la résolution de la douleur chez la majorité des patients. En particulier, l’étude menée par Reda et ses collègues a montré que bien que la douleur et la plupart des mesures de la fonction sensorielle, des symptômes sensoriels et de la réponse à la capsaïcine aient continué à s’améliorer au cours d’un suivi à long terme, de nombreux sujets présentaient encore des anomalies sensorielles. Bien que nous ne puissions exclure que la fiabilité de nos résultats puisse être influencée par le petit échantillon de patients, la question de savoir si le système trijumeau, un territoire particulier, est plus prédisposé à la réinnervation cutanée que d’autres zones du corps reste une question intéressante pour de futures recherches.
La densité moyenne des fibres myélinisées épidermiques et dermiques et leur rapport dans le côté du miroir non affecté ne différaient pas des témoins. Cependant, chez deux des dix patients que nous avons étudiés, les potentiels évoqués par laser liés à la fibre C étaient absents après avoir stimulé le côté non affecté et les deux patients présentaient une légère perte de fibres épidermiques, bien que moins grave chez le côté non affecté que chez le côté affecté. Cette découverte est conforme aux études cliniques, neurophysiologiques et de biopsie cutanée antérieures montrant des lésions bilatérales des fibres nerveuses et soutient l’hypothèse selon laquelle le PHN peut occasionnellement provoquer une atteinte légère de la voie afférente sensorielle subclinique du côté non affecté (Haanpää et al., 1997; Oaklander et coll., 1998; Truini et coll., 2008).
Notre étude de biopsie cutanée montrant que le PHN ophtalmique affecte différemment les fibres myélinisées épidermiques et dermiques et épargne l’innervation autonome de la peau fournit de nouvelles informations pour comprendre les mécanismes sous-jacents à cette condition invalidante.
Contributions des auteurs
Déclaration sur les conflits d’intérêts
Les auteurs déclarent que la recherche a été menée en l’absence de relations commerciales ou financières pouvant être interprétées comme un conflit d’intérêts potentiel.
Notes de bas de page
- ^http://www.ihs-classification.org/_downloads/mixed/International-Headache-Classification-III-ICHD-III-2013-Beta.pdf
Deuschl, G., et Eisen, A. (1999). Réflexes à longue latence suite à une stimulation nerveuse électrique. La fédération internationale de neurophysiologie clinique. Électroencéphalogramme. Clin. Neurophysiol. Suppl. 52, 263–268.
Résumé PubMed /Google Scholar
Oaklander, A.L. (2001). La densité des terminaisons nerveuses restantes dans la peau humaine avec et sans névralgie post-herpétique après le zona. Douleur 92, 139-145. doi: 10.1016/s0304-3959 (00) 00481-4
Résumé PubMed / Texte intégral CrossRef /Google Scholar
Leave a Reply