Menu
CI-DESSUS :© ISTOCK.COM , RODIMOVA
Les questions sur la vie des oiseaux disparus aujourd’hui perchés dans les musées d’histoire naturelle ont persisté longtemps après leur disparition: À quoi ressemblaient-ils? À quoi ressemblaient-ils en vol ? Quelle niche écologique habitaient-ils?
Alors que des efforts sont en cours pour ramener des mammifères éteints, tels que le mammouth laineux et le quagga, grâce au clonage, à l’insémination artificielle et à un processus de reproduction visant à ramener les espèces domestiquées à des phénotypes qui ressemblent étroitement à leurs ancêtres sauvages, les systèmes reproducteurs des oiseaux ne sont pas aussi adaptés à ces techniques.
Les scientifiques se tournent donc vers la transmission des cellules germinales en culture, une technique prometteuse utilisée depuis plus d’une décennie pour propager des poulets domestiqués modifiés par des gènes. L’idée est que les gènes d’oiseaux éteints pourraient être reproduits et introduits dans les lignées germinales des embryons hôtes.
Nous partons d’un endroit où il existe au moins une technologie viable, puis nous en sortons biologiquement.
— Rosemary Walzem, Texas A&Université M
Bien que la technique fonctionne bien chez les poulets, les milieux de culture cellulaire actuels ne supportent pas les cellules germinales primordiales des oiseaux sauvages (PGC), précurseurs du sperme et de l’ovule. Les PGC transportent des séquences génétiques dans un hôte afin qu’elles puissent être transmises de génération en génération. Revive &Restore, une organisation qui intègre les biotechnologies à la conservation de la faune et soutient une grande partie de la recherche sur la désextinction, a fait de la mise au point de tels milieux une priorité. Cela permettrait l’amplification à grande échelle des PGC d’oiseaux sauvages, y compris peut-être ceux d’oiseaux en voie de disparition, et offrirait une plate-forme de modification génétique qui pourrait aider à redonner vie à des espèces éteintes.
« La culture est difficile”, explique Marie-Cécile Van de Lavoir, vice-présidente des opérations chez Ligand Pharmaceuticals, qui, dans une étude de 2006, a fait progresser la technique chez les poulets en développant les premières cultures de PGC modifiées qui ne se différenciaient pas de leur phénotype et restaient dédiées à la transmission des lignées germinales. Elle possède plusieurs brevets connexes dans le domaine et a fourni des études de faisabilité initiales pour relancer la restauration & pour son effort de désextinction aviaire. « Jusqu’à présent, je n’ai vu aucun système de culture chez aucune autre espèce” en dehors des poulets qui montre l’efficacité souhaitée, dit-elle. « Chaque espèce d’oiseau a un type d’exigence de culture différent. Et nous ne savons pas encore quelles sont ces exigences. »
Rosemary Walzem, biochimiste nutritionnelle à l’Université Texas A&M, avec une petite équipe d’étudiants et de chercheurs postdoctoraux, essaie de résoudre ce problème.
« Nous partons d’un endroit où il existe au moins une technologie viable, puis nous nous dirigeons biologiquement vers un parent du poulet, le tétras pinnaté (Tympanuchus cupido pinnatus), explique Walzem. Et une fois la technique des cellules germinales cultivées stabilisée chez le tétras penné, la stratégie serait ensuite étendue à une sous-espèce éteinte et étroitement apparentée du tétras.
Entrez – ou plutôt sortez – de la poule de bruyère.

Habitant les garrigues et les plaines sablonneuses de la côte Est de l’Amérique du Nord, la poule de bruyère (T. cupido cupido) était un grand tétras et un aliment de base jusqu’au milieu du XIXe siècle. L’oiseau était si commun que le naturaliste Thomas Nuttall rapporta en 1832 que « les domestiques stipulaient avec leurs employeurs de ne pas amener la poule de bruyère à la table plus souvent que quelques fois par semaine. »
La chasse excessive, la maladie et d’autres pressions ont entraîné une chute brutale du nombre de poules de bruyère. En 1870, il ne restait plus que des populations restantes sur les îles côtières, y compris au dernier stand de la poule de bruyère sur Martha’s Vineyard, où l’oiseau devint en quelque sorte une cause célèbre. Marquant une première tentative de conservation, la réserve de poules de Bruyère a été créée en 1908; ici, les amateurs d’oiseaux se sont rassemblés près d’habitats d’accouplement appelés leks, ou terrains en plein essor, pour assister aux danses extravagantes de parade nuptiale des mâles. Les oiseaux frappaient leurs pattes, étendaient deux plumes en forme de corne juste au-dessus de grands sacs aériens colorés sur leur cou et envoyaient une cascade de sons en plein essor. La dernière poule de bruyère, connue des habitants sous le nom de Ben en plein essor, a été vue en 1932.
Un intérêt mutuel pour la modification des génomes d’oiseaux a valu à Walzem une subvention de Revive&Restore pour travailler à la désextinction de l’espèce. La première étape de la tentative de Walzem de ramener la poule de bruyère a été d’établir une population reproductrice de tétras pennés au Texas A &M. Le tétras penné a à peu près la même morphologie que son cousin plus petit et éteint, et bien qu’il ait disparu d’une grande partie de son aire de répartition précolombienne, il peut encore être trouvé dans 10 États. Après un transfert réussi d’un éleveur vers son nouvel enclos au Texas A &M, un troupeau de huit oiseaux a produit 66 œufs au cours de la dernière saison des amours en 2020.
La prochaine étape pour « faire avancer le projet, c’est d’obtenir des conditions où nous pouvons cultiver des cellules germinales primordiales en culture, de manière fiable”, explique Walzem. À cette fin, les PGC sont extraites d’embryons de donneurs de tétras pennés et cultivées in vitro où elles peuvent être répliquées. Dans cet état, les PGC sont facilement accessibles pour la manipulation, y compris l’édition du génome qui pourrait à l’avenir introduire des séquences génétiques copiées d’espèces éteintes. Ensuite, les cellules sont injectées dans un embryon de poulet de substitution en développement, où elles migrent vers les organes sexuels. Lorsque la mère porteuse éclot et finit par se reproduire, le sperme et l’ovule de sa progéniture abritent le génome de l’embryon de tétras donneur, ainsi que les modifications génétiques introduites par les scientifiques.
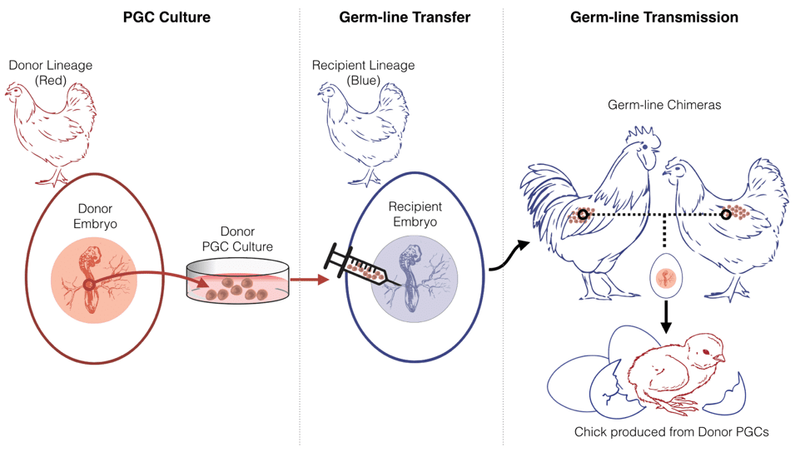
Les premières tentatives de Walzem pour propager et étendre des PGC de tétras pennées récoltées à partir d’embryons n’ont pas réussi dans deux types de milieux différents.
« Il pourrait y avoir des centaines de molécules qui doivent être impliquées dans la programmation d’une cellule”, explique Walzem. Pour comprendre les besoins nutritionnels des PGC et développer la meilleure recette pour les soutenir in vitro, Walzem jette un large filet pour expérimenter les conditions des milieux disponibles. Elle envisage d’utiliser des plates-formes analytiques telles que la métabolomique et les réseaux de cytokines pour comprendre pourquoi les cellules germinales prospèrent et s’amplifient dans certains lots de médias et non dans d’autres.
En suivant des molécules de signalisation appelées cytokines, Walzem cherchera des indications sur les stades de développement des cellules dans les milieux pour déterminer à quel moment elles continuent à se développer ou à se bloquer. Avec le profil métabolique, les cytokines pourraient identifier davantage les ingrédients requis pour le milieu PGC optimal. Ou, inversement, ce que son équipe pourrait découvrir, c’est ce qui empêche les cellules germinales de prospérer dans les médias en premier lieu. ”Et cela peut être le plus grand pas en avant », pour identifier et éliminer les obstacles, dit Walzem.
Si l’équipe Texas A&M réussit à cultiver des cellules germinales de tétras pennées, la prochaine étape de la transmission par la lignée germinale consiste à injecter ces cellules dans la circulation sanguine d’un embryon de poulet hôte pendant une période précise qui permettrait aux cellules de s’installer et d’occuper les gonades de l’embryon, puis de se développer normalement sous forme de spermatozoïdes ou d’ovules.
Mais l’embryon de poulet hôte a aussi ses propres cellules germinales, « et fondamentalement, il y a un combat de chien entre qui possède” la reproduction, dit Walzem. « Et vous devez imaginer que les propres PGC du destinataire ont un avantage sur le terrain. »
Pour cette raison, le taux de réussite de la transmission des lignées germinales chez les poulets n’est que de 5 à 8%, explique Eszter Patakiné Várkonyi dans un e-mail au scientifique. En tant que chercheuse principale au Centre National pour la Biodiversité et la Conservation des Gènes, Institut pour la Conservation des Gènes des Animaux d’élevage, en Hongrie, elle a concentré ses travaux sur la préservation des races de poulets rares, qui sont populaires dans les petites exploitations en Hongrie et sont plus résistantes aux maladies et aux parasites que les oiseaux dans l’aviculture industrielle. Pour augmenter le taux de transmission des cellules germinales primordiales, Várkonyi suggère d’utiliser des embryons de poulet stérilisés chimiquement: Sans cellules germinales indigènes concurrentes, le succès de la transmission des lignées germinales atteint 99,5%. L’utilisation d’embryons de poulet stérilisés pour héberger des cellules germinales de tétras pennées est une tactique envisagée par Walzem.
Si cette manœuvre de transmission des cellules germinales en culture s’avère fructueuse et que le poulet de substitution se reproduit avec un autre poulet portant également la lignée germinale du tétras, sa progéniture sera le tétras penné.
Walzem prévoit de continuer à collaborer avec ses collègues sur le terrain pour identifier davantage les différences entre les génomes de la poule de bruyère et du tétras penné, un processus déjà avancé par Revive&Restore grâce à son financement du séquençage du génome du genre de tétras Tympanuchus. Lorsque les gènes spécifiques à la poule de bruyère sont identifiés en somme, elle se tourne vers l’Institut de médecine génomique du Texas A&M pour se joindre à l’effort et modifier les gènes correspondants dans les cellules germinales de tétras pennées pour conférer des attributs de poule de bruyère.
Il reste à voir si ce qui éclot finalement dans le laboratoire de Walzem reproduit vraiment la poule de bruyère. L’épigénétique et l’environnement joueront également un rôle essentiel dans son conditionnement et sa survie. Et pour que tout effort de conservation tienne, les humains doivent être de meilleurs gardiens de l’habitat de l’oiseau. À cette fin, Revive & Restore a l’intention de maintenir des troupeaux de chimères et de poules de bruyère de substitution tout en réintroduisant l’espèce dans les plaines sablonneuses protégées des îles du Massachusetts pour une étude continue. Si l’effort pour éteindre la poule de bruyère arrive à ce point, une telle étape pourrait être de 10 ans ou plus.
Leave a Reply