különbség egyetlen kettős és hármas kötések
fő különbség-Egy vs kettős vs hármas kötések
kémiai kötések tartsa atomok egy molekula együtt létrehozásával erők között az elektronok és a magok két atom. A kémiai reakciókat a kémiai kötések létrehozása vagy megszakítása szabályozza. Vannak különböző típusú kötvények, mint a kovalens, Ionos, van der Waal ‘ s stb. A kötések tulajdonságai különböző szempontoktól függően változnak, mint például a molekula jellege, szilárd típus (kristályos vagy amorf) stb. A kovalens kötéseket két vagy több elektron megosztásával alakítják ki. Az atomok közötti megosztott elektronok száma határozza meg a kötések számát; függetlenül attól, hogy egyszeri, kettős vagy hármas. Ezért az egy -, kettős-és hármas kötések kovalens kötések. Az egyetlen kettős és hármas kötés közötti fő különbség a megosztott elektronok száma. Ha a megosztott szám egy pár elektron, akkor a kötés egyetlen kötés lesz, míg ha két atomot két pár (négy elektron) köt össze, akkor kettős kötést képez. A hármas kötéseket úgy alakítják ki, hogy három pár (hat atom) elektront osztanak meg. Ezek a megosztó elektronok általánosan ismert valence elektronok. Ez a cikk meg fogja nézni,
1. Mi az egyetlen kötés?
– definíció, tulajdonságok, példák
2. Mi a kettős kötés?
– definíció, tulajdonságok, példák
3. Mi a hármas kötés?
– definíció, tulajdonságok, példák
4. Mi a különbség az egy-és háromszoros kötvények között?
mi az egyetlen kötés
egyetlen kötés úgy alakul ki, hogy egy pár vegyértékű elektront osztunk meg két szomszédos atom között. Az egyetlen kötés a kovalens kötés legegyszerűbb formája, ahol minden atom egy valence elektronot biztosít. Ezek a Valencia elektronok az atomok legkülső héjában találhatók. Itt a negatív töltésű megosztott elektronokat az atomok pozitív töltésű magjai húzzák fel. Ezek a húzóerők együtt tartják az atomokat. Ezt az elrendezést egyetlen kötvénynek nevezik. Az egyetlen kötéssel rendelkező molekulák kevésbé reaktív, mint a többszörös kötésű molekulák. Ráadásul gyengébbek, mint a többszörös kötések, és magasabb kötéshosszúak az atomok közötti alacsony húzóerő miatt, összehasonlítva a több kötéssel. Az egyetlen kötést csak egyetlen kötőjel jelöli; ex: C C. alkánok, például metán, etán, propán néhány példa az egyetlen kötéssel rendelkező vegyületekre.
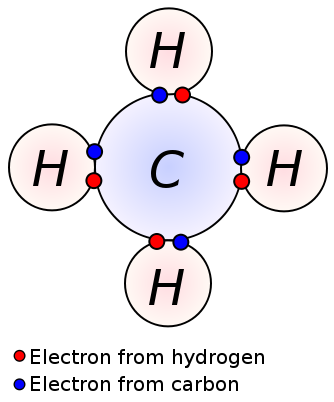
metán
mi a kettős kötés
kettős kötés alakul ki az atomok legkülső pályáján elhelyezkedő két pár Valencia elektron megosztásával. A kettős kötésű vegyületek nagyon reakcióképesek, mint az egyetlen kötésű vegyületek, de kevésbé reaktív, mint a hármas kötésű vegyületek. A kettős kötéseket két párhuzamos kötőjel jelöli; ex: C=C. Néhány példa a vegyületek kettős kötések közé alkének, mint például etilén, propén, karbonil vegyületek (C=O), azo vegyületek (N=N), iminek (C=N), és szulfoxidok (S=O).
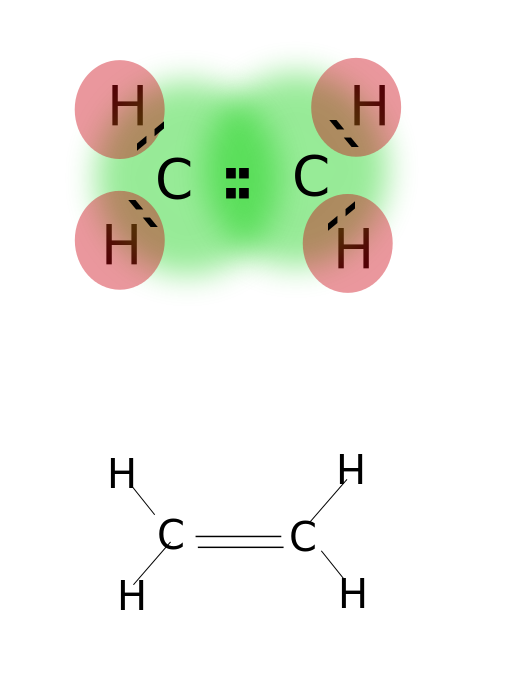
Etilén
Mi is az a Hármas kötés
Ha két atom osztozik három pár valence elektronok (hat valence elektronok), a megállapított kötvények úgynevezett hármas kötések. A hármas kötések a legerősebbek és a leginkább reaktív kovalens kötések. Az egy-és kettős kötésekkel összehasonlítva a hármas kötések a legalacsonyabb kötési hosszúak a két atom közötti nagyobb húzóerő miatt. A hármas kötelék jelöli három párhuzamos vonalak között két atom; ex: C≡C-Néhány példa a vegyületek háromszoros kötvények tartalmaz nitrogént (N≡N), cianid-ion (C≡N) acetilén (CH≡CH), valamint szén-monoxid (C≡O).
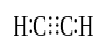
acetilén
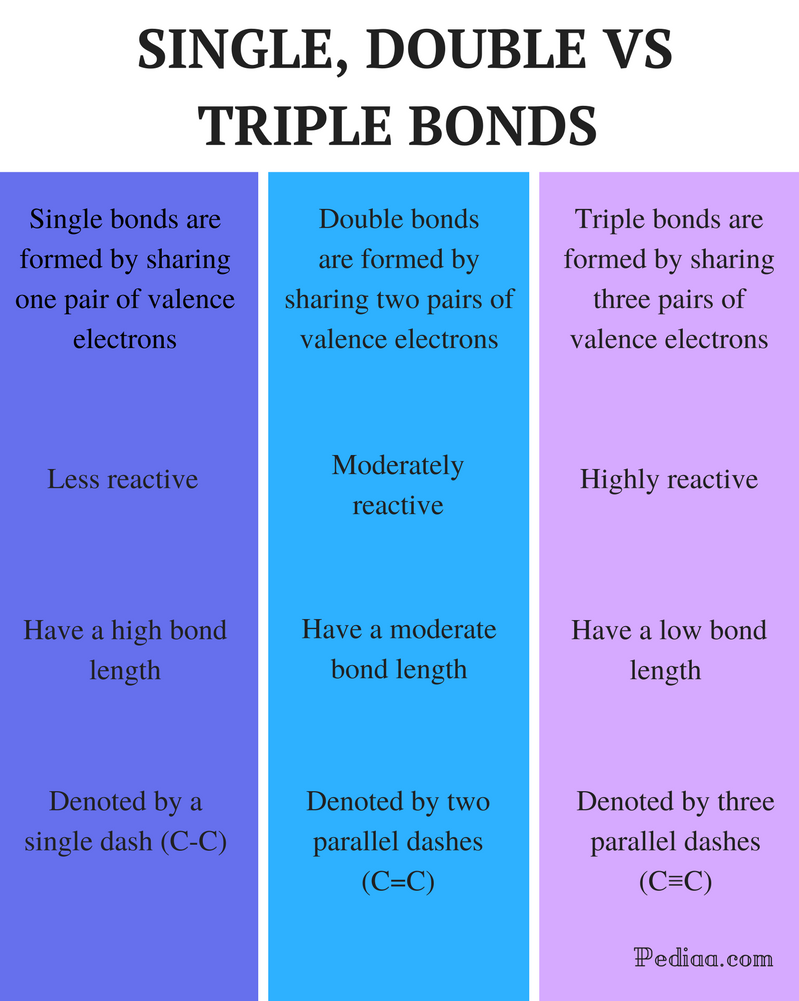
különbség az egy kettős és hármas kötések között
meghatározás:
Egykötvény: Egyetlen kötés alakul ki egy pár valence elektron megosztásával.
kettős kötés: kettős kötés alakul ki két pár Valencia elektron megosztásával.
hármas kötés: három pár Valencia elektron megosztásával hármas kötés alakul ki.
reaktivitás:
egyetlen kötés: az egyetlen kötés kevésbé reaktív.
kettős kötés: a kettős kötések mérsékelten reagálnak.
hármas kötés:a hármas kötések nagyon reaktív.
kötéshossz:
Egykötvény: az Egykötések nagy kötéshosszúak.
kettős kötés: a kettős kötések mérsékelt kötési hosszúak.
hármas kötés: A hármas kötések alacsony kötési erővel rendelkeznek.
jelöli:
egyetlen kötés: az Egykötéseket egyetlen kötőjel (C-C) jelöli.
kettős kötés: a kettős kötéseket két párhuzamos kötőjel jelöli (C=C).
hármas kötés: a hármas kötéseket három párhuzamos kötőjel (C≡C) jelöli.
példák:
egyetlen kötés: a példák közé tartoznak az alkánok, például a metán, az etán, a propán, a bután stb.
kettős kötés: ilyenek például az etilén, propén, karbonilvegyületek (C=O), azo vegyületek (N=N), iminek (C=N) és szulfoxidok (S=O).
hármas kötés: Ilyenek például A nitrogéngáz (N≡N), A cianidion (C≡N), az acetilén (CH≡CH) és a szén-monoxid (C≡O).
![]()
Leave a Reply