Forskjellen Mellom Enkelt Dobbelt Og Trippelbindinger
Hovedforskjell – Enkelt vs Dobbelt vs Trippelbindinger
Kjemiske bindinger holder atomer i et molekyl sammen ved å etablere krefter mellom elektroner og kjerner av to atomer. Kjemiske reaksjoner styres ved å etablere eller bryte de kjemiske bindingene. Det finnes ulike typer obligasjoner som kovalent, ionisk, van Der Waal osv. Egenskapene til bindingene varierer avhengig av ulike aspekter som molekylets natur, fast type (krystallinsk eller amorf) etc. Kovalente bindinger dannes ved å dele to eller flere elektroner. Antallet delt elektron mellom atomer bestemmer antall bindinger; om det er enkelt, dobbelt eller trippel. Derfor er enkelt -, dobbelt-og trippelbindinger kovalente bindinger. Hovedforskjellen mellom enkelt dobbelt og trippelbinding er antall delte elektroner. Hvis det delte tallet er ett par elektroner, vil bindingen være en enkeltbinding, mens hvis to atomer bundet av to par (fire elektroner), vil det danne en dobbeltbinding. Trippelbindinger dannes ved å dele tre par (seks atomer) elektroner. Disse deler elektroner er kjent som valenselektroner. Denne artikkelen vil se på,
1. Hva er En Single Bond?– br> – Definisjon, Egenskaper, Eksempler
2. Hva Er En Double Bond?– br> – Definisjon, Egenskaper, Eksempler
3. Hva er En Triple Bond?– br> – Definisjon, Egenskaper, Eksempler
4. Hva er forskjellen Mellom Single Double Og Triple Bonds?
hva er En Enkeltbinding
en enkeltbinding dannes ved deling av ett par valenselektroner mellom to tilstøtende atomer. En enkeltbinding er den enkleste formen for en kovalent binding, hvor hvert atom gir en valenselektron. Disse valenselektronene er plassert i det ytre skallet av atomer. Her blir de negativt ladede delte elektronene trukket av de positivt ladede atomkjernene. Disse trekkkreftene holder atomene sammen. Dette arrangementet er kjent som et enkeltbinding. Molekylene med enkeltbindinger er mindre reaktive i motsetning til molekylene med flere bindinger. Videre er de svakere enn flere bindinger og har høyere bindingslengder på grunn av den lave trekkraften mellom atomer sammenlignet med flere bindinger. En enkeltbinding er betegnet med bare en enkelt dash; ex: C C. Alkaner som metan, etan, propan er noen eksempler på forbindelser med enkeltbindinger.
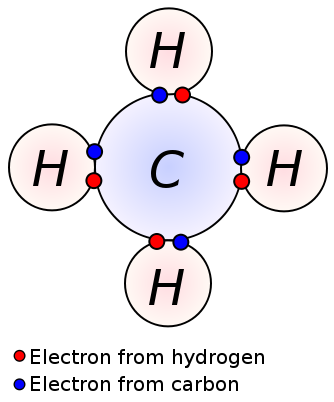
Metan
hva Er En Dobbeltbinding
en dobbeltbinding dannes ved å dele to par valenselektroner plassert i den ytterste bane av atomer. Forbindelser med dobbeltbindinger er svært reaktive enn enkeltbundne forbindelser, men mindre reaktive enn forbindelser med trippelbindinger. Dobbeltbindinger er betegnet med to parallelle bindestreker; ex: C=C. Noen eksempler på forbindelser med dobbeltbindinger inkluderer alkener som etylen, propen, karbonylforbindelser (C=O), azoforbindelser (N=N), iminer (C=N) og sulfoksider (s=O).
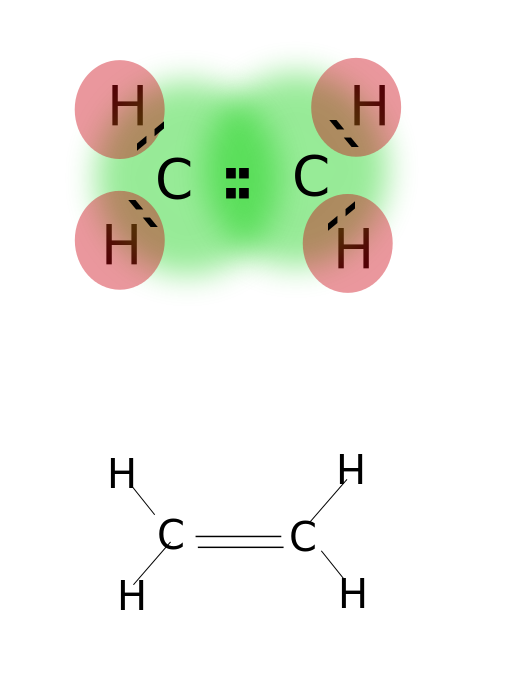
Etylen
Hva er En Trippelbinding
når to atomer deler tre par valenselektroner (seks valenselektroner), kalles de etablerte bindingene trippelbindinger. Trippelbindinger er de sterkeste og mest reaktive kovalente bindingene. Sammenlignet med enkelt-og dobbeltbindinger har trippelbindinger den laveste bindingslengden på grunn av den høyere trekkraften mellom to atomer. En trippelbinding er betegnet med tre parallelle bindestreker mellom to atomer; f. eks. C≡C. noen eksempler på forbindelser med trippelbindinger inkluderer nitrogengass (N≡N), cyanidion (C≡N), acetylen (CH≡CH) og karbonmonoksid (C≡O).
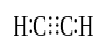
Acetylen
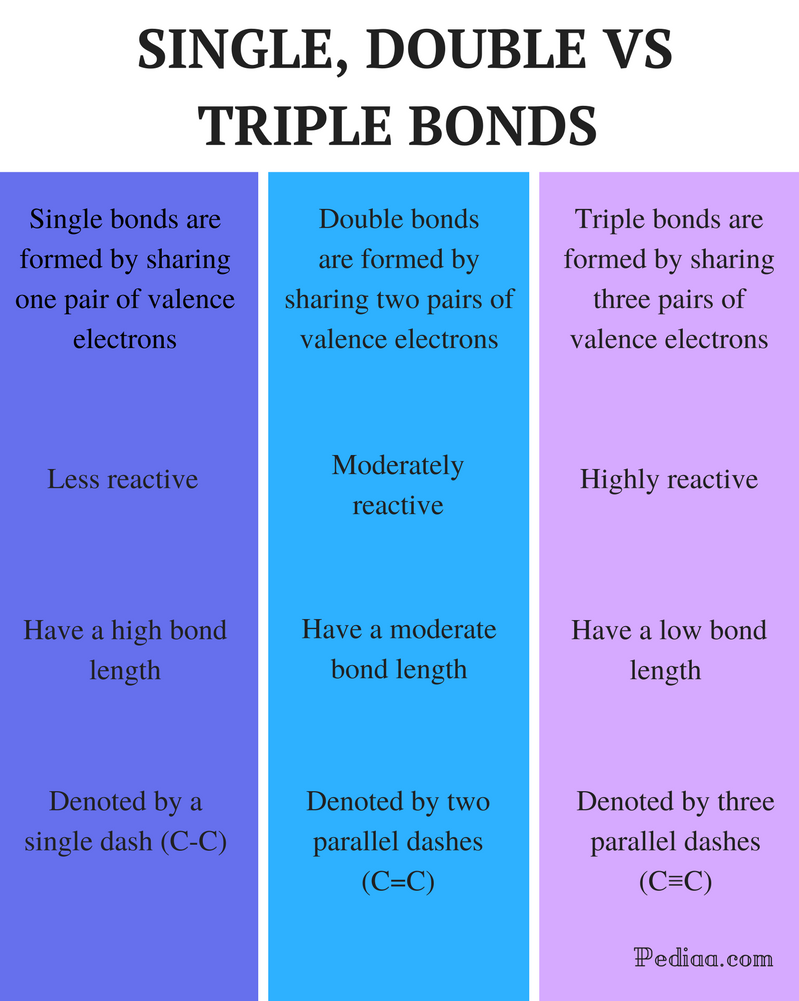
Forskjell Mellom Enkeltdoble Og Trippelbindinger
Definisjon:
Enkeltbinding: En enkeltbinding dannes ved å dele ett par valenselektroner.Dobbeltbinding: en dobbeltbinding dannes ved å dele to par valenselektroner. Trippelbinding: en trippelbinding dannes ved å dele tre par valenselektroner.
Reaktivitet:
Enkeltbinding: Enkeltbindinger er mindre reaktive.
Dobbeltbinding: Dobbeltbindinger er moderat reaktive.
Trippelbinding: Trippelbindinger er svært reaktive.
Bond lengde:
Enkeltbinding: Enkeltbindinger har en høy obligasjonslengde.
Dobbeltbinding: Dobbeltbindinger har en moderat obligasjonslengde.
Trippelbinding: Trippelbindinger har lav bindingsstyrke.
Betegnet med:
Enkeltbinding: Enkeltbindinger er betegnet med et enkelt dash (C-C).
Dobbeltbinding: Dobbeltbindinger er betegnet med to parallelle bindestreker (C=C).
Trippelbinding: Trippelbindinger betegnes med tre parallelle bindestreker (C≡C).
Eksempler:
Enkeltbinding: Eksempler inkluderer Alkaner som metan, etan, propan, butan etc.Dobbeltbinding: Eksempler er etylen, propen, karbonylforbindelser (C=O), azoforbindelser (N=N), iminer (C=N) og sulfoksider (s=O).
Trippelbinding: Eksempler er Nitrogengass (N≡N), cyanidion (C≡N), acetylen (CH≡CH) og karbonmonoksid (C≡O).
![]()
Leave a Reply