verschil tussen enkelvoudige dubbele en drievoudige bindingen
belangrijkste verschil-enkelvoudige vs Dubbele vs drievoudige bindingen
chemische bindingen houden atomen in een molecuul bij elkaar door krachten tussen de elektronen en kernen van twee atomen vast te stellen. Chemische reacties worden beheerst door het vestigen of breken van de chemische bindingen. Er zijn verschillende soorten bindingen zoals covalent, ionisch, van der Waal ‘ s etc. De eigenschappen van de bindingen variëren afhankelijk van diverse aspecten zoals aard van molecule, vast type (kristallijn of amorf) enz. Covalente bindingen worden gevormd door het delen van twee of meer elektronen. Het aantal gedeelde elektronen tussen atomen bepaalt het aantal bindingen; of het nu enkel, dubbel of drievoudig is. Daarom zijn enkele, dubbele en drievoudige bindingen covalente bindingen. Het belangrijkste verschil tussen enkele dubbele en drievoudige binding is het aantal gedeelde elektronen. Als het gedeelde getal één paar elektronen is, zal de binding een enkele binding zijn, terwijl als twee atomen gebonden zijn door twee paren (vier elektronen), het een dubbele binding zal vormen. Drievoudige bindingen worden gevormd door het delen van drie paren (zes atomen) van elektronen. Deze delen elektronen zijn algemeen bekend als valentie-elektronen. Dit artikel zal kijken naar
1. Wat is een enkele band?
– definitie, eigenschappen, voorbeelden
2. Wat is een dubbele binding?
– definitie, eigenschappen, voorbeelden
3. Wat is een drievoudige binding?
– definitie, eigenschappen, voorbeelden
4. Wat is het verschil tussen enkele dubbele en drievoudige bindingen?
Wat is een enkele binding
een enkele binding wordt gevormd door het delen van één paar valentie-elektronen tussen twee aangrenzende atomen. Een enkele binding is de eenvoudigste vorm van een covalente binding, waarbij elk atoom één valentie-elektron levert. Deze valentie-elektronen bevinden zich in de buitenste schil van atomen. Hier worden de negatief geladen gedeelde elektronen aangetrokken door de positief geladen kernen van atomen. Deze trekkrachten houden de atomen bij elkaar. Deze regeling staat bekend als een enkele obligatie. De molecules met enige bindingen zijn minder reactief in tegenstelling tot de molecules met veelvoudige bindingen. Bovendien zijn ze zwakker dan meerdere bindingen en hebben ze hogere bindingslengtes vanwege de lage trekkracht tussen atomen in vergelijking met meerdere bindingen. Een enkele binding wordt aangeduid met slechts een enkel streepje; bijvoorbeeld: C C. alkanen zoals methaan, ethaan, propaan zijn enkele voorbeelden voor verbindingen met enkele bindingen.
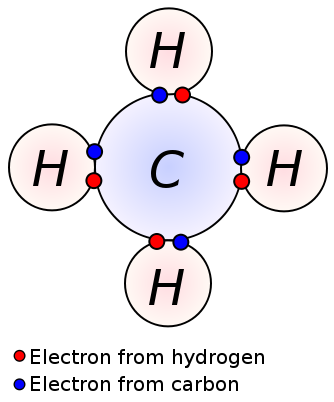
methaan
Wat is een dubbele binding
een dubbele binding wordt gevormd door het delen van twee paar valentie-elektronen in de buitenste baan van atomen. Verbindingen met dubbele bindingen zijn zeer reactief dan enkelvoudige gebonden verbindingen, maar minder reactief dan verbindingen met drievoudige bindingen. Dubbele bindingen worden aangeduid met twee parallelle streepjes; bijvoorbeeld: C = C. Enkele voorbeelden van verbindingen met dubbele bindingen zijn alkenen zoals ethyleen, propeen, carbonylverbindingen (C=O), azoverbindingen (N=N), imines (C=N) en sulfoxiden (S=O).
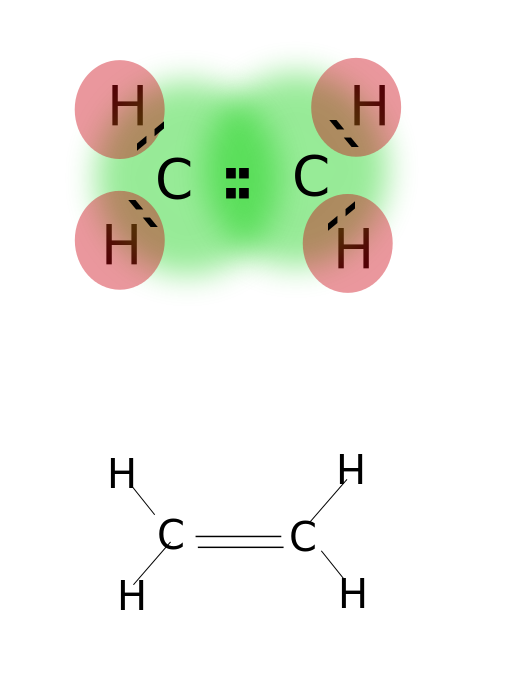
ethyleen
Wat is een drievoudige binding
wanneer twee atomen drie paar valentie-elektronen (zes valentie-elektronen) delen, worden de vastgestelde bindingen drievoudige bindingen genoemd. Drievoudige bindingen zijn de sterkste en meest reactieve covalente bindingen. In vergelijking met enkele en dubbele bindingen, hebben drievoudige bindingen de laagste bindingslengte als gevolg van de hogere trekkracht tussen twee atomen. Een drievoudige binding wordt aangeduid door drie parallelle streepjes tussen twee atomen; bijvoorbeeld: C≡C. enkele voorbeelden van verbindingen met drievoudige bindingen zijn stikstofgas (N≡N), cyanide-ion (C≡N), acetyleen (CH≡CH) en koolmonoxide (C≡O).
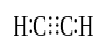
acetyleen
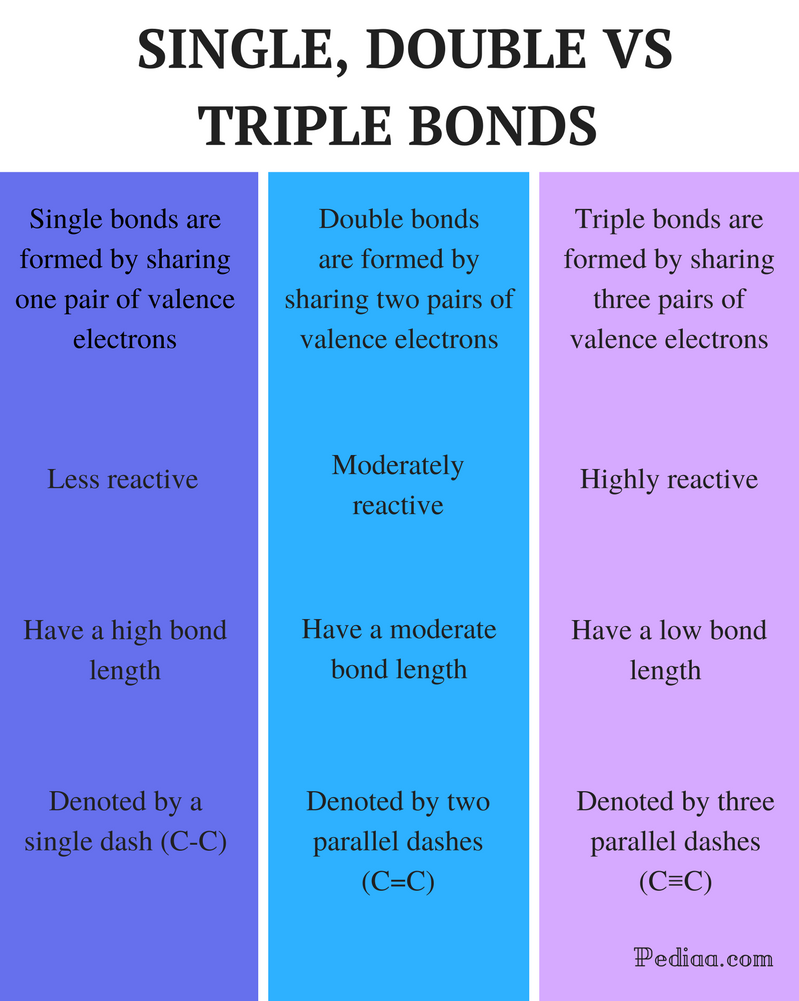
verschil tussen enkelvoudige dubbele en drievoudige bindingen
definitie:
enkelvoudige bindingen: Een enkele binding wordt gevormd door één paar valentie-elektronen te delen.
dubbele binding: een dubbele binding wordt gevormd door het delen van twee paren valentie-elektronen.
drievoudige binding: een drievoudige binding wordt gevormd door het delen van drie paren valentie-elektronen.
reactiviteit:
enkelvoudige binding: enkelvoudige bindingen zijn minder reactief.
dubbele binding: dubbele binding is matig reactief.
Triple Bond: Triple bindingen zijn zeer reactief.
Obligatielengte:
enkelvoudige Obligatielengte: enkelvoudige obligaties hebben een hoge obligatielengte.
dubbele binding: dubbele bindingen hebben een matige obligatielengte.
drievoudige binding: Triple bindingen hebben een lage bindingssterkte.
aangeduid met:
enkelvoudige obligatie: enkelvoudige obligaties worden aangeduid met een enkel streepje (C-C).
dubbele binding: dubbele bindingen worden aangeduid met twee parallelle streepjes (C = C).
drievoudige binding: drievoudige binding wordt aangeduid met drie parallelle streepjes (C≡C).
voorbeelden:
enkelvoudige binding: voorbeelden zijn alkanen zoals methaan, ethaan, propaan, butaan enz.
dubbele binding: voorbeelden zijn ethyleen, propeen, carbonylverbindingen (C = O), azoverbindingen (N=N), imines (C=N) en sulfoxiden (S=O).
drievoudige binding: Voorbeelden hiervan zijn stikstofgas (N≡N), cyanide-ion (C≡N), acetyleen (CH≡CH) en koolmonoxide (C≡O).
![]()
Leave a Reply