różnica między pojedynczymi wiązaniami podwójnymi i potrójnymi
główna różnica – wiązania pojedyncze vs Podwójne vs potrójne
wiązania chemiczne utrzymują Atomy w cząsteczce razem, ustanawiając siły między elektronami i jądrami dwóch atomów. Reakcje chemiczne są regulowane przez ustanowienie lub zerwanie wiązań chemicznych. Istnieją różne rodzaje wiązań, takie jak kowalencyjne, jonowe, van der Waala itp. Właściwości wiązań różnią się w zależności od różnych aspektów, takich jak natura cząsteczki, Typ stały (krystaliczny lub amorficzny) itp. Wiązania kowalencyjne powstają przez dzielenie dwóch lub więcej elektronów. Liczba wspólnych elektronów między atomami określa liczbę wiązań; czy jest to pojedyncze, podwójne lub potrójne. Dlatego wiązania pojedyncze, podwójne i potrójne są wiązaniami kowalencyjnymi. Główną różnicą między wiązaniem pojedynczym podwójnym i potrójnym jest liczba wspólnych elektronów. Jeśli wspólna liczba jest jedną parą elektronów, Wiązanie będzie wiązaniem pojedynczym, natomiast jeśli dwa atomy połączone dwiema parami (cztery elektrony), utworzy wiązanie podwójne. Wiązania potrójne powstają przez dzielenie trzech par (sześciu atomów) elektronów. Te wspólne elektrony są powszechnie znane jako elektrony walencyjne. Ten artykuł będzie wyglądać na,
1. Czym jest pojedyncza więź?
– definicja, właściwości, przykłady
2. Co To jest wiązanie podwójne?r– – definicja, właściwości, przykłady
3. Co To jest Wiązanie potrójne?
– definicja, właściwości, przykłady
4. Jaka jest różnica między wiązaniami pojedynczymi podwójnymi i potrójnymi?
co to jest pojedyncze Wiązanie
pojedyncze Wiązanie powstaje przez dzielenie jednej pary elektronów walencyjnych między dwoma sąsiednimi atomami. Pojedyncze Wiązanie jest najprostszą formą wiązania kowalencyjnego, gdzie każdy atom zapewnia jeden elektron walencyjny. Te elektrony walencyjne znajdują się w zewnętrznej powłoce atomów. Tutaj ujemnie naładowane wspólne elektrony są przyciągane przez dodatnio naładowane jądra atomów. Te siły ciągnące trzymają Atomy razem. Układ ten jest znany jako pojedyncze Wiązanie. Cząsteczki z wiązaniami pojedynczymi są mniej reaktywne w przeciwieństwie do cząsteczek z wiązaniami wielokrotnymi. Co więcej, są one słabsze od wiązań wielokrotnych i mają większą długość wiązań ze względu na niską siłę przyciągania między atomami w porównaniu do wiązań wielokrotnych. Pojedyncze Wiązanie jest oznaczane tylko pojedynczą kreską; ex: C C. alkany, takie jak metan, etan, propan, są przykładami związków z pojedynczymi wiązaniami.
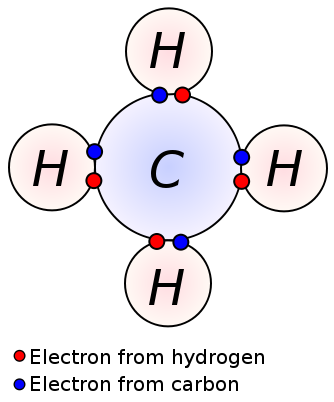
Metan
co to jest wiązanie podwójne
wiązanie podwójne powstaje przez dzielenie dwóch par elektronów walencyjnych znajdujących się na najbardziej zewnętrznej orbicie atomów. Związki z wiązaniami podwójnymi są wysoce reaktywne niż związki z wiązaniami pojedynczymi, ale mniej reaktywne niż związki z wiązaniami potrójnymi. Wiązania podwójne są oznaczone dwoma równoległymi kreskami; ex: C=C. Niektóre przykłady związków z podwójnymi wiązaniami obejmują alkeny, takie jak etylen, Propen, związki karbonylowe (C=O), związki azowe (N=N), iminy (C=N) i sulfoksydy (S=O).
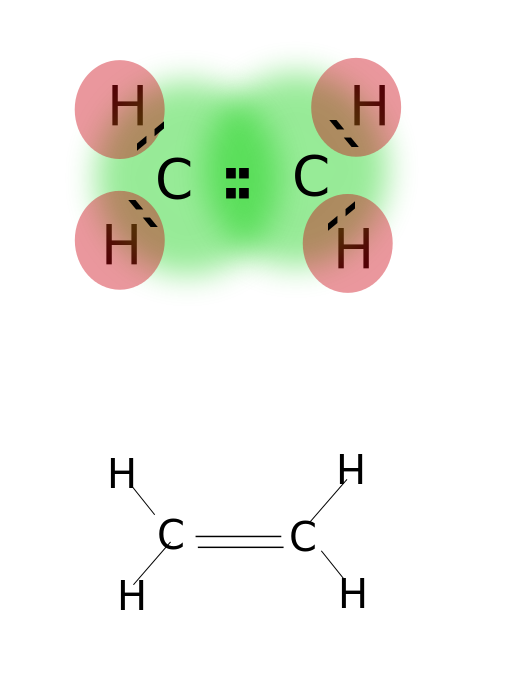
etylen
co to jest Wiązanie potrójne
gdy dwa atomy dzielą trzy pary elektronów walencyjnych (sześć elektronów walencyjnych), ustalone wiązania nazywane są wiązaniami potrójnymi. Wiązania potrójne są najsilniejszymi i najbardziej reaktywnymi wiązaniami kowalencyjnymi. W porównaniu z wiązaniami pojedynczymi i podwójnymi, wiązania potrójne mają najniższą długość wiązania ze względu na większą siłę przyciągania między dwoma atomami. Wiązanie potrójne jest oznaczane przez trzy równoległe kreski między dwoma atomami; ex: C≡C. Niektóre przykłady związków z wiązaniami potrójnymi obejmują gaz azotowy (N≡N), jon cyjankowy (C≡N), acetylen (CH≡CH) i tlenek węgla (C≡O).
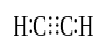
Acetylen
różnica między pojedynczymi wiązaniami podwójnymi i potrójnymi
definicja:
Wiązanie pojedyncze: Pojedyncze Wiązanie powstaje przez dzielenie jednej pary elektronów walencyjnych.
wiązanie podwójne: wiązanie podwójne powstaje przez dzielenie dwóch par elektronów walencyjnych.
Wiązanie potrójne: Wiązanie potrójne powstaje przez dzielenie trzech par elektronów walencyjnych.
reaktywność:
Wiązanie pojedyncze: wiązania pojedyncze są mniej reaktywne.
wiązanie podwójne: wiązania podwójne są umiarkowanie reaktywne.
Wiązanie potrójne: wiązania potrójne są wysoce reaktywne.
długość wiązania:
pojedyncze Wiązanie: pojedyncze wiązania mają wysoką długość wiązania.
wiązanie podwójne: wiązania podwójne mają umiarkowaną długość wiązania.
Wiązanie potrójne: Wiązania potrójne mają niską siłę wiązania.
oznaczony przez:
pojedyncze Wiązanie: pojedyncze wiązania są oznaczane pojedynczym myślnikiem (C-C).
wiązanie podwójne: wiązania podwójne są oznaczone dwoma równoległymi kreskami (C = C).
Wiązanie potrójne: wiązania potrójne są oznaczone trzema równoległymi kreskami (C≡C).
przykłady:
Wiązanie pojedyncze: przykłady obejmują alkany, takie jak metan, etan, propan, butan itp.
wiązanie podwójne: przykłady obejmują etylen, Propen, związki karbonylowe (C=O), związki azowe (N=N), iminy (C=N) i sulfoksydy (S=O).
Wiązanie potrójne: Przykłady obejmują azot (N≡N), jon cyjanku (C≡N), acetylen (CH≡CH) i tlenek węgla (C≡O).
![]()
Leave a Reply