7.2: Quimotripsina
Introdução
Quimotripsina é uma das enzimas mais estudadas devido às suas duas fase cinética: pré-estado estacionário e estado estacionário. O estudo destes dois cinética estados dá a evidência do “Ping-Pong” mecanismo, a formação de ligação covalente complexos, levando a ligação covalente reações de hidrólise, e a taxa de reações catalisadas. A síntese da quimotripsina ocorre principalmente no pâncreas. No entanto, em vez da forma activa, é produzida como um zimogénio inactivo chamado quimotripsinogénio para evitar que a sua actividade da protease digere o pâncreas. Após a secreção no lúmen do intestino delgado, ele é convertido à sua forma ativa por outra enzima chamada tripsina. Esta dependência de uma enzima diferente para a activação de uma protease é uma forma comum para o organismo prevenir a digestão de órgãos e outros efeitos secundários enzimáticos nocivos.
quimotripsina opera através de um mecanismo geral conhecido como o mecanismo ping-pong (figura \(\PageIndex{1}\)) pelo qual a enzima reage com um substrato para formar uma enzima intermédia. Este intermediário tem propriedades diferentes da enzima inicial, por isso, para regenerar a actividade enzimática inicial, deve reagir com um substrato secundário. Este processo é ilustrado abaixo:

mais especificamente, quimotripsina opera através de um tipo particular de mecanismo de ping-pong chamado hidrólise covalente. Isto significa que a enzima forma primeiro uma ligação covalente com o substrato-alvo, deslocando a fracção mais estável para a solução. Este complexo de substrato enzimático é chamado de intermediário enzimático. O intermediário então reage com água, que desloca a parte restante do substrato inicial e reforma a enzima inicial.
quimotripsina, como a maioria das enzimas, é específica nos tipos de substratos com os quais reage. Como protease, cliveia polipeptídeos, e a sua especificidade inerente permite-lhe actuar apenas no terminal carboxi de resíduos aromáticos. É um mecanismo algo complicado, e é melhor explicado em uma série de passos.
1. O alvo entra no local ativo da quimotripsina, e é mantido lá por interações hidrofóbicas entre grupos não-polares expostos de resíduos de enzimas e a cadeia lateral não-polar aromática do substrato. É importante notar a ligação de hidrogênio entre o nitrogênio Schiff em histidina-57 e a cadeia lateral de oxigênio da serina-195.
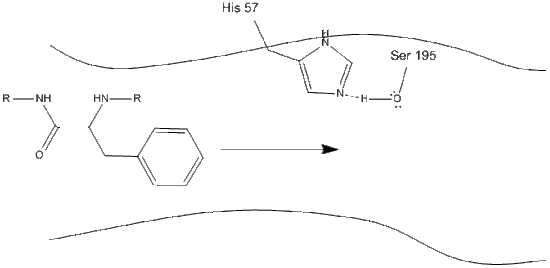
2. Auxiliado pela ligação de hidrogênio histidina-serina, o grupo hidroxila na serina-195 realiza um ataque nucleofílico sobre o carbono carbonila de um aminoácido aromático, enquanto simultaneamente transfere o hidrogênio hidroxilo para o nitrogênio histidina Schiff. Este ataque empurra os elétrons de carbonila pi para o oxigênio carbonila, formando um intermediário de curta duração consistindo de um carbono C-terminal com quatro ligações únicas.: Anion oxygen, the beta-carbon of the aromatic amino acid, the N-terminus of the subsequent amino acid of the substrate protein, and the serine-195 side-chain oxygen.
.gif?revision=1&size=bestfit&width=720&height=192)
3. Este intermediário é de curta duração, uma vez que os elétrons oxianion reformam a ligação pi com o C-terminus do aminoácido aromático. O vínculo entre as carboxipenicilinas terminus aromáticos de aminoácidos e o n-terminal da posterior resíduo é desfeita, e os elétrons são utilizados para extrair o hidrogênio do protonated Schiff nitrogênio em histidina-57. As ligações entre o carbono carbonílico e o oxigênio Serino-195 permanecem em uma configuração de éster. Isto é chamado de acil-enzima intermediário. O lado C-terminal do polipéptido está agora livre para dissociar-se do local activo da enzima.
4. Moléculas de água são agora capazes de entrar e se ligar ao local ativo através da ligação de hidrogênio entre os átomos de hidrogênio da água e o nitrogênio de histidina-57 Schiff.
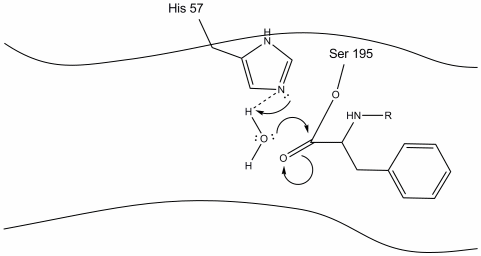
5. O oxigênio da água agora faz um ataque nucleofílico sobre o carbono carbonila do intermediário acil-enzima, empurrando os elétrons pi do carbonilo para o carbono carbonil como histidina-57 extrai um próton da água. Isto Forma Outro carbono quaternário ligado covalentemente com a serina, um hidroxilo, um oxianion, e o aminoácido aromático. O próton no recentemente protonado histidina-57 é agora capaz de fazer uma ligação de hidrogênio com o oxigênio da serina.
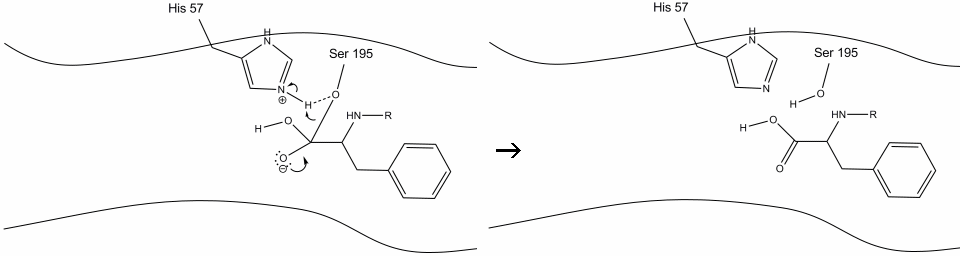
6. Os elétrons oxianion reformam a ligação carbonila pi, clivando a ligação entre o carbono carbonila e a serina hidroxila. Os elétrons nesta ligação são usados pelo oxigênio Serino para desprotonar o nitrogênio de histidina Schiff e reformar a enzima original. O substrato já não tem afinidade com o local ativo, e logo se dissocia do complexo.
Leave a Reply