Fronteiras em Farmacologia
Introdução
Lipossomas são um tipo de nanocarrier que têm sido amplamente investigados para a droga entrega. Eles são compostos por bilayers fosfolípidos que cercam um espaço aquoso distinto, permitindo assim encapsulação de compostos hidrofílicos e hidrofóbicos (Metselaar e Storm, 2005). Os lipossomas são capazes de estabilizar os compostos terapêuticos e superar barreiras à absorção celular e tecidular (Ding et al., 2006; Hua e Wu, 2013). Isto permite-lhes melhorar a focalização de compostos em locais de doença e, consequentemente, reduzir a acumulação em órgãos não visados (Bakker-Woudenberg et al., 1994; Mastrobattista et al., 1999; Hua, 2013; Hua et al., 2015; Sercombe et al., 2015; Zununi Vahed et al., 2017). Existem quatro tipos principais de lipossomas baseados em suas características de superfície-lipossomas convencionais, lipossomas Peguilados, lipossomas-alvo ligando, e lipossomas teranósticos (Figura 1; Sercombe et al., 2015). Ligante-alvo lipossomas fornecer o potencial de um site específico de entrega de drogas para determinados tecidos ou órgãos, que seletivamente express alvo de ligante (Willis e Forssen, 1998; Bendas, 2001; Sawant e Torchilin, 2012), enquanto que Peguilado lipossomas conferir estéricos obstáculo para melhorar a circulação de meia-vida do sistema de entrega seguinte sistêmica de administração (Torchilin, 1994; Wang et al., 2015). Lipossomas incorporando uma combinação das várias plataformas de entrega podem melhorar ainda mais a entrega de compostos encapsulados, dependendo da via de administração e local da doença.
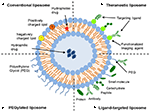
a FIGURA 1. Representação esquemática dos diferentes tipos de sistemas lipossómicos de distribuição de droga – (a) lipossoma convencional, (B) lipossoma peguilado, (C) lipossoma orientado para o ligante e (D) lipossoma Teranostico (Sercombe et al., 2015).
Após o processo de fabricação, lipossomas são caracterizados para garantir a homogeneidade através de um número de parâmetros, incluindo interações de encapsulamento, ligando-conjugação, composição de lipídios, a carga de superfície e propriedades morfológicas (por exemplo, tamanho, forma e número de lamelas) (Kuntsche et al., 2011). Estas características são importantes porque podem ter um grande impacto no comportamento dos lipossomas tanto in vitro como in vivo (Sawant e Torchilin, 2012; Sercombe et al., 2015). Reconhecimento e liberação de lipossomas pelas defesas do corpo, incluindo o sistema reticuloendotelial (RES) e adsorção de opsoninas com posterior adoção pelo sistema fagocítico mononuclear, são importantes contribuintes para a depuração e degradação dos lipossomas (Senior, 1987; Cullis et al., 1998; Ishida et al., 2001). Portanto, ser capaz de determinar as propriedades físico-químicas dos lipossomas manufaturados é importante para otimizar uma formulação para posterior avaliação translacional.um aspecto importante na avaliação físico-química dos lipossomas é a visualização da morfologia das nanopartículas por microscopia. Há uma série de técnicas disponíveis para imagiologia lipossomas e outras nanopartículas que podem ser amplamente categorizadas em microscopia de luz, elétron ou força atômica (Bibi et al., 2011). Cada técnica tem as suas próprias vantagens e limitações, que devem ser consideradas na avaliação dos estudos sobre os sistemas de distribuição de droga baseados em nanopartículas (Quadro 1). Esta revisão avaliará cada técnica de imagem utilizada para avaliar as características morfológicas dos lipossomas.

a TABELA 1. Summary of current imaging techniques for characterizing liposome morphology.
microscopia de luz
luz ou microscopia óptica refere-se a microscópios que utilizam luz visível e um arranjo de Lentes para ampliar um campo de visão (Murphy e Davidson, 2012c). A microscopia de luz básica em si é incapaz de fornecer informações completas sobre a camada lipídica em comparação com o detalhe oferecido por outras técnicas de microscopia. No entanto, pode ser utilizado para obter rapidamente uma imagem das vesículas utilizando equipamento de laboratório básico (Bibi et al., 2011). Esta técnica pode ser particularmente útil ao recolher informações gerais sobre o tamanho, forma, homogeneidade e grau de agregação de uma amostra lipossómica (Nallamothu et al., 2006). Microscópios de luz têm uma resolução final de ∼250 nm (governada pelo menor tamanho limitado de difração que pode ser alcançado pelo instrumento) e, como tal, são tipicamente incapazes de fornecer informações detalhadas sobre as estruturas de pequenas vesículas unilamelares (SUV) e a lamelaridade das vesículas (Bibi et al., 2011). Geralmente, a microscopia leve só pode fornecer informações significativas sobre vesículas unilamelares gigantes (GUVs), que podem variar de um a centenas de micrômetros de diâmetro (Bagatolli, 2009). Incorporação de sondas fluorescentes, técnicas de polarização e aplicação de Microscopia confocal de alta resolução pode fornecer mais informações sobre a estrutura 3D e lamelaridade das vesículas (Bagatolli, 2009).
Microscopia de Polarização
Este tipo de microscopia de luz utiliza a capacidade única de luz polarizada para interagir com polarizable laços de ordenar moléculas (Murphy e Davidson, 2012d). O aumento da absorção da luz ocorre quando dipolos moleculares na amostra estão alinhados com o vetor de polarização da onda luminosa incidente; resultando em diferenças de fase entre a amostragem de raios de luz, que por sua vez produzem alterações dependentes de interferência na amplitude no plano de imagem (Murphy e Davidson, 2012d). O contraste de imagem então surge não apenas dos efeitos de interferência e difração, mas também devido à presença de arranjos moleculares ordenados (Murphy e Davidson, 2012d). Pode ser usado para estudar a forma e dinâmica de muitas estruturas celulares ordenadas, incluindo bilayers lipídicos de membranas plasmáticas (Bibi et al., 2011; Murphy and Davidson, 2012d). As imagens podem ser obtidas em monocromático ou em cor. Esta técnica fornece um método alternativo para visualizar lipossomas, particularmente para confirmar a formação de vesículas. Não fornece observações conclusivas sobre as características bilayer ou lamelaridade das vesículas (Bibi et al., 2011). Além disso, a microscopia de polarização também é limitada pelo tamanho das vesículas que podem ser visualizadas, com grandes vesículas na faixa micrômetro com a clareza ideal. Esta técnica não fornece imagens claras de partículas na gama nanométrica.microscopia de fluorescência é uma forma especial de microscopia de luz que explora a capacidade dos fluorocromos emitirem luz após serem excitados com luz de um certo comprimento de onda (Murphy e Davidson, 2012b). Esta técnica é amplamente utilizada na Biofísica para fornecer informações essenciais sobre a estrutura e dinâmica dos componentes de membrana (Bouvrais et al., 2010). Nestes estudos, as sondas fluorescentes são especificamente incorporadas à membrana sob investigação, permitindo a visualização da estrutura. Uma grande variedade de corantes fluorescentes com várias propriedades químicas e fotônicas estão disponíveis comercialmente, atendendo a uma variedade de questões de pesquisa. Por exemplo, alguns corantes fluorescentes podem preferir ambientes de membrana específicos que exibam diferentes arranjos e embalagens laterais (Bouvrais et al., 2010). Como tal, a microscopia de fluorescência permite que o potencial para aplicar simultaneamente múltiplas sondas dentro de uma amostra para fornecer informações sobre a própria estrutura da membrana. As sondas fluorescentes podem ser colocadas no interior do compartimento aquoso, bem como na camada lipídica dos lipossomas (Bibi et al., 2011). Este arranjo pode ser especialmente útil ao ver GUVs, onde podem ser obtidas informações sobre a forma, tamanho e fluidez das vesículas lipídicas (Klymchenko et al., 2009; Bouvrais et al., 2010). A incorporação de sondas, como lípidos rotulados de rodamina, diretamente no bilayer lipídico também pode permitir a visualização da lamelaridade dos lipossomas (Bibi et al., 2011).
a desvantagem da microscopia fluorescente é que a adição de sondas e corantes a um sistema de membrana pode potencialmente interferir com as propriedades do sistema de administração lipossómica (Bouvrais et al., 2010; Bibi et al., 2011; Murphy and Davidson, 2012b). Contudo, a utilização de concentrações baixas de corantes (≤1 mol%) demonstrou ter um impacto mínimo nas propriedades físicas da membrana (Bouvrais et al., 2010). Também é importante notar que a escolha do corante fluorescente é uma etapa crítica, como alguns corantes podem induzir grandes mudanças no host de membrana e/ou causar artefatos experimentais, resultando em dados imprecisos interpretação (Bouvrais et al., 2010). Além disso, a peroxidação lipídica fotoinduzida também pode levar à formação de domínio, mesmo em sistemas de corantes simples. Este processo pode resultar na formação de grandes jangadas e formação espontânea de facetas (Bouvrais et al., 2010). A exposição prolongada à luz fluorescente também pode resultar em descoloração e perda de intensidade de fluorescência. Portanto, a escolha do corante fluorescente e o desenvolvimento de novas sondas de membrana são considerações importantes quando se utiliza microscopia de fluorescência (Klymchenko et al., 2009).microscopia de varrimento Confocal tem sido um avanço na área de microscopia de fluorescência. Em vez de iluminar toda a amostra, uma imagem é construída através da varredura de um (ou mais) feixes de luz focados em toda a amostra. A luz que regressa da amostra iluminada passa por uma abertura que rejeita a luz fora de foco vinda de cima e abaixo do plano de interesse.; garantir que apenas imagens de uma pequena profundidade de campo são obtidas, melhorando grandemente a resolução fora de plano (Bibi et al., 2011; Murphy and Davidson, 2012a). Usando esta técnica, uma” pilha-z ” de imagens é coletada, começando do topo da vesícula seguida por imagens tomadas em incrementos z definidos para o fundo da amostra, resultando em uma imagem 3D composta da amostra (Bibi et al., 2011; Murphy and Davidson, 2012a). Microscopia de varredura Confocal tornou-se uma técnica mais atraente sobre microscópios de luz epifluorescente devido à sua clareza superior de imagem. No caso dos GUVs, esta técnica é capaz de visualizar a estrutura interna dos sistemas lipídicos, o que muitas vezes não é possível com outros métodos de microscopia (Ruozi et al., 2011; Mertins and Dimova, 2013). Por exemplo, a separação da fase aquosa e lipídica bilayer pode ser claramente visualizada em vesículas maiores (Mertins e Dimova, 2013). No entanto, a microscopia confocal ainda é limitada por difração e, portanto, incapaz de produzir imagens de alta definição de SUVs ou lipossomas oligolamelares (Ruozi et al., 2011).
técnicas de Microscopia Eletrônica
microscopia eletrônica é um método para a visualização de vesículas sob ampliação muito alta (Henry, 2005). É amplamente usado na caracterização de vesículas lipídicas como o comprimento de onda de elétrons (e, portanto, resolução limitada por difração), é muitas ordens de magnitude menor do que a microscopia óptica, e portanto fornece super-resolução para visualização clara de pequenos lipossomas (Bibi et al., 2011; Ruozi et al., 2011). Esta técnica usa um feixe de elétrons focados na superfície da amostra por várias lentes eletromagnéticas. Os elétrons são então dispersos pela amostra, e são então reorientados e ampliados por uma nova série de lentes eletromagnéticas na coluna de imagem para produzir uma imagem projetada (Henry, 2005). Existem vários tipos diferentes de microscópios eletrônicos, cada um exigindo um método de preparação de amostras diferente.
de Microscopia eletrônica de Varredura (SEM)
microscópios eletrônicos (SEMs) utilizam um feixe de elétrons que é verificado através de ou sobre uma amostra (em vez de através de uma amostra) para produzir uma imagem ampliada de um objeto (Adler e Schiemann, 1985). Alder et al. primeiro tentou usar SEM para caracterizar lipossomas em 1984 (Adler e Schiemann, 1985). Eles mostraram que usando o método de liofilização para preparar as amostras de lipossomas para o SEM resultou em uma grande proporção de pedaços visíveis e material incrustado (Adler e Schiemann, 1985). Estudos mais recentes têm mostrado que a estrutura lipossômica em si pode sofrer perturbações devido às condições de alto vácuo e processos de coloração necessários para esta técnica de preparação (Ruozi et al., 2011). SEM Agora não é comumente usado para analisar lipossomas porque requer que a amostra seja seca ou fixada antes da imagem (Ruozi et al., 2011). No entanto, SEM Pode fornecer informações gerais sobre a estrutura concêntrica das diferentes camadas lipídicas, bem como dar detalhes sobre o tamanho e morfologia esférica de uma preparação (Nirale et al., 2009).
microscopia electrónica de transmissão (met)
microscopia electrónica de transmissão (met) é o método de imagem mais frequentemente utilizado para a avaliação da estrutura das nanopartículas (Henry, 2005; Kuntsche et al., 2011). Envolve a preparação de uma amostra fina (<100 nm de espessura) que é colocada em uma câmara de vácuo. O feixe de elétrons atravessa a amostra, onde é então focada pela lente objetiva para formar uma imagem. O Met pode facilmente visualizar amostras de matéria mole com uma resolução espacial abaixo de 1 nm de tamanho (Henry, 2005; Kuntsche et al., 2011; Ruozi et al., 2011). Esta técnica pode ser mais categorizada com base no método de preparação de amostras utilizado-em particular, coloração negativa, freeze – fratura e GDT criogênico. Pode fornecer informações sobre as modificações da superfície das nanopartículas, uma vez que proporciona melhor contraste e contorno das imagens do que outras técnicas de microscopia. Por exemplo, a conjugação da transferrina à superfície dos lipossomas de colesterol/DSPC mostrou um revestimento da superfície de partículas com um met de coloração negativa, que estava ausente nas preparações não conjugadas de lipossomas (Anabousi et al., 2005). Num ensaio separado, foram adicionados anticorpos específicos contra a transferrina humana antes do procedimento de coloração negativa para confirmar a identidade do revestimento da superfície de partículas (Anabousi et al., 2005). Portanto, o Met oferece a possibilidade de alcançar uma resolução muito melhorada ao avaliar a conjugação de ligantes à superfície dos lipossomas.
técnica de coloração negativa
em met de coloração negativa, a preparação da amostra envolve a colocação de uma pequena quantidade de amostra hidratada numa grelha. Uma vez que as vesículas estão em contacto directo com a grelha, a sua orientação e morfologia podem ser afectadas, pelo que este facto deve ser tido em conta (Bibi et al., 2011). Também é necessário incorporar os lipossomas em um material denso de elétrons adequado (ex., sais de metal pesado como acetato de uranilo ou ácido fosfotungstico) que fornece alto contraste, então vesículas podem ser vistas contra um fundo corado escuro (Ruozi et al., 2011). A técnica de coloração negativa é relativamente rápida e simples; no entanto, tem sido mostrado causar mudanças na estrutura lipossômica original e pode levar à criação de franjas claras e escuras que podem ser confundidas com estruturas lamelares (Bibi et al., 2011; Ruozi et al., 2011). Além disso, a colocação da amostra sob vácuo pode causar uma maior desidratação da amostra, o que pode novamente causar alterações na estrutura das vesículas (Bibi et al., 2011). Embora a técnica do Met de coloração negativa possa proporcionar uma ampliação muito maior para as nanopartículas de imagem, os danos na estrutura lipossómica dificultam a avaliação precisa das características morfológicas da amostra. Portanto, outras técnicas de imagem são geralmente necessárias para confirmar os resultados.a técnica de freeze-fracture não requer qualquer processo de secagem e pode fornecer informações adicionais sobre a estrutura interna das nanopartículas (Kuntsche et al., 2011). Este método envolve a colocação de uma amostra numa grelha MET que está inserida entre dois suportes de cobre ou ouro (Severs, 2007). A amostra é vitrificada por congelação rápida, tipicamente com propano líquido ou nitrogênio líquido, antes de ser fracturada ao longo de áreas da amostra com fracas interações moleculares. Esta superfície de fratura pode ser ainda mais gravada e sombreada com uma fina camada de platina ou carbono para fornecer uma réplica “negativa” do plano de amostra de fratura (Severs, 2007; Kuntsche et al., 2011). A réplica é então limpa com um solvente orgânico para remover todos os resíduos antes da visualização sob um microscópio met. Como estas réplicas são tão estáveis, elas podem ser armazenadas e vistas mais tarde (Kuntsche et al., 2011). A principal vantagem desta técnica é que as réplicas refletem de perto o estado nativo da amostra, e podem fornecer informações detalhadas sobre a estrutura 3D das vesículas e organização bilayer (Bibi et al., 2011; Kuntsche et al., 2011). Esta informação inclui a construção multilamelar e o empacotamento bilamador de vesículas multilamelares. Esta técnica também pode avaliar o tamanho agregado e pode ser particularmente útil para examinar a interação dos lipossomas catiónicos com o DNA (Bibi et al., 2011). No entanto, artefatos ainda podem ocorrer na amostra durante a preparação devido à insuficiente taxa de congelamento, deposição de moléculas de solvente e/ou estresse mecânico (Severs, 2007; Kuntsche et al., 2011). Por exemplo, um” efeito rippling ” pode ocorrer sobre os SUV na amostra (Bibi et al., 2011). Esta é uma deformação bilayer comum que é devido a uma desordem nas transições das cadeias acil antes do congelamento. Vesículas incubadoras entre a temperatura de transição pré-transição e a temperatura de transição real também podem causar ondulações (Bibi et al., 2011). Curiosamente, isso pode ser usado para fornecer informações sobre as transições de fase lipídica que ocorrem com a natureza variável dos lípidos usados para preparações lipossômicas (Bibi et al., 2011).
TEM criogénico
TEM criogénico (cryo-TEM) é uma variação do TEM onde são utilizadas películas finas aquosas hidratadas vitrificadas em etano líquido antes da imagiologia. Esta técnica permite a análise de lipossomas em seu estado mais nativo, e é uma ferramenta valiosa para determinar o tamanho, forma, estrutura interna e lamelaridade dos lipossomas (Weisman et al., 2004; Bibi et al., 2011; Kuntsche et al., 2011). A principal vantagem de congelar rapidamente amostras de lipossomas é minimizar a formação de cristais de gelo e preservar proteínas ou outros materiais (Bibi et al., 2011; Kuntsche et al., 2011). Isto é benéfico quando as proteínas ou o ADN foram encapsulados dentro das nanopartículas (Weisman et al., 2004; Kuntsche et al., 2011). Crio-TEM é a forma mais útil de microscopia atualmente disponível para estudar lipossomas, uma vez que evita problemas com fixação química, desidratação, corte e coloração – todos eles podem afetar a morfologia das vesículas (Bibi et al., 2011). A gama de resolução é de ∼5 a 500 nm, conforme definido pela espessura do filme (Almgren et al., 2000). No entanto, várias limitações devem ser observadas com esta técnica, incluindo o fato de que apenas uma imagem 2D é obtida a partir de objetos 3D (que geralmente também se aplica à maioria das outras técnicas de microscopia). Para superar esta limitação, a reconstrução de formas 3D a partir de um número suficientemente grande de imagens 2D de partículas não esféricas orientadas aleatoriamente é possível (Orlova et al., 1999), bem como ver a amostra em diferentes ângulos de inclinação para obter informações sobre a forma 3D (Van Antwerpen e Gilkey, 1994). Tomografia eletrônica criogênica (crio-ET) também pode ser usada para atingir imagens 3D (Le Bihan et al., 2009). Crio-TEM também utiliza doses mais baixas de elétrons, o que significa que muitas vezes tem uma resolução mais baixa em comparação com outros métodos (Bibi et al., 2011; Kuntsche et al., 2011). Artefatos ainda são possíveis devido à formação de uma película fina de gelo amorfo e o uso de manchas na amostra aplicando forças de cisalhamento durante a formação do filme (Almgren et al., 2000; Bibi et al., 2011).
Microscopia Eletrônica de varrimento ambiental (ESEM)
microscopia eletrônica de varrimento ambiental (ESEM) é um sistema de imagem que não requer o uso de fixação, coloração ou congelamento de vesículas, e pode permitir a imagem de mudanças dinâmicas de sistemas húmidos sem preparação prévia de amostras (Muscariello et al., 2005; Ruozi et al., 2011). A principal característica do ESEM é a presença de vapor de água na câmara de microscópio. A capacidade de manter uma atmosfera contendo água em torno da amostra que pode ser parcialmente ou mesmo totalmente hidratada é possível através do uso de um sistema de vácuo graduado de abertura múltipla que permite que a câmara de imagem seja mantida a pressões até 55 hPa (Bibi et al., 2011; Ruozi et al., 2011). O feixe de elétrons primário pode gerar elétrons secundários que então encontram moléculas de vapor, levando a uma amplificação em cascata do sinal antes de chegar ao detector. Devido a isso, o ESEM não necessita de preparação de amostras (Muscariello et al., 2005). Esta técnica permite a variação no ambiente da amostra através de uma série de composições de pressão, temperatura e gás (Mohammed et al., 2004), que é útil para determinar como as mudanças ambientais afetam as vesículas. Isto aplica-se à formulação nanofarmacêutica e aos estudos de estabilidade (Bibi et al., 2011). O ESEM também tem sido usado para analisar o carregamento de drogas no bilayer de lipossomas (Mohammed et al., 2004), bem como determinar o tamanho e a forma das vesículas. Uma limitação do ESEM é que ele não pode fornecer informações detalhadas sobre a lamelaridade e arquitetura interna das estruturas nanoscais (Ruozi et al., 2011).microscopia de Força Atômica (em inglês “Atomic Force Microscopy”) é um tipo de técnica de microscopia de varredura. Funciona executando uma ponta afiada ligada a um cantilever e sensor sobre a superfície de uma amostra e medindo as forças da superfície entre a sonda e a amostra (Sitterberg et al., 2010). Como o cantilever corre ao longo da superfície da amostra, ele se move para cima e para baixo devido às características da superfície e o cantilever se deflecte de acordo. Esta deflexão é geralmente quantificada usando um sensor óptico, com o feixe laser sendo refletido na parte de trás do cantilever sobre o detector de luz (Sitterberg et al., 2010). O AFM não precisa operar no vácuo e pode operar no ar ambiente ou no líquido; por isso, está sendo cada vez mais usado para a imagem de amostras biológicas, bem como nanopartículas (Liang et al.,2004a, b; Ruozi et al., 2005, 2009). A AFM tem uma resolução excelente na ordem de frações de um nanômetro e pode fornecer uma imagem 3D de lipossomas, juntamente com detalhes sobre morfologia, distribuição de tamanho, homogeneidade e estabilidade (Liang et al.,2004a, b; Ruozi et al., 2005, 2007, 2009). O AFM pode ser usado para caracterizar as modificações superficiais dos lipossomas e detectar ligantes (por exemplo, anticorpos e polímeros) conjugados na superfície da membrana lipossómica (fazendas et al., 1999; Moutardier et al., 2003; Anabousi et al., 2005; Liang et al., 2005). Por exemplo, fazendas et al. usado AFM para ampliar a borda da membrana lipossómica e foram capazes de imagens de estruturas triméricas, com aproximadamente 8-10 nm de diâmetro, o que representou o acoplamento de anticorpos IgG à superfície lipossómica (fazendas et al., 1999). Os resultados mostraram que a eficácia da técnica foi altamente dependente do método de conjugação utilizado, sendo os anticorpos conjugados directamente à superfície lipossómica visíveis com o AFM (mobilidade proteica restrita), em comparação com os anticorpos ligados às cadeias PEG. Foi sugestivo que as cadeias PEG causaram elevada mobilidade proteica e, portanto, não puderam ser escaneadas (fazendas et al., 1999). Por outro lado, Anabousi et al mostraram que a incorporação de lípidos Peguilados nos lipossomas induziu uma estabilização estérica com lipossomas mantendo uma forma esférica (Anabousi et al., 2005). As imagens AFM da superfície dos lipossomas não conjugados eram lisas e nenhuma estrutura podia ser observada, enquanto a conjugação de transferrina à superfície dos lipossomas Peguilados foi visualizada como pequenas estruturas globulares (Anabousi et al., 2005). Da mesma forma, Moutardier et al fabricou lipossomas com núcleos poliméricos (LSP) que consistiam de drogas carregadas em partículas poliméricas que formavam o núcleo das vesículas lipídicas (Moutardier et al., 2003). Imagens tiradas usando AFM mostraram a presença de uma rede de polímeros na superfície exterior, o que sugere que o núcleo polimérico de colagénio irradiou para fora e formou uma camada superficial no LSP (Moutardier et al., 2003). Além dos detalhes estruturais da superfície, a AFM pode fornecer informações sobre as propriedades mecânicas e químicas de uma superfície de amostra através de medições de força (Ruozi et al., 2007). Por exemplo, Mao et al. utilizou esta técnica para avaliar a elasticidade e propriedades adesivas dos lipossomas (Mao et al., 2004). Uma limitação do AFM é a necessidade de as nanopartículas serem adsorvidas em superfícies de suporte, tais como mica ou bolachas de silício. A adsorção de lipossomas em um substrato sólido tem o potencial de modificar o tamanho e a forma das vesículas, e causar seu achatamento. (Ruozi et al., 2007). Além disso, o contato periódico da ponta da sonda pode arrastar os lipossomas enquanto se move através das vesículas em uma amostra (Jass et al., 2000). Apesar disso, o AFM ainda é uma ferramenta útil na avaliação dos lipossomas.
conclusão
existe uma ampla gama de técnicas de imagem disponíveis para avaliar a morfologia dos lipossomas, cada um com suas próprias vantagens e desvantagens. A microscopia de luz pode fornecer detalhes gerais sobre o tamanho e a forma das vesículas maiores e a homogeneidade de uma amostra de uma forma relativamente rápida. Inversamente, TEM é a técnica mais comumente usada para examinar a morfologia dos lipossomas em muito mais detalhes.; no entanto, o potencial para alterações estruturais em cada subtipo met devido a coloração e/ou exposição a condições de vácuo deve ser considerado na interpretação dos resultados. O ESEM é mais útil na determinação de alterações lipossômicas em resposta ao meio ambiente, enquanto o AFM está emergindo como um método útil na análise morfológica de nanopartículas e fornece a resolução máxima da superfície lipossômica. Tanto o AFM como o Met são capazes de visualizar ligantes conjugados à superfície dos lipossomas e fornecer informações complementares sobre modificações da superfície. Em geral, a escolha da técnica depende das características morfológicas e do grau de detalhe requerido. Além disso, a compreensão dos potenciais efeitos do método de preparação de amostras de cada técnica de imagem é importante no processo de seleção.
contribuições dos autores
redacção do manuscrito: a-LR e SH. Revisão crítica do artigo para conteúdo intelectual importante: SH, PD, JF, WP, AM, DS e AW.
Declaração de conflito de interesses
os autores declaram que a investigação foi realizada na ausência de quaisquer relações comerciais ou financeiras que possam ser interpretadas como um potencial conflito de interesses.
agradecimentos
os autores desejam agradecer ao Pharmacy Research Trust de New South Wales, à Rebecca L. Cooper Medical Research Foundation, à Gladys M. Brawn Fellowship, ausEE Research Foundation, e à Universidade de Newcastle por fornecerem apoio financeiro para a nossa investigação.
Adler, K., and Schiemann, J. (1985). Caracterização dos lipossomas por varrimento de microscopia eletrônica e técnica de freeze-fracture. Micron Microsc. Acta 16, 109-113. doi: 10.1016/0739-6260(85)90039-5
CrossRef Texto Completo | Google Scholar
Almgren, M. Edwards, K., e Karlsson, G. (2000). Microscopia eletrônica de transmissão criogênica de lipossomas e estruturas relacionadas. Os Colóides Surfam. Um Físico. Eng. Aspide. 174, 3–21. doi: 10.1016/S0927-7757(00)00516-1
CrossRef Texto Completo | Google Scholar
Anabousi, S., Laue, M., Lehr, C. M., Bakowsky, U., and Ehrhardt, C. (2005). Avaliar a modificação da transferrina dos lipossomas por microscopia de força Atómica e microscopia electrónica de transmissão. Euro. J. Pharm. Biopharm. 60, 295–303. doi: 10.1016 / j. ejpb.2004.12.009
PubMed Abstract | CrossRef Full Text | Google Scholar
Bagatolli, L. A. (2009). Membranas e microscopia de fluorescência. Reviews in Fluorescence 2007. New York, NY: Springer, 33-51. doi: 10.1007 / 978-0-387-8722-7_2
CrossRef Full Text | Google Scholar
Bakker-Woudenberg, I. A., Storm, G., and Woodle, M. C. (1994). Lipossomas no tratamento de infecções. J. Alvo Da Droga. 2, 363–371. doi: 10.3109 / 10611869408996811
PubMed Abstract | CrossRef Full Text/Google Scholar
fazendas, G. (2001). Imunolipossomas: uma abordagem promissora para atingir a terapia do cancro. Biodrogas 15, 215-224. doi: 10.2165/00063030-200115040-00002
CrossRef Texto Completo | Google Scholar
Bendas, G., Krause, R., Bakowsky, U., Vogel, J., e Rothe, U. (1999). Capacidade de obtenção de imunolipossomas novos preparados por uma nova técnica de conjugação de anticorpos. T. J. Pharm. 181, 79–93. doi: 10.1016/S0378-5173(99)00002-2
PubMed Resumo | CrossRef Texto Completo | Google Scholar
Bibi, S., Kaur, R., Henriksen-Lacey, M., McNeil, S. E., Wilkhu, J., Lattmann, E., et al. (2011). Imagem microscópica de lipossomas: desde tampas até SEM ambiental. T. J. Pharm. 417, 138–150. doi: 10.1016 / j. ijpharm.2010.12.021
PubMed Resumo | CrossRef Texto Completo | Google Scholar
Bouvrais, H., Pott, T., Bagatolli, L. A., Ipsen, J. H., e Meleard, P. (2010). Impacto das sondas fluorescentes ancoradas em membranas nas propriedades mecânicas dos bilayers lipídicos. Biochim. Biophys. Acta 1798, 1333-1337. doi: 10.1016 / j. bbamem.2010.03.026
PubMed Abstract | CrossRef Full Text | Google Scholar
Cullis, P. R., Chonn, A., and Semple, S. C. (1998). Interacções dos lipossomas e sistemas de transporte à base de lípidos com proteínas sanguíneas: relação com o comportamento de depuração in vivo. Adv. Drug Deliv. Rev. 32, 3-17. doi: 10.1016/S0169-409X(97)00128-2
PubMed Resumo | CrossRef Texto Completo | Google Scholar
Ding, B. S., Dziubla, T., Shuvaev, V. V., Muro, S., e Muzykantov, V. R. (2006). Sistemas avançados de distribuição de drogas que visam o endotélio vascular. Mol. Interv. 6, 98–112. doi: 10.1124 / mi.6.2.7
PubMed Abstract | CrossRef Full Text/Google Scholar
Henry, C. R. (2005). Morfologia das nanopartículas suportadas. Programa. Surf. Ciência. 80, 92–116. doi: 10.1016 / j. progsurf.2005.09.004
CrossRef Full Text | Google Scholar
Hua, S. (2013). Alvos de locais de inflamação: molécula de aderência intercelular-1 como alvo de novas terapêuticas inflamatórias. Frente. Farmacol. 4:127. doi: 10.3389 / fphar.2013.00127
PubMed Abstract | CrossRef Full Text | Google Scholar
Hua, S., Marks, E., Schneider, J. J., and Keely, S. (2015). Avanços nos sistemas de nano-administração oral para o fornecimento de medicamentos direccionados para o cólon na doença inflamatória intestinal: alvo selectivo para tecido doente versus tecido saudável. Nanomedicina 11, 1117-1132. doi: 10.1016 / j. nano.2015.02.018
PubMed Abstract | CrossRef Full Text/Google Scholar
Hua, S., and Wu, S. Y. (2013). A utilização de nanocarriadores à base de lípidos para terapias específicas para a dor. Frente. Farmacol. 4:143. doi: 10.3389 / fphar.2013.00143
PubMed Abstract | CrossRef Full Text | Google Scholar
Ishida, T., Harashima, H., and Kiwada, H. (2001). Interacções dos lipossomas com as células in vitro e in vivo: opsonins and receptors. Curr. Drug Metab. 2, 397–409. doi: 10.2174/1389200013338306
PubMed Abstract | CrossRef Full Text | Google Scholar
Jass, J., Tjarnhage, T., and Puu, G. (2000). From liposomes to supported, planar bilayer structures on hydrophilic and hydrophobic surfaces: an atomic force microscopy study. Biophys. J. 79, 3153–3163. doi: 10.1016/S0006-3495(00)76549-0
PubMed Abstract | CrossRef Full Text | Google Scholar
Klymchenko, A. S., Oncul, S., Didier, P., Schaub, E., Bagatolli, L., Duportail, G., et al. (2009). Visualization of lipid domains in giant unilamellar vesicles using an environment-sensitive membrane probe based on 3-hydroxyflavone. Biochim. Biophys. Acta 1788, 495-499. doi: 10.1016 / j. bbamem.2008.10.019
PubMed Abstract | CrossRef Full Text | Google Scholar
Kuntsche, J., Horst, J. C., and Bunjes, H. (2011). Microscopia eletrônica de transmissão criogênica (crio-TEM) para estudar a morfologia dos sistemas coloidais de distribuição de drogas. T. J. Pharm. 417, 120–137. doi: 10.1016 / j. ijpharm.2011.02.001
PubMed Resumo | CrossRef Texto Completo | Google Scholar
Le Bihan, O., Bonnafous, P., Marak, L., Bickel, T., Trepout, S., Mornet, S., et al. (2009). Tomografia crioelectrónica da transmigração nanoparticular para lipossoma. J. Struct. Biol. 168, 419–425. doi: 10.1016 / j. jsb.2009.07.006
PubMed Abstract | CrossRef Full Text | Google Scholar
Liang, X., Mao, G., and Ng, K. Y. (2004a). Propriedades mecânicas e medição da estabilidade de lipossomas contendo colesterol em mica por microscopia de força atómica. J. Colloid Interface Sci. 278, 53–62.
PubMed Abstract/Google Scholar
Liang, X., Mao, G., and Ng, K. Y. (2005). Effect of chain lengths of PEO-PPO-PEO on small unilamellar liposome morphology and stability: an AFM investigation. J. Colloid Interface Sci. 285, 360–372. D. O. I.: 10.1016 / j. jcis.2004.11.042
PubMed Abstract | CrossRef Full Text | Google Scholar
Liang, X., Mao, G., and Simon Ng, K. Y. (2004b). Sondando pequenas vesículas unilamelares de EggPC na superfície da mica por microscopia de força atômica. Os Colóides Surfam. B Biointerfaces 34, 41-51.
PubMed Abstract/Google Scholar
Mao, G., Liang, X., and Ng, K. Y. S. (2004). Encyclopedia of Nanoscience and Nanotechnology. New York, NY: Marcel Dekker.
Google Scholar
Mastrobattista, E., Koning, G. A., and Storm, G. (1999). Imunolipossomas para o fornecimento específico de medicamentos antitumores. Adv. Drug Deliv. Rev. 40, 103-127. doi: 10.1016/S0169-409X(99)00043-5
CrossRef Texto Completo | Google Scholar
Mertins, O., and Dimova, R. (2013). Insights on the interactions of chitosan with phospholipid vesicles. Parte II: rigidez das membranas e formação de poros. Langmuir 29, 14552-14559. doi: 10.1021 / la4032199
PubMed Abstract | CrossRef Full Text/Google Scholar
Metselaar, J. M., and Storm, G. (2005). Lipossomas no tratamento de doenças inflamatórias. Perito Em Opin. Farmácia. 2, 465–476. doi: 10.1517/17425247.2.3.465
PubMed Resumo | CrossRef Texto Completo | Google Scholar
Mohammed, A. R., Weston, N., Coombes, A. G., Fitzgerald, M., and Perrie, Y. (2004). Formulação lipossómica de medicamentos pouco solúveis em água: optimização do Carregamento de medicamentos e análise da estabilidade do sistema de gestão de resíduos. T. J. Pharm. 285, 23–34. doi: 10.1016 / j. ijpharm.2004.07.010
PubMed Resumo | CrossRef Texto Completo | Google Scholar
Moutardier, V., Tosini, F., Vlieghe, P., Cara, L., Delpero, J. R., e Clerc, T. (2003). As biodisponibilidade dos medicamentos anticancerígenos coloidais em modelos de administração oral. T. J. Pharm. 260, 23–38. doi: 10.1016 / S0378-5173(03)00231-X
PubMed Abstract | CrossRef Full Text | Google Scholar
Murphy, D. B., and Davidson, M. W. (2012a). Microscopia A Laser Confocal. Fundamentals of Light Microscopy and Electronic Imaging, 2nd Edn. Hoboken, NJ: John Wiley & Sons, 265-305. DOI: 10.1002/9781118382905.ch13
CrossRef Full Text | Google Scholar
Murphy, D. B., and Davidson, M. W. (2012b). Microscopia De Fluorescência. Fundamentos da microscopia de luz e imagem Electrónica. Weinheimcity in Germany: John Wiley & Sons, 199-231. DOI: 10.1002/9781118382905.ch11
CrossRef Full Text | Google Scholar
Murphy, D. B., and Davidson, M. W. (2012c). Fundamentos da microscopia de luz e imagem Electrónica. Hoboken, NJ: John Wiley & Sons, 1-19. doi: 10.1002/9781118382905
CrossRef Texto Completo | Google Scholar
Murphy, D. B., e Davidson, M. W. (2012d). Microscopia De Polarização. Fundamentos da microscopia de luz e imagem Electrónica. Hoboken, NJ: John Wiley & Sons, 153-171. doi: 10.1002/9781118382905.ch9
CrossRef Texto Completo | Google Scholar
Muscariello, L., Rosa, F., Marinho, G., Giordano, R., Barbarisi, M., Cafiero, G., et al. (2005). Uma visão crítica das aplicações ESEM no campo biológico. J. Cell. Physiol. 205, 328–334. doi: 10.1002 / jcp.20444
PubMed Resumo | CrossRef Texto Completo | Google Scholar
Nallamothu, R., Madeira, G. C., Pattillo, C. B., Silva, R. C., Kiani, M. F., Moore, B. M., et al. (2006). Um sistema de administração de lipossomas orientado para a vasculatura tumoral para a combretastatina A4: concepção, caracterização e avaliação In vitro. AAPS PharmSciTech 7: E32. doi: 10.1208/pt070232
PubMed Resumo | CrossRef Texto Completo | Google Scholar
Nirale, N. M., Vidhate, R. D., e Nagarsenker, M. S. (2009). Lipossomas de propionato de fluticasona para administração pulmonar. Indian J. Pharm. Ciência. 71, 709–711.
Google Scholar
Orlova, E. V., Sherman, M. B., Chiu, W., Mowri, H., Smith, L. C., and Gotto, A. M. Jr. (1999). Three-dimensional structure of low density lipoproteins by electron cryomicroscopy. Proc. Natl. Acad. Sci. U.S.A. 96, 8420–8425. doi: 10.1073/pnas.96.15.8420
CrossRef Full Text | Google Scholar
Ruozi, B., Belletti, D., Tombesi, A., Tosi, G., Bondioli, L., Forni, F., et al. (2011). AFM, ESEM, TEM, and CLSM in liposomal characterization: a comparative study. Int. J. Nanomedicine 6, 557–563. doi: 10.2147/IJN.S14615
PubMed Abstract | CrossRef Full Text | Google Scholar
Ruozi, B., Tosi, G.), Forni, F., Fresta, M., and Vandelli, M. A. (2005). Atomic force microscopy and photon correlation spectroscopy: two techniques for rapid characterization of liposomes. Euro. J. Pharm. Ciência. 25, 81–89. doi: 10.1016 / j. ejps.2005.01.020
PubMed Abstract | CrossRef Full Text | Google Scholar
Ruozi, B., Tosi, G., Leo, E., and Vandelli, M. A. (2007). Aplicação de microscopia de força atômica para caracterizar lipossomas como portadores de drogas e genes. Talanta 73, 12-22. doi: 10.1016 / j. talanta.2007.03.031
PubMed Resumo | CrossRef Texto Completo | Google Scholar
Ruozi, B., Tosi, G., Tonelli, M., Bondioli, L., Mucci, A., Forni, F., et al. (2009). AFM phase imaging of soft-hydrated samples: a versatile tool to complete the chemical-physical study of liposomes. J. Liposome Res. 19, 59-67. doi: 10.1080 / 08982100802584071
PubMed Abstract | CrossRef Full Text/Google Scholar
Sawant, R., and Torchilin, V. P. (2012). Desafios no desenvolvimento de terapeuticas lipossómicas específicas. AAPS J. 14, 303-315. doi: 10.1208 / s12248-012-9330-0
PubMed Abstract | CrossRef Full Text | Google Scholar
Senior, J. H. (1987). Fate and behavior of liposomes in vivo: a review of controlling factors. Critico. Rev. Ther. Traficante Syst. 3, 123–193.
PubMed Resumo | Google Scholar
Sercombe, L., Veerati, T., Moheimani, F., Wu, S. Y., Sood, A. K., e Hua, S. (2015). Avanços e desafios do fornecimento de drogas assistido por lipossomas. Frente. Farmacol. 6:286. doi: 10.3389 / fphar.2015.00286
CrossRef Full Text | Google Scholar
Severs, N. J. (2007). Freeze-fracture electron microscopy. Nat. Protoc. 2, 547–576. doi: 10.1038/nprot.2007.55
PubMed Abstract | CrossRef Full Text | Google Scholar
Sitterberg, J., Ozcetin, A., Ehrhardt, C., and Bakowsky, U. (2010). Utilising atomic force microscopy for the characterisation of nanoscale drug delivery systems. Eur. J. Pharm. Biopharm. 74, 2–13. doi: 10.1016/j.ejpb.2009.09.005
PubMed Abstract / CrossRef Full Text | Google Scholar
Torchilin, V. P. (1994). Imunolipossomas e imunolipossomas Peguilados: possível utilização para o fornecimento específico de agentes de imagem. Immunometods 4, 244-258. doi: 10.1006 / immu.1994.1027
PubMed Abstract | CrossRef Full Text/Google Scholar
Van Antwerpen, R., and Gilkey, J. C. (1994). Microscopia crio-electrónica revela subestrutura lipoproteica humana de baixa densidade. J. Lipid Res. 35, 2223-2231.
PubMed Abstract | Google Scholar
Wang, X., Song, Y., Su, Y., Tian, Q., Li, B., Quan, J., et al. (2015). Are PEGylated liposomes better than conventional liposomes? A special case for vincristine. Drug Deliv. 29, 1–9. doi: 10.3109/10717544.2015.1027015
PubMed Abstract | CrossRef Full Text | Google Scholar
Weisman, S., Hirsch-Lerner, D., Barenholz, Y., and Talmon, Y. (2004). Nanostructure of cationic lipid-oligonucleotide complexes. Biophys. J. 87, 609–614. doi: 10.1529/biophysj.103.033480
PubMed Abstract | CrossRef Full Text/Google Scholar
Willis, M., and Forssen, E. (1998). Lipossomas com ligante. Adv. Drug Deliv. Rev. 29, 249-271. doi: 10.1016/S0169-409X(97)00083-5
CrossRef Texto Completo | Google Scholar
Zununi Vahed, S., Salehi, R., Davaran, S., e Sharifi, S. (2017). Sistemas de co-administração de medicamentos baseados em lipossomas em células cancerígenas. Madre. Ciência. Eng. C Mater. Biol. Appl. 71, 1327–1341. doi: 10.1016 / j. msec.2016.11.073
PubMed Abstract | CrossRef Full Text | Google Scholar
Leave a Reply