Fronteiras em Oncologia
Introdução
Cerca de 25% do início de pacientes com câncer de mama ainda detectar a recorrência local e desenvolver metástases à distância após o tratamento ativo (1), e cerca de 10% dos pacientes no estágio IV da doença, no diagnóstico inicial, no mundo desenvolvido, o que é referido como “de novo” câncer de mama metastático (MBC) (2). Apesar dos avanços do tratamento, o hemograma permanece incurável, e até 70-80% dos pacientes morrem de câncer em 5 anos (2). Como resultado da heterogeneidade dos leucócitos, são desenvolvidos vários modelos de prognóstico baseados em fatores ou pontuações de prognóstico para prever os seus resultados clínicos e para direcionar os clínicos a tomarem decisões terapêuticas apropriadas (3-5). Além disso, há também uma variedade de modelos de prognóstico para o câncer de mama com metástase cerebral (BCBM) para os médicos para prever com precisão a sobrevivência nestes pacientes (6, 7).o cancro da mama pode metastizar-se em qualquer parte do corpo, mas metastase principalmente no pulmão, osso, fígado, gânglios linfáticos não axilares e cérebro (8). Notavelmente, a metástase hepática (LM) não é apenas um local metastático comum, mas também associada a um aumento significativo do risco de morte semelhante à metástase cerebral, uma mortalidade desproporcionalmente mais elevada em comparação com metástases pulmonares ou ósseas (5, 8). Como a avaliação prognóstica (GPA) é amplamente aceita em pacientes BCBM, os modelos prognósticos acima mencionados estimulam-nos a propor um modelo prático para BCLM (3-7). O nosso objectivo era construir um modelo prognóstico fiável e convivial para a BCLM e avaliar a sua concordância e precisão, validando-o tanto internamente como externamente. O modelo de prognóstico pode ajudar os clínicos a estimar o risco de morte de doentes com BCLM e a selecionar o tratamento ideal.
doentes e métodos
selecção de doentes
o presente estudo foi aprovado pelos comités de ética independentes do FUSCC. Foram identificados doentes com hemograma completo consecutivos diagnosticados no FUSCC entre janeiro de 2007 e dezembro de 2018 (n = 9.062). Os critérios de elegibilidade foram os seguintes:: (1) cancro da mama confirmado histologicamente, (2) doentes do sexo feminino, (3) fígado como o primeiro local de doença metastática no cancro da mama metastático ou recorrente de novo, e (4) registos completos e pormenorizados. Foram excluídos doentes com cancro da mama bilateral, outras neoplasias invasivas ou com seguimento desconhecido. Por último, foram seleccionados 1022 doentes elegíveis para análise adicional. Os passos completos da seleção são mostrados na figura S1.foi recolhida informação sobre as seguintes variáveis clinicopatológicas: idade, subtipos moleculares, informação prévia do tratamento (cirurgia e quimioterapia sistémica), IFM, locais de metástase extra-hepática (cérebro, pulmão, osso e gânglios linfáticos), características de metástase hepática (distribuição, número, diâmetro máximo), hemoglobina (HB), testes da função hepática e tempo de sobrevivência. Os subtipos moleculares incluíram o estado do receptor hormonal (HR) e do receptor 2 do factor de crescimento epidérmico humano (HER2). Definimos a IFM como o intervalo entre a data de diagnóstico do cancro da mama primário e a data da primeira metástase distante. Os pontos de corte da IFM utilizados neste estudo foram de 3 e 24 meses de acordo com a referência (9). Assim, os doentes podem ser divididos em três grupos: doentes com MBC de novo (MFI < 3 meses), doentes com uma IFM curta (≤ 24 meses) e doentes com uma IFM longa > 24 meses. Metástase de gânglios linfáticos distantes foi definida como metástase a partir de gânglios linfáticos ipsilaterais axilares, supraclaviculares, infraaclaviculares ou internos mamários. O diagnóstico de LM foi baseado na imagem radiográfica ou evidência patológica. As características das metástases hepáticas foram avaliadas com a ajuda de tomografia computadorizada abdominal (TC), imagiologia por ressonância magnética (MRI), ou amostras de ressecção cirúrgica. Testes de função hepática foram, também, analisadas no presente estudo, incluindo bilirrubina total, alanina aminotransferase (ALT), aspartato aminotransferase (AST), fosfatase alcalina (ALP), lactato desidrogenase (LDH), e γ-glutamil transferase, a albumina ratio (GAR). Foram colhidas amostras de sangue para testes laboratoriais no prazo de uma semana após o diagnóstico de LM. As classificações de distribuição, número ou diâmetro máximo das metástases hepáticas e LDH foram baseadas em outros estudos (10-13). Os valores de corte para a HB, bilirrubina total, ALT, AST e ALP foram determinados de acordo com os critérios terminológicos comuns para eventos adversos (CTCAE) porque anomalias moderadas ou de grau II nos níveis de hemoglobina ou função hepática podem influenciar escolhas terapêuticas (14). O valor de GAR foi definido como uma razão simples entre o nível de serumi-glutamil transferase (GGT, U/L) e o nível de albumina sérica (ALB g/L). OS do tempo de metástase foi medido a partir da data de diagnóstico de LM até a morte para qualquer causa. O último período de acompanhamento foi novembro de 2019, com um tempo mediano de acompanhamento de 18, 63 meses. Se os pacientes foram perdidos para acompanhamento, foi censurado no último dia de acompanhamento.
análise estatística
os doentes foram divididos em formação (2007-2016, n = 715) e validação (2016-2018, n = 307) num rácio de 7:3. O valor de corte ideal para a GAR foi escolhido pelo cálculo da análise da curva característica de operação do Índice de Youden e do receptor (ROC) (figura S2). Pearson chi-squared test ou o teste exato de Fisher foi utilizado para fazer uma comparação entre as variáveis categóricas. Cox proportional hazards regression models with the backward selection method were used for multivariate analysis and to compute hazard ratios. Os coeficientes de regressão foram calculados através da análise de regressão multivariada e depois multiplicados por 10 e arredondados para representar pontuações prognósticas finais. A inicialização foi usada para validação interna. Em seguida, curvas ROC e parcelas de calibração dependentes do tempo foram usadas para avaliar a discriminação e calibração deste modelo prognóstico no conjunto de validação. Os valores de corte dos grupos de risco foram determinados pelas parcelas X-tile (15). A análise de sobrevivência foi realizada usando curvas de sobrevivência Kaplan-Meier, e testes log-rank foram usados para comparar curvas de sobrevivência. Todos os valores de P eram de duas faces, e os valores de P < 0, 05 foram considerados estatisticamente significativos. A análise estatística foi realizada utilizando software SPSS (SPSS 20, Chicago, IL, EUA) e software R Versão 4.0.1.
os resultados
características e relação com a estratificação do risco
um total de 1022 doentes seleccionados neste estudo foram divididos em conjuntos de Formação (n = 715) e validação (n = 307). Os quadros 1 e S1 apresentam uma descrição das características clinicopatológicas. No grupo de formação, foram 126 pacientes (17,6%) do diagnosticada de novo MBC e 589 pacientes (82.4%) com recorrentes MBC, dos quais 297 pacientes (50.4%) teve um curto IFM e 292 pacientes (49.6%) tinham um longo das IFM. A idade mediana no diagnóstico de LM foi de 50 anos (intervalo de 21-87) com 617 doentes (86.3%) menos de 60 anos. Destes doentes, a proporção de doentes HR-positivos e HER2-positivos foi de 62, 2 e 38, 0%, respectivamente. Entre os pacientes recorrentes com hemograma completo, quase todos os pacientes foram submetidos a cirurgia no tumor primário (584, 99, 2%) e receberam quimioterapia adjuvante (neo) (569, 96, 6%). Os padrões de metástases distantes mostraram que o local mais comum de metástase extra-hepática foi o osso (42,7%) seguido por gânglios linfáticos distantes (36,1%), pulmão (25,6%) e cérebro (2,9%). A metástase hepática foi caracterizada por distribuição difusa e pequenos nódulos, a maioria dos quais eram múltiplos (≥3 metástases, 77,3%) mas pequenos nódulos (≤3 cm, 59,4%) e envolvia lóbulos direito e esquerdo (74,4%). Na fase inicial da LM, a função hepática foi diminuída em vários graus, mas geralmente ligeira. O aumento da LDH (36.1%) e GAR (35.9%), parecia ser sensível disfunção hepática indicadores, e moderada ou acima de anormalidades no HB (2.9%), bilirrubina total (2.7%), ALT (3.6%), AST (9.5%), e ALP (3.9%) os níveis eram incomuns de acordo com CTCAE. Em comparação com o grupo de baixo risco, o grupo de risco intermédio e elevado apresentou uma taxa mais elevada de negatividade HR e HER2, uma IFM curta, metástase extra-hepática, carga tumoral de metástase hepática e anomalias nos níveis de hemoglobina ou função hepática (todas as Ps ≤ 0, 001), sugerindo que estes factores podem afectar o prognóstico de BCLM.
a Tabela 1. Características de base e sua relação com a estratificação de risco do conjunto de formação.
modelo de prognóstico e validação
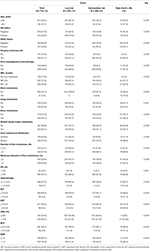
no modelo de regressão multivariada da Cox, subtipos moleculares (estado HR e HER2), IFM, locais de metástase extra-hepática (metástase cerebral, pulmonar e óssea) e testes da função hepática (bilirrubina total, LDH e GAR) foram associados ao OS (Quadro 2). Especificamente, o risco de morte RH negativo (RH 1.740, IC 95% 1.424–2.127, P < 0,001) e HER2 negativo (RH 1.615, 95% CI 1.316–1.983, P < 0.001) pacientes aumentou em relação ao RH ou HER2 positivo homólogos. O comprimento da IMF também teve um impacto significativo na sobrevivência de BCLM pacientes, e, portanto, a sobrevivência de pacientes com uma longa IFM (HR 1.612, IC 95% 1.195–2.174, P < 0.001) foi reduzido em comparação com os pacientes com de novo MBC, e pacientes com um curto IFM (HR 2.563, 95% CI 1.904–3.449, P < 0.001) tinha mais de duas vezes o risco de morte em relação a eles. Além disso, a presença de metástases extra-hepáticas (metástases cerebrais, pulmonares e ósseas) e da função hepática anormal (bilirrubina total, LDH e GAR) foram todas correlacionadas com um impacto prognóstico desfavorável sobre OS. Este prognóstico modelo teve a área sob a curva (AUC) de tempo-dependente ROC em 1 ano SO com 0.78 no conjunto de treinamento e 0,80 no conjunto de validação, indicando que este modelo teve uma boa discriminação (Figura 1). O método de inicialização foi usado para confirmar a estabilidade do nosso modelo prognóstico no conjunto de treinamento, e os resultados finais foram bastante robustos (tabela S2). As curvas de calibração do modelo prognóstico para um ano e 3 anos de SO no conjunto de treino, bem como para um ano de SO no conjunto de validação, mostraram a sua boa concordância (Figura 2).

Tabela 2. Modelo de regressão de Cox multivariável (conjunto de formação).
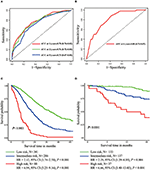
a Figura 1. Curvas ROC dependentes do tempo do modelo prognóstico no conjunto de formação (a) e no conjunto de validação (B). Sobrevivência global de metástases dos três grupos de prognóstico no conjunto de formação (C) e validação (D).
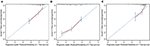
Figura 2. A curva de calibração para prever a sobrevivência do doente a 1 ano (a) e 3 anos (b) no conjunto de treino e a 1 ano (C) no conjunto de validação.
a Estratificação de Risco e Sobrevivência

a Tabela 3. Cálculo da pontuação e pontos de corte dos grupos prognósticos.
Discussão
Na presente análise de 1,022 pacientes tratados em nossa instituição a partir de 2007 para 2018, temos mostrado que moleculares subtipos (de RH e status HER2), IMF, os sítios de metástases extra-hepática (cérebro, pulmão, e as metástases ósseas), testes de função hepática (bilirrubina total, LDH, e GAR) foram fatores prognósticos independentes de BCLM pacientes. Assim, um modelo de prognóstico para pacientes com BCLM foi construído usando fatores de prognóstico.
no que diz respeito aos subtipos moleculares, o HR positivo pode indicar que o crescimento e proliferação do câncer de mama ainda são regulamentados por hormônios, chamados tumores hormonais dependentes. Ao mesmo tempo, a terapia endócrina tem benefícios, incluindo poucas reações adversas e efeitos duradouros, que muitas vezes podem trazer benefícios de sobrevivência a longo prazo para pacientes HR-positivos. Portanto, HR positivo tem sido considerado como um fator significativo sugerindo um prognóstico favorável no câncer de mama precoce e metastático.(1, 3-5, 8-10, 16). Embora a amplificação e sobreexpressão HER2 seja considerada como um preditor de um risco de metástase distante e morte relacionada com o câncer de mama, posteriormente desenvolvidos agentes anti–HER2 têm melhorado notavelmente a sobrevivência de pacientes com câncer de mama HER2 positivo (2, 9, 17). Na era da terapêutica-alvo, um estudo no sudeste dos Países Baixos concluiu que o risco de mortalidade dos doentes HER2 negativos aumentou 44% (IC 95% 1, 13-1, 83, P = 0, 003) em comparação com os doentes HER2 positivos (9). Em nosso estudo, o risco de morte de pacientes HR-negativos e HER2-negativos aumentou em comparação com os HR ou HER2-positivos, consistente com estas observações. Os doentes com uma IFM curta, geralmente definida como ≤24 meses, apresentavam um prognóstico pior (3, 5, 9). Além disso, os doentes de novo MBC pareciam ter um prognóstico significativamente melhor em relação aos doentes de hemograma recorrente, embora esta diferença tenha sido gradualmente reduzida com a extensão do intervalo sem doença (DFI) ou IFM (9, 18, 19). Lobbezoo et al. verificou-se que os doentes com IFM ≤24 meses tinham um tempo de sobrevivência significativamente mais curto (9, 1 vs. 29.4 meses, P < 0.001) do que aqueles com de novo estágio IV doenças, mas doentes com mais de IFM (>24 meses) tinham a mesma prognóstico (27.9 vs 29,4 meses, P = 0,73) (9). A possível razão para este fenómeno é que os doentes com hemograma recidivante previamente submetidos a terapêutica sistemática podem ser mais resistentes à quimioterapia do que os doentes sem terapêutica prévia com hemograma de novo, mas é necessária uma investigação mais aprofundada (9, 18, 19). Este estudo confirmou que o tempo de sobrevivência dos doentes com uma IFM longa foi encurtado em comparação com o de novo MBC com doentes com uma IFM curta, o que conferiu um resultado significativamente pior.a sobrevivência dos glóbulos brancos diferiu significativamente de acordo com os locais metastáticos e os doentes com metástases viscerais foram associados a um risco aumentado de mortalidade em comparação com os doentes com metástases não viscerais (3-5, 9, 18). Além disso, a presença de metástases cerebrais teve um impacto maior na sobrevivência do que qualquer outro local metastático(3, 5, 9, 18). Não foi surpreendente que múltiplas metástases tiveram uma influência mais desfavorável sobre o prognóstico.(3, 5, 9, 17, 18). Nesta análise, metástase extra-hepática, exceto para metástases dos gânglios linfáticos distantes, pode levar a uma menor sobrevivência, provavelmente porque a metástase hepática foi o fator crítico de risco de vida em comparação com metástases dos gânglios linfáticos.
deve-se notar que os doentes com níveis de bilirrubina mais elevados apresentaram um risco muito mais baixo para várias doenças em parte através das suas propriedades antioxidantes e anti-inflamatórias (20). Um estudo recente também relatou que uma redução de cerca de 40% do risco de morte foi demonstrada em pacientes com câncer de mama precoce com maior nível total de bilirrubina (21). No entanto, a hiperbilirrubinemia foi associada a um mau prognóstico entre os doentes com BCLM (22). É possível que, ao contrário da bilirrubina total relativamente mais elevada entre os doentes com cancro da mama não metastático, uma bilirrubina aumentada 1, 5 vezes mais do que o limite superior normal (LSN) entre os doentes com BCLM possa prever lesões hepáticas graves e, assim, contribuir para a interrupção do fármaco ou encefalopatia hepática.o efeito de Warburg faz com que as células cancerígenas dependam da glicólise aeróbica, mesmo quando o fornecimento de oxigénio é suficiente, o que é a marca do metabolismo do cancro em contraste com os tecidos normais (23). A LDH desempenha um papel indispensável na glicólise devido à sua capacidade de converter piruvato em lactato em condições anaeróbicas (24). Níveis desregulados de LDH podem refletir maior carga tumoral, menor resposta ao tratamento e prognóstico, que já haviam sido relatados em tumores múltiplos (21, 24-26). Uma meta-análise do efeito prognóstico da LDH em doentes com cancro da mama demonstrou que níveis mais elevados de LDH resultaram numa OS insatisfatória e na sobrevivência livre de progressão, que incluiu 11 estudos envolvendo 6.102 doentes (27).
GGT, o principal antioxidante endógeno, faz aminoácidos precursores assimilados e envolve na síntese de glutationa (28). A GGT nos tumores permite que as células reponham rapidamente a glutationa após receberem terapia anticancerosa pró-oxidante e, portanto, está correlacionada com a resistência ao fármaco e a baixa sobrevivência (29). Curiosamente, Fentiman et al. relatou-se que foi identificada uma relação significativamente positiva entre risco elevado de GGT e de cancro da mama (30). ALB sintetizado pelo fígado funciona como um antioxidante, transportador de nutrientes, e tem participação em vias de sinal devido às suas propriedades estruturais únicas (31). A hipoalbuminemia geralmente ocorre em pacientes com câncer avançado e é atribuída a vários mecanismos, incluindo diminuição da síntese hepática, aumento do catabolismo e cachexia (21,31). Hipoalbuminemia é um indicador independente de mau prognóstico de vários tumores.(21, 22, 32, 33). Em contraste com a diminuição dos níveis séricos de albumina, os níveis séricos de GGT tendem a ser elevados quando a função hepática está diminuída. Portanto, GAR baseado nos dois parâmetros acima pode ter a vantagem de refletir a capacidade de reserva hepática e prever o prognóstico (32, 33). No estudo actual, a função hepática anormal (bilirrubina total, LDH e GAR) estavam todas correlacionadas com um impacto prognóstico desfavorável sobre OS.
Após análise do prognóstico de 123 doentes com BCLM, Duan et al. verificou-se que os doentes com três ou mais metástases hepáticas transportavam 2.26 vezes o aumento do risco de morte em relação a doentes com<3 metástases hepáticas em análise multivariada (10). No entanto, as características da metástase hepática neste estudo parecem não fazer diferença. Existem duas razões potenciais que contribuem para esta discrepância. Em primeiro lugar, a distribuição, o número e o diâmetro máximo das metástases hepáticas foram significativamente diferentes nos três grupos de risco, indicando que o risco de mortalidade aumentou com a expansão das metástases hepáticas na análise univariada. Posteriormente, a função hepática anormal estava intimamente relacionada com a carga tumoral de metástases hepáticas, ajustando o papel destes fatores na análise multivariada.existem muitos estudos de prognóstico na definição de BCLM. Uma análise de 145 doentes com BCLM demonstrou que a hipoalbuminemia, a idade mais avançada e a negatividade do ER eram indicadores independentes da baixa sobrevivência (22). Uma análise do registro Grego obteve resultados semelhantes, em que a positividade HR, baixo grau histológico, ausência de metástase extra-hepática e bom estado de desempenho foram fatores prognósticos significativos para prognósticos favoráveis na análise univariada (34). Um estudo recente baseado na população, que incluiu mais de 4.000 doentes com BCLM de novo, identificou factores demográficos e socioeconómicos, grau patológico, número total de metástases extrahepáticas, tratamento e subtipo molecular como parâmetros que influenciam significativamente a sobrevivência global (17). Regierer et al. desenvolveu uma pontuação prognóstica para o MBC com base no estado de RH, IFM, e locais de metástases para prever o seu prognóstico e individualizar o tratamento ideal, que foi validado interna e externamente (5). Infelizmente, o estatuto de HER2 não foi incluído na pontuação prognóstica e, portanto, limitou a sua aplicabilidade. O GPA mamária modificado para pacientes BCBM integrando quatro parâmetros clínicos simples teve um papel imediato na previsão de sua sobrevivência, mas não foi aplicável para pacientes BCLM (7). Tanto quanto sabemos, não existe um modelo de prognóstico que integre esses fatores de prognóstico para pacientes com BCLM, por isso o nosso modelo faz sentido pragmático.
também houve algumas limitações nesta pesquisa. Em primeiro lugar, um estudo único e retrospectivo inevitavelmente resultou em viés de seleção, embora o nosso modelo prognóstico tenha sido validado interna e externamente. Em segundo lugar, os pacientes que desenvolveram metástases hepáticas mais tarde no curso da doença foram excluídos de modo que não fomos capazes de avaliar estes pacientes. Em terceiro lugar, não estavam disponíveis informações detalhadas sobre o desempenho e o tratamento neste estudo.
conclusões
apesar destas limitações, esta pesquisa pode fornecer um modelo prognóstico simples e confiável. A principal vantagem do nosso estudo é a incorporação de parâmetros facilmente acessíveis na prática clínica com base na grande amostra de pacientes BCLM. Além da classificação requintada de tumores de acordo com os métodos de sequenciamento de próxima geração, nosso modelo pode ajudar a identificar subgrupos com prognóstico diferente e orientar a terapia subsequente.
Dados de Disponibilidade Declaração
As contribuições originais apresentados no estudo estão incluídas no artigo/Material Suplementar, mais dúvidas podem ser encaminhadas para o autor correspondente/s.
Ética Instrução
O estudo foi aprovado pelos comitês de ética independentes de FUSCC. Os pacientes / participantes deram seu consentimento informado por escrito para participar deste estudo.
contribuições dos autores
LJ propôs o estudo. XZ e YG coletaram os dados. LJ e LF analisaram os dados e escreveram o primeiro rascunho. ZW revisou criticamente o manuscrito. Todos os autores contribuíram para o artigo e aprovaram a versão submetida.
conflito de interesses
os autores declaram que a pesquisa foi realizada na ausência de quaisquer relações comerciais ou financeiras que possam ser interpretadas como um potencial conflito de interesses.
agradecimentos
reconhecemos Lei Cheng para a realização da análise de dados.
material suplementar
abreviaturas
BCLM, cancro da mama com metástases hepáticas; FUSCC, Fudan University Shanghai Cancer Center; ROC, receiver operating characteristic curve; IMF, metastático livre de intervalo; de RH, hazard ratio; IC, intervalo de confiança; OS, a sobrevida geral; MBC, o cancro da mama metastático; BCBM, o câncer de mama com metástase cerebral; LM, metástase hepática; GPA, classificados de avaliação de prognóstico; HB, hemoglobina; HR, receptor de hormônio; HER2, human epidermal growth factor receptor 2; CT, tomografia computadorizada; ressonância magnética ressonância magnética; ALT, alanina aminotransferase; AST, aspartato aminotransferase; ALP, fosfatase alcalina; LDH, lactato desidrogenase; GAR, γ-glutamil transferase, a albumina relação; GGT, γ-glutamil transferase; ALB, albumina; CTCAE, critérios terminológicos comuns para efeitos adversos; LSN, limite superior do normal.
4. Puente J, Lopez-Tarruella S, Ruiz a, Lluch A, Pastor M, Alba E, et al. Índice de prognóstico prático para doentes com cancro da mama recorrente metastizado: análise retrospectiva de 2322 doentes do registo El Alamo Espanhol GEICAM. Tratamento Para Cancro Da Mama. (2010) 122:591–600. doi: 10.1007/s10549–009-0687–4
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Regierer AC, Wolters R, Ufen MP, Weigel A, Novopashenny I, Kohne CH, et al. An internally and externally validated prognostic score for metastatic breast cancer: analysis of 2269 patients. Ann Oncol. (2014) 25:633–8. doi: 10.1093/annonc/mdt539
PubMed Abstract | CrossRef Full Text
6. Marko NF, Xu Z, Gao T, Kattan MW, Weil RJ. Previsão da sobrevivência em mulheres com cancro da mama e metástases cerebrais: um nomograma supera os atuais modelos de previsão de sobrevivência. Cancer. (2012) 118:3749–57. doi: 10.1002 / cncr.26716
PubMed Resumo | CrossRef Texto Completo | Google Scholar
7. Subbiah IM, Lei X, Weinberg JS, Sulman EP, Chavez-MacGregor M, Tripathy D, et al. Validation and development of a modified breast graded prognostic assessment as a tool for survival in patients with breast cancer and brain metastases. J Clin Oncol. (2015) 33:2239–45. doi: 10.1200 / JCO.2014.58.8517
PubMed Resumo | CrossRef Texto Completo | Google Scholar
9. Lobbezoo DJ, van Kampen RJ, Voogd AC, Dercksen MW, van den Berkmortel F, Smilde TJ, et al. Prognóstico do cancro da mama metastizado: existem diferenças entre doentes com cancro da mama metastizado de novo e com cancro da mama metastizado recorrente? Br J Cancer. (2015) 112:1445–51. doi: 10.1038/bjc.2015.127
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Duan XF, Dong NN, Zhang T, Li Q. The prognostic analysis of clinical breast cancer subtypes among patients with liver metastases from breast cancer. Int J Clin Oncol. (2013) 18:26–32. doi: 10.1007/s10147–011-0336-x
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Dueck AC, Mendoza TR, Mitchell SA, Reeve BB, Castro KM, Rogak LJ, et al. Validade e fiabilidade da versão do “Patient-Reported Outcomes” do US National Cancer Institute dos critérios de terminologia comuns para eventos adversos (PRO-CTCAE). JAMA Oncol. (2015) 1:1051–9. doi: 10.1001 / jamaoncol.2015.2639
PubMed Resumo | CrossRef Texto Completo | Google Scholar
17. Xie J, Xu Z. a Population-Based Study on Liver Metastases in Women with Newly Diagnosticed Breast Cancer. Cancer Epidemiol Biomarkers Prev. (2019) 28:283–92. doi: 10.1158/1055–9965.EPI-18–0591
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Dawood S, Broglio K, Ensor J, Hortobagyi GN, Giordano SH. Survival differences among women with de novo stage IV and relapsed breast cancer. Ann Oncol. (2010) 21:2169–74. doi: 10.1093/annonc/mdq220
PubMed Abstract | CrossRef Full Text
19. den Brok WD, Speer CH, Gondara L, Baxter e, Tyldesley SK, Lohrisch CA. Sobrevivência com cancro da mama metastático com base na apresentação inicial, de novo versus recidiva. Tratamento Para Cancro Da Mama. (2017) 161:549–56. doi: 10.1007/s10549–016-4080–9
PubMed Resumo | CrossRef Texto Completo | Google Scholar
20. Fujiwara R, Haag M, Schaeffeler E, Nies AT, Zanger UM, Schwab M. Systemic regulation of bilirubin homeostasis: potential benefits of hyperbilirubinemia. Hepatologia. (2018) 67:1609–19. doi: 10.1002/hep.29599
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Liu X, Meng QH, Ye Y, Hildebrandt MAT, Gu J, Wu X. Prognostic significance of pretreatment serum levels of albumin, LDH and total bilirubin in patients with non-metastatic breast cancer. Carcinogenesis. (2015) 36:243–8. doi: 10.1093/carcin/bgu247
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Vander Heiden MG, Cantley LC, Thompson CB. Compreender o efeito de Warburg: as necessidades metabólicas da proliferação celular. Ciência. (2009) 324:1029–33. doi: 10.1126 / science.1160809
PubMed Resumo | CrossRef Texto Completo | Google Scholar
24. Mishra D, Banerjee D. lactato desidrogenases como ligações metabólicas entre tumor e estroma no microambiente tumoral. Cancer. (2019) 11:750. doi: 10.3390/cancers11060750
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Pelizzari G, Basile D, Zago S, Lisanti C, Bartoletti M, Bortot L, et al. Lactate dehydrogenase (ldh) response to first-line treatment predicts survival in metastatic breast cancer: first clues for a cost-effective and dynamic biomarker. Cancers. (2019) 11:1243. doi: 10.3390/cancers11091243
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Hopkins AM, Rowland A, McKinnon RA, Sorich MJ. Predictors of long-term disease control and survival for HER2-positive advanced breast cancer patients treated with pertuzumab, trastuzumab, and docetaxel. Front Oncol. (2019) 9:789. doi: 10.3389/fonc.2019.00789
PubMed Abstract | CrossRef Full Text | Google Scholar
34. Pentheroudakis G, Fountzilas G, Bafaloukos D, Koutsoukou V, Pectasides D, Skarlos D, et al. Cancro da mama metastático com metástases hepáticas: análise de registo das características clinicopatológicas, de gestão e de desfecho de 500 mulheres. Tratamento Para Cancro Da Mama. (2006) 97:237–44. doi: 10.1007 / s10549–005-9117–4
PubMed Abstract | CrossRef Full Text / Google Scholar
Leave a Reply