Latência Viral: abaixo, mas não fora, de
quando imagina vírus que se escondem do seu sistema imunitário, pode pensar no vírus herpes simplex, responsável por feridas frias e herpes genital, ou no vírus da varicela-zoster, que causa herpes simplex. Estes vírus podem persistir por décadas em um estado de hibernação conhecido como latência e evitar a detecção por nosso sistema imunológico (Kennedy et al., 2015). Os vírus latentes podem, por vezes, acordar e começar a replicar-se mais uma vez, causando sintomas e infecção de propagação (Lieberman, 2016).
O vírus da Imunodeficiência Humana (VIH)é igualmente um mestre em fugas. Forma um reservatório latente no início da infecção, permitindo que o vírus para escapar do sistema imunológico e para sobreviver a longo prazo. As pessoas que vivem com o VIH tomam medicamentos diários conhecidos como terapêutica anti-retroviral combinada (RMA) para prevenir a replicação do vírus. No entanto, a arte não é uma cura, uma vez que não visa vírus que já estão latentes. Estas drogas são, portanto, dadas para a vida de um indivíduo: a interrupção do tratamento, mesmo durante algumas semanas, permitirá que os vírus latentes reativem e reacendam a infecção activa. As pessoas com HIV podem esperar ter uma vida longa e saudável devido à arte, mas os vírus latentes sempre estarão presentes em seu corpo.encontrar uma cura para o VIH requer ser capaz de eliminar ou controlar o reservatório viral latente. No entanto, algumas questões-chave ainda precisam de ser abordadas para alcançar este objectivo. Como, quando e onde o HIV estabelece latência? Qual é o tamanho do reservatório latente, e a melhor maneira de medi-lo? O que desencadeia a reactivação de vírus latentes? Agora, em eterna, Milhas Davenport, Brandon Keele e colegas da Universidade de Nova Gales do Sul e o Frederico, o Laboratório Nacional de Investigação do Cancro, incluindo Mykola Pinkevych como primeiro autor – relatório quando o latente reservatório é estabelecido em primatas não humanos modelo de HIV e quanto do reservatório pode ser reativado (Pinkevych et al., 2019).
neste estudo, a equipa infectou macacos rhesus com o vírus da imunodeficiência símia (SIV), um vírus precursor que é endémico em macacos africanos e geneticamente semelhante ao VIH (Williams e Burdo, 2009). Em algum momento durante o século XX, o SIV saltou de primatas não humanos para seres humanos; este evento de transmissão entre espécies, juntamente com a rápida evolução, permitiu que o vírus se espalhasse de forma eficiente nas pessoas e para criar a atual pandemia de HIV (Keele et al., 2006).
Pinkevych et al. começou por infectar macacos rhesus com um SIV projetado contendo mais de 10.000 sequências aleatórias únicas de DNA; uma vez sequenciadas, estes’ códigos de barras ‘ permitem que vírus individuais sejam identificados (Fennessey et al., 2017). Os macacos foram então tratados com terapêutica anti-retroviral 4, 10 ou 27 dias após a infecção. Estes intervalos simulam agudos (4 dias), precoces (10 dias), ou intervenções tardias (27 dias) com a arte em humanos. As drogas foram dadas por aproximadamente um ano, e o vírus foi completamente suprimido em todos os animais. O tratamento foi então interrompido e o vírus latente foi autorizado a reactivar. Usando sequenciamento genético e modelagem matemática, a equipe determinou o tamanho do reservatório latente de SIV e como ele seria reativado.
nos macacos, o início do tratamento quatro dias após a infecção não bloqueou a formação do reservatório latente, mas reduziu o seu tamanho em aproximadamente 100 vezes em comparação com o início posterior da ART. Da mesma forma, as pessoas que começam a arte dentro de dias após a aquisição do HIV têm um reservatório extremamente pequeno em comparação com aqueles que começam o tratamento mais tarde (Luzuriaga et al., 2015; Henrich et al., 2017). Apesar destas grandes diferenças no tamanho global do reservatório, uma vez que a ART foi interrompida, os vírus latentes reativaram-se a taxas semelhantes em animais de tratamento agudo, precoce e tardio (Figura 1). Pinkevych et al. assim, concluir que a maioria dos vírus que têm potencial para reativar estão estabelecendo latência logo após a infecção.
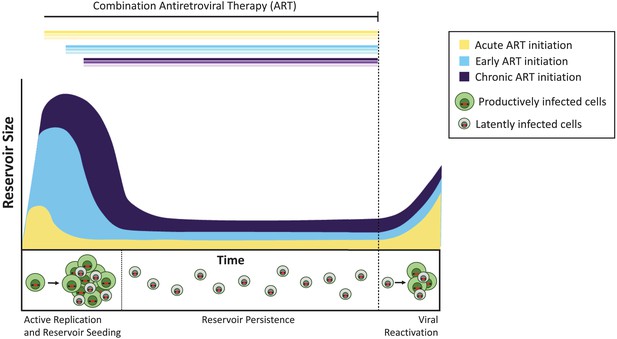
O tempo de terapia anti-retroviral influencia o tamanho do latente reservatório.sem tratamento, as células infectadas com vírus replicantes activos (células infectadas produtivamente; mostradas em verde) criam vírus infecciosos. Uma minoria de células infectadas contém vírus que podem persistir indefinidamente como um reservatório latente (células infectadas latentemente; mostradas em cinza), e esses vírus podem potencialmente ser reativados em uma data posterior. Tratamento administrado durante a fase aguda da infecção (isto é, dentro de dias ou semanas de infecção primária; amarelo curva) resulta em um menor latente reservatório que quando o tratamento é iniciado precocemente (dentro de seis meses da infecção, a luz azul) ou durante a infecção crônica (mais de 6 meses desde a infecção, violeta). Se o tratamento for interrompido (linha tracejada), o vírus reactiva-se a partir destes reservatórios a níveis semelhantes para reacender a infecção activa e reeducar o reservatório latente.
para explorar por que razão o momento do tratamento não pareceu influenciar a taxa de reactivação, a equipa mediu o nível de mutações genéticas nos vírus latentes. Se os vírus acumulam mutações mais prejudiciais quanto mais tempo eles estão se replicando ativamente no corpo, isso sugere que os animais que recebem arte retardada poderia transportar uma maior proporção de vírus latentes que são defeituosos e não podem despertar. No entanto, a equipe descobriu que a maioria dos vírus (mais de 80%) estavam geneticamente intactos em todos os animais, independentemente de quando o tratamento começou. Isto é completamente diferente do que acontece com a infecção pelo HIV em seres humanos, onde a maioria dos vírus latentes contêm grandes mutações genéticas e supressões, deixando apenas uma pequena fração (entre 2% e 11%) que são capazes de reativação (Ho et al., 2013; Bruner et al., 2019).
Um estudo recente, que avaliou a dinâmica do reservatório de HIV em pessoas com Art estável, identificou outra discrepância entre este modelo SIV e latência de HIV em seres humanos. Apesar da técnica em curso, o VIH latente pode, por vezes, reactivar-se espontaneamente e os vírus tornam-se detectáveis no sangue durante um curto período de tempo. Em humanos, estes ‘blips’ virais estão filogeneticamente ligados a um reservatório viral estabelecido não apenas na infecção inicial ,mas através de anos de infecção não tratada (Jones et al., 2018). As razões subjacentes a estas diferenças não são bem compreendidas e representam áreas importantes para a investigação em curso.apesar das diferenças entre os modelos de primatas não humanos e a infecção pelo VIH humano, o trabalho de Pinkevych et al. confirma que a latência viral é estabelecida muito cedo após a infecção. Estes resultados indicam que a terapêutica antirretrovírica deve ser iniciada o mais rapidamente possível para controlar a infecção pelo VIH e reduzir o tamanho do reservatório latente. Muito ainda é Desconhecido sobre como a latência do HIV é estabelecida e mantida, especialmente sob tratamento; no entanto, os modelos SIV continuarão a ser uma ferramenta importante para entender como erradicar o reservatório latente.
Leave a Reply