Organic Chemistry II

experimentalmente, no entanto, observa-se que existe uma barreira significativa à rotação sobre a ligação C2-C3, e que toda a molécula é planar. Além disso, a ligação C2-C3 tem 148 pm de comprimento, mais curta que uma ligação única carbono-carbono típica (cerca de 154 pm), embora maior que uma ligação dupla típica (cerca de 134 pm).
teoria Molecular orbital explica estas observações com o conceito de ligações pi deslocalizadas. Nesta imagem, os quatro orbitais atômicos 2p combinam matematicamente para formar quatro orbitais moleculares pi de energia crescente. Dois destes-os orbitais pi ligantes-são menores em energia do que os orbitais atômicos p a partir dos quais são formados, enquanto dois – os orbitais pi antibonding – são maiores em energia.

a menor energia orbital molecular, pi1, tem apenas interação construtiva e nós zero. Maior em energia, mas ainda menor que os orbitais p isolados, o orbital pi2 tem um nó, mas duas interações construtivas – assim, ele ainda é um orbital de ligação global. Olhando para os dois orbitais antibonding, pi3 * tem dois nós e uma interação construtiva, enquanto pi4* tem três nós e zero interações construtivas.
By the aufbau principle, The four electrons from the isolated 2pz atomic orbitals are placed in the bonding pi1 and pi2 MO’s. Porque pi1 inclui interação construtiva entre C2 E C3, há um grau, na molécula de 1,3-butadieno, de interação pi-ligante entre estes dois carbons, o que explica o seu comprimento mais curto e a barreira à rotação. A figura de ligação de Valência do 1,3-butadieno mostra as duas ligações pi como sendo isoladas umas das outras, com cada par de elétrons pi “presos” na sua própria ligação pi. No entanto, a teoria orbital molecular prevê (com precisão) que os quatro elétrons pi são, em certa medida, deslocalizados, ou “espalhados”, sobre todo o sistema pi.

1,3-butadieno é o exemplo mais simples de um sistema de ligações pi conjugadas. Para ser considerada conjugada, duas ou mais ligações pi devem ser separadas por apenas uma única ligação – em outras palavras, não pode haver um carbono SP3-hibridizado intermediário, porque isso quebraria o sistema sobreposto de orbitais p paralelos. No composto abaixo, por exemplo, as ligações duplas C1-C2 E C3-C4 são conjugadas, enquanto a ligação dupla C6-C7 é isolada das outras duas ligações pi por C5 hibridizado sp3.

um conceito muito importante a ter em mente é que existe uma estabilidade termodinâmica inerente associada à conjugação. Esta estabilidade pode ser medida experimentalmente comparando o calor da hidrogenação de dois dienos diferentes. (Hydrogenation is a reaction type that we will learn much more about in chapter 15: essentially, it is the process of adding a hydrogen molecule – two protons and two electrons – to a p bond). Quando as duas ligações duplas conjugadas do 1,3-pentadieno são “hidrogenadas” para produzir pentano, cerca de 225 kJ é liberado por mole de pentano formado. Compare isso com aproximadamente 250 kJ / mol liberado quando as duas ligações duplas isoladas em 1,4-pentadieno são hidrogenadas, também formando pentano. a formação de polímeros sintéticos a partir de dienos tais como 1,3-butadieno e isopreno é discutida na secção 18.5. Polímeros sintéticos são moléculas grandes compostas por pequenas unidades repetitivas. Você provavelmente está familiarizado com alguns desses polímeros; por exemplo, polietileno, polipropileno, poliestireno e poli(cloreto de vinilo).

Figura 13.6: diagrama de Energia para a hidrogenação de 1,3-butadieno (não em escala).
como a hidrogenação do 1,3-butadieno liberta menos do que a quantidade de energia prevista, o conteúdo energético do 1,3-butadieno deve ser inferior ao esperado. Em outras palavras, 1,3-butadieno é mais estável do que sua fórmula sugere.
o dieno conjugado é menor em energia: por outras palavras, é mais estável. Em geral, as ligações pi conjugadas são mais estáveis do que as ligações pi isoladas.
aqui está um diagrama de energia comparando diferentes tipos de ligações com as suas taxas de hidrogenação (por mol) para mostrar estabilidade relativa de cada molécula (1 kcal = 4, 18 kJ). (Quanto menor o calor da hidrogenação (por ligação pi), mais estável a estrutura é.)
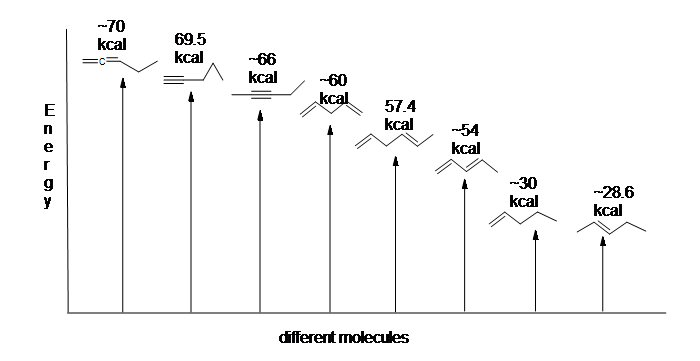
a estabilização dos dienos por conjugação é menos dramática do que a estabilização aromática do benzeno. No entanto, descrições similares de ressonância e orbitais moleculares de conjugação podem ser escritas.
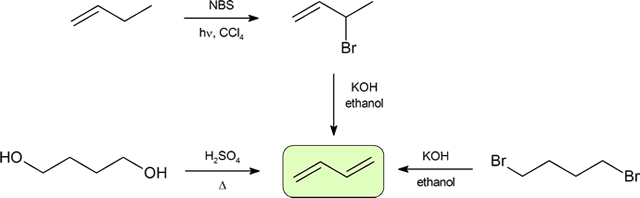
síntese de dienos
as duas formas mais frequentes de sintetizar dienos conjugados são a desidratação de álcoois e a desidrohalogenação de organohaletos, que foram introduzidas na preparação de alcenos (secção 9.9). O esquema seguinte ilustra algumas das rotas para preparar um dieno conjugado.
sistemas Pi conjugados podem envolver átomos de oxigénio e azoto, bem como carbono. No metabolismo das moléculas de gordura, algumas das principais reações envolvem alcenos que são conjugados a grupos carbonila.

MO é muito útil para explicar por que as moléculas orgânicas que contêm sistemas estendidos de ligações pi conjugadas muitas vezes têm cores distintas. beta-caroteno, o composto responsável pela cor laranja das cenouras, tem um sistema estendido de 11 ligações pi conjugadas.

Exercícios
Exercício 2.9: Identificar todas as ligações duplas conjugadas e isoladas nas estruturas abaixo. Para cada sistema pi conjugado, especifique o número de orbitais p sobrepostos, e quantos elétrons pi são compartilhados entre eles.

exercício 2.10: identificar todas as ligações IP isoladas e conjugadas no licopeno, o composto de cor vermelha nos tomates. Quantos electrões pi estão contidos no sistema pi conjugado?
Leave a Reply