Phosphofructokinase (PFK)
Conteúdo
- 1. Introdução
- 2 Papel na Glicólise
- 3 Mecanismo e o Regulamento de Phosphofructokinase
- 4 Regulamento
- 5 Conformacional Alterações em um Dimeric Unidade de PFK
- 6 Principais Conformacional Alterações em uma Subunidade da PFK.
- 7 Site-Directed Mutagenesis
- 8 Doença
- 9 estruturas 3D de PFK
Introdução
Phosphofructokinase-1 (PFK-1) é um glycolytic enzima que catalisa a transferência de um phosphoryl grupo para produzir e . Ver Enzimas De Glicólise. Mg2+ também é importante nesta reação (). A fosfofrutoquinase – 2 (PFK-2) atua sobre os mesmos substratos para produzir ADP e . . A reação de PFK é fortemente exergônica (irreversível) sob condições fisiológicas e, portanto, é um dos passos determinantes da velocidade da via glicolítica. Na maioria dos organismos/tecidos, PFK é a principal enzima reguladora do fluxo da via glicolítica; a sua actividade é controlada pelas concentrações de um número anormalmente elevado de metabolitos, incluindo ATP, ADP, AMP, PEP e frutose-2,6-bifosfato.
é um tetrâmero de subunidades idênticas de 320 resíduos. É uma enzima alostérica que é descrita usando o modelo de simetria do alosterismo em que há uma transição concertada de seu estado R de alta atividade para seu estado T de baixa atividade. Foram notificadas as estruturas de raio-X dos Estados R E T da enzima. A ligação de uma molécula de seu substrato F6P, que vincula o R do estado de enzima com alta afinidade, mas o estado enzima com baixa afinidade, faz com que PFK para assumir o R do estado, que, por sua vez, aumenta a afinidade de ligação da enzima para obter F6P (um homotropic efeito). Activadores, tais como ADP e AMP ligam-se aos chamados locais alostéricos, ligando locais distintos do local ativo, onde eles também facilitam a formação do Estado R e, portanto, ativam a enzima (um efeito heterotrópico; ADP, sendo um produto da reação PFK, também se liga no local ativo da enzima). Da mesma forma, inibidores como a EPP ligam-se a sítios alostéricos (que no caso da PFK sobrepõe o local alostérico activador) onde promovem a formação do Estado T, inibindo assim a enzima. dois dos locais activos da enzima encontram-se na interface com as interfaces do local activo em magenta com os substratos em ciano. Dois outros sites ativos estão na interface das subunidades B (verde) e C (rosa). Um close da subunidade D (Amarelo) mostra que os aminoácidos de ambas as subunidades Um (luz azul) e D (Amarela) contribuir para a ligação de F6P. Dois dos alostéricos sites estão localizados na interface de e dois na interface de subunidades C e D. Novamente as interfaces são magenta com o alostéricos ligante em ciano. A closeup of the Of subunit a shows contributions from both subunits to the binding of ADP. As mudanças conformacionais em ir entre os Estados R E T de PFK são ilustradas abaixo.
as coordenadas atômicas para o estado R PFK foram obtidas a partir de 4pfk; as coordenadas para o estado T PFK foram obtidas a partir de Philip Evans, MRC Laboratory of Molecular Biology, Cambridge, U. K. Mas agora estão disponíveis como 6pfk.
papel na glicólise
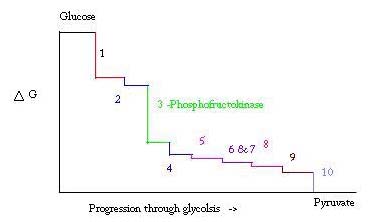
glicólise é o processo para preparar e decompor a glucose para fazer ácido pirúvico, que é usado na respiração anaeróbia ou como um dos reagentes iniciais no ciclo do ácido cítrico. Três pontos no processo de glicólise ocorrem com uma grande energia livre negativa e são, portanto, irreversíveis. Estes três pontos são hexocinase, fosfofrutoquinase e piruvato cinase; destes três PFK é considerado o principal ponto regulador para a glicólise no músculo com ΔG= -25,9 kJ/mol. a Fosfofrutoquinase liga-se tanto ao MG2+-ATP como ao frutose-6-fosfato (F6P) para produzir frutose-1,6-bifosfato e Mg2+-ADP. Embora a imagem com ambos os produtos não tenha sido determinada, ligado à enzima tem sido. Há três pontos de ligação ligando por subunidade. Dois compõem o local ativo, que liga F6P e ATP, enquanto o terceiro é um local de ligação alostérica. Alguns resíduos propostos envolvidos no local activo incluem . PFK existe em dois estados conformacionais, ambos e que estão em equilíbrio. A ATP liga ambos os locais activos e alostéricos em ambas as conformações. Enquanto o ATP liga-se ao sítio ativo igualmente bem, ele liga preferencialmente o alostéricos site do T Este estado preferencial de ligação provoca um deslocamento do equilíbrio dos dois estados, para uma maior quantidade de T do estado , o que diminui a afinidade para o F6P. também se liga ao alostéricos site para aumentar a taxa de R estado phosphofructokinase. Junto com ADP,AMP e F2,6P inibem o papel regulador do ATP. O km de PFK para ATP é .020mM e …A glicólise é um processo metabólico essencial para a sobrevivência. Portanto, na sua ativação e supressão, ela deve ser altamente regulamentada. Três pontos no processo de glicólise ocorrem com uma grande energia livre negativa e são, portanto, irreversíveis. Estes três pontos são hexocinase, fosfofrutoquinase e piruvato cinase. Estas três reações são candidatos a serem os principais pontos de regulação por causa de suas altas energias livres negativas. Dos três, PFK é considerado o principal ponto regulatório para a glicólise (#3 na figura abaixo) no músculo, com um ΔG= -25,9 kJ/mol, porque é um passo comprometido. Uma vez que PFK converte F6P para F1,6P, a reação não será facilmente revertida por causa da alta quantidade de energia que deve ser superada para ir para trás. . Esta barreira energética faz sentido visto que a piruvato cinase catalisa a reação final (#10) e a hexocinase (#1) não está envolvida na glicólise quando o processo é iniciado a partir do glicogênio.
PFK é regulado por ATP, AMP e ADP. Enquanto o ATP liga-se ao sítio ativo igualmente bem em ambos os R e T estados, ele liga preferencialmente o alostéricos site do T Este estado preferencial de ligação provoca um deslocamento do equilíbrio dos dois estados, para uma maior quantidade de T do estado , o que diminui a afinidade para o F6P. Alostéricos ativador ADP também se liga ao alostéricos site para aumentar a taxa de R estado phosphofructokinase. Como pode ser visto a partir do gráfico abaixo, as parcelas para a atividade de PFK são sigmoidal. Isto demonstra ainda a natureza Cooperativa da enzima. A ligação inicial do substrato à enzima é difícil, mas uma vez que se liga e força a mudança de estado a partir de T -> R, os outros substratos ligam-se muito mais facilmente. O gráfico também mostra que a adição de ATP move o gráfico para a direita (ou seja, diminui a afinidade para o F6P), enquanto a adição de AMP O move para a esquerda.
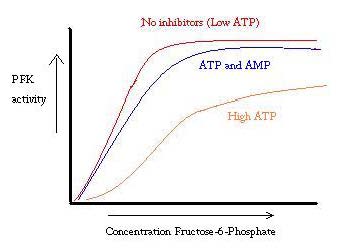
o sistema de regulação corresponde bem com a função de PFK. Quando a PFK está activa, a ATP está a ser produzida a partir dela, à medida que outros produtos são decompostos de forma mais completa. Assim, quando os níveis de ATP são baixos e é necessário fazer mais, a atividade da PFK será aumentada, porque a ADP estará em alta concentração. O oposto também se aplica, porque a alta concentração de ATP inibe a atividade proteica. E, no entanto, esta explicação não pode explicar completamente a regulação do PFK, porque os níveis de ATP não variam bastante entre músculos ativos e em repouso. Deve encontrar-se outro meio de regulação alostérica.
PFK’s Km for ATP is .020mM e …032mM.este exercício cinemático consiste em duas cenas cinemáticas que ilustram algumas das alterações conformacionais alostericamente induzidas que ocorrem em PFK a partir de Bacillus stearothermophilus.
Conformacional Alterações em um Dimeric Unidade de PFK
Este kinemage mostra as duas subunidades do tetramer cuja interface contém dois sítios ativos. A primeira vista, 1: PFK dímero, mostra as duas subunidades em sua conformação de Estado R como representadas por suas backbones Ca com subunidade 1 em tom rosa e subunidade 2 em rosa. Duas cadeias laterais em cada subunidade são mostradas, respectivamente, as do Glu 161 (vermelho) e do arg 162 (Cian), que fazem parte do local de ligação F6P nos Estados T e R(ver abaixo). Um F6P (hotpink) e um ADP (verde; “ADP-ativo”) estão ligados no site ativo de cada subunidade. Um ADP adicional (amarelo; “ADP-allo”) é ligado em um local alostérico separado de cada subunidade. Os ADPs cada um tem um Mg2 + associado, que é representado aqui por uma bola da mesma cor que o ADP a que se liga.
clique no botão” animar ” para mudar o dímero entre os seus Estados R e T. Em seu estado T, Subunit 1 é bluetint e Subunit 2 é skyblue. As cadeias laterais de Glu 161 e Arg 162 em ambas as subunidades são vermelhas e cianas como antes (apenas os átomos Ca e Cb da cadeia lateral arg 162 na subunidade 1 são observados na estrutura de raios X do estado T; os da subunidade 2 são todos observados). A enzima do Estado T liga-se ao inibidor 2-fosfoglicolato (ouro; “PGC”), um análogo não fisiológico do fosfoenolpiruvato intermediário glicolítico (PEP). Note que o local de ligação do PGC no estado T sobrepõe o local de ligação alostérica do ADP no estado R (“ADP-allo”) e, portanto, a sua ligação é mutuamente exclusiva. Os locais ativos do estado T, que não contêm F6P, são marcados por “ghost” F6Ps (gray;”F6P site”), que têm as mesmas posições que os f6ps na enzima do Estado R.
A segunda vista, 2: Sites Allo / Act, é um closeup da parte superior da primeira vista mostrando tanto o local ativo quanto o local alostérico nesta região. Note que o local ativo está localizado na interface entre duas subunidades e que o local alostérico interage diretamente com o local ativo na subunidade adjacente. Compare as conformações de Estado R e estado T exibindo ambos ao mesmo tempo ou clicando em “animar”. Consegue identificar o ião Mg2+ associado a cada um dos ADPs ligados à enzima no Estado R? Que átomos de ADP coordenam estes íons Mg2+?
o grupo fosfato de PGC liga-se ao local alostérico no estado T na mesma posição que o grupo fosfato beta de “ADP-allo” liga-se ao local alostérico do Estado R; ambos os grupos fosfato ligam-se às cadeias laterais dos mesmos três resíduos (2 arg e 1 Lys; não demonstrado).
no estado R de alta atividade, a cadeia lateral positivamente carregada de Arg 162 forma uma ponte salina ligada a hidrogênio com o grupo de 6-fosfato negativamente carregado de F6P (linhas tracejadas brancas), uma interação que presumivelmente estabiliza o estado R em relação ao estado T e é, portanto, em parte responsável pelo efeito homotrópico de F6P.
as principais mudanças conformacionais em uma subunidade de PFK.
esta CINEMAGEM mostra os segmentos próximos do local alostérico (os resíduos 53-60 não são mostrados aqui). Como em KINEMAGE 1, o polipéptido é representado por sua cadeia Ca com subunidades de Estado R 1 e 2 em vermelho e rosa, e subunidades de Estado T 1 e 2 em bluetint e skyblue. O KINEMAGE 2 surge no ponto 1: o sítio alostérico, no estado R, que mostra o grupo fosfato de F6P (“hotpink”) ligado no local activo da enzima numa ponte salina ligada a hidrogénio (linhas brancas tracejadas) com a cadeia lateral de Arg 162 (“cyan”). Um ADP (amarelo; “ADP-allo”) ocupa o local alostérico adjacente. Clique uma vez em” animar ” para mudar para o estado T. Isto substitui o ADP no local alostérico do Estado R com o inibidor e PGC analógico PEP (ouro). F6P já não ocupa o local ativo, mas sua posição no estado R é indicada pelo” fantasma “F6P (cinza; visto clicando no”site F6P”). o que acontece com o segmento helicoidal central dos polipeptídeos (resíduos 149-164) na transição R para T? O que isso faz às posições relativas do Glu 161 negativamente carregado e do arg 162 positivamente carregado? Clique no “site F6P”. Que influência teria a ausência da carga positiva do arg 162 sobre a vinculação do F6P? Isto explica, pelo menos em parte, por que razão o PFK do Estado T tem baixa afinidade para o F6P? Veja 2: Closeup, para uma closeup das interações F6P-sidechain. Centralize as moléculas, escolhendo ” piccenter “do menu” Ferramentas ” e clicando no átomo que você gostaria de estar no centro. Desliza a barra “zoom” para aumentar a vista.a carga negativa do Glu 161 teve um efeito negativo na ligação F6P no Estado T. Esta ideia não foi apoiada por experiências de mutagénese no local. Foram feitos vários PFKs mutantes, incluindo R162A, E161A e R162A/E161A. a mutação R162A causou uma diminuição de 30 vezes na ligação F6P. A mutação E161A, no entanto, teve pouco efeito sobre a capacidade da PEP para inibir a ligação F6P. a deficiência em eritrócitos hereditários de PFK está associada a miopatia e hemólise (doença de Tarui).estruturas 3D de PFK estruturas 3D de FOSFOFRUTOQUINASE estruturas 3D de PFK
Leave a Reply