What Influences the Size of Groups in Which Primates Choose to Live?

uma das principais contribuições teóricas feitas pelo estudo de Primatas é uma compreensão do que influencia a natureza da variação complexa na estrutura social e organizações. Subjacente a isto está um conjunto de desenvolvimentos teóricos que examinam por que os animais vivem em grupos em primeiro lugar e por que os grupos são de um tamanho particular. Aqui, nos concentramos na questão de ” quais as influências do tamanho dos grupos em que os primatas escolhem viver?”os primatas são particularmente úteis para abordar esta questão porque os seus tamanhos de grupo são altamente variáveis, não só dentro, mas também entre espécies. O tamanho intraespecífico do grupo para o colobo vermelho (Procolobus rufomitratus), por exemplo, varia entre 12 e 150 membros (Chapman & Chapman 2000a). A variação interespecífica varia de um único indivíduo, como visto em orangotangos (Pongo sp.) (van Schaik 1999), para mais de 800 membros em mandrills (Mandrillus sphinx) (Abernethy et al. 2002). Além disso, dentro de algumas espécies, grupos sociais repetidamente dividem e re-unem-se em subgrupos de diferentes tamanhos e combinações ao longo do tempo (por exemplo, fissão-fusão organização social de macacos-aranha (Ateles sp.) e chimpanzés (Pan troglodytes), ou a organização multi-nível de gelada (Theropithecus gelada) e babuínos Hamadrias (Papio hamadryas, Aureli et al. 2008). Esta variação fornece a base para que os pesquisadores desenvolvam modelos para investigar tanto os fatores ecológicos quanto os fatores sociais de tamanho de grupo. o Agrupamento de
é benéfico de várias formas. Acredita-se que indivíduos em grupos maiores tenham um risco reduzido de predação (Hamilton 1971), podem ser mais capazes de encontrar e defender recursos alimentares (Cody 1971, Wrangham 1980), e podem ser protegidos contra ameaças conspecíficas, como o infanticídio por machos extra-grupos (Wrangham 1979). Vários pesquisadores têm sugerido que o agrupamento confere benefícios tão previsíveis (Alexander 1974, van Schaik 1983) que as diferenças de tamanho do grupo podem ser explicadas pelas desvantagens (Wrangham et al. 1993). O custo potencial mais amplamente aceite do agrupamento é considerado uma redução na eficiência da procura de alimentos. Estar com outros indivíduos com as mesmas necessidades dietéticas significa que os animais ou lutam por alimentos( concurso), ou um animal de um grupo bate outro para o alimento, assim, quando o segundo animal vem para uma área não há simplesmente nenhum alimento (concurso de Mexidos, Janson & van Schaik 1988). Em ambas as situações, pensa-se que a concorrência sobre os alimentos leva os animais a terem de viajar mais longe. A lógica por trás deste argumento é relativamente simples. Os animais devem alimentar-se numa área que possa satisfazer as suas necessidades energéticas e nutricionais. Daqui decorre que um aumento da dimensão do grupo aumentará a área que deve ser coberta para encontrar o abastecimento alimentar adequado. Assim, os indivíduos devem viajar mais e gastar mais energia se estiverem em um grupo grande, do que se forragem em um grupo menor. Com um aumento no tempo gasto viajando, um ponto é abordado onde a energia gasta em viagens é muito caro e grupos menores se tornam vantajosos. Desta forma, os factores ecológicos podem influenciar os padrões de movimento e a eficiência de procura, restringindo assim o tamanho dos grupos que podem explorar eficientemente os recursos alimentares disponíveis. Estas idéias têm sido formalizada em que se tornou conhecido como as Restrições Ecológicas (Modelo de Chapman & Chapman, 2000b, Ganas & Robbins, 2005, Snaith & Chapman, 2007, Teichroeb & Sicotte 2009).
a componente essencial do modelo de restrições ecológicas é que um aumento da dimensão do grupo deve levar a um aumento da concorrência dentro do grupo alimentar. É concebível que isto funcione de uma forma ligeiramente diferente, dependendo da natureza dos recursos utilizados por determinadas espécies. Com frugívoros, e possivelmente muitos primatas folívoros, que se alimentam em remendos discretos — tipicamente árvores com itens alimentares ou aglomerados de árvores — outros membros do grupo podem esgotar remendos mais rapidamente e levar a intervalos de dias aumentados (Chapman 1988, Snaith & Chapman 2005). Para espécies mais insectívoras, cujos recursos podem não ocorrer em manchas discretas, viagens contínuas através do dossel em busca de insetos com membros adicionais do grupo podem levar a um aumento na sobreposição de campos de busca individuais, reduzindo as taxas de encontro per capita com alimentos e, assim, aumentando a área que deve ser pesquisada (van Schaik et al. 1983). assim, o modelo de restrições ecológicas sugere que os fatores que afetam a distância que os animais viajam também devem afetar o tamanho do grupo. Para os animais que normalmente se alimentam de frutas ou folhas que podem ser depauperadas, o tamanho do adesivo determinaria quanto tempo um grupo de um determinado tamanho poderia ficar e se alimentar. Um grupo grande gastaria menos tempo em um patch de um tamanho dado do que um grupo menor, porque esgota o patch mais rápido — um grupo grande simplesmente tem mais bocas para alimentar. Se os animais viajam entre patches uma vez que eles os esgotaram, então a densidade e distribuição de patches irá determinar os custos de viagem incorridos. Quando patches de recursos estão em alta densidade ou em uma distribuição amontoada, a distância para o próximo patch é pequena, os custos de viagem são baixos, e os animais podem, portanto, formar grandes grupos. Em tais momentos, qualquer custo adicional associado a ser um membro de um grande grupo, como a necessidade de visitar muitos patches, pode ser facilmente recuperado. Em contraste, quando os remendos de recursos ocorrem em baixas densidades, a distância para o próximo remendo é tipicamente grande, os custos de viagem são elevados, e os animais não podem se dar ao luxo de esgotar rapidamente remendos, e, portanto, os animais formam pequenos grupos.
A fissão-fusão organização social de aranha, macacos, chimpanzés e outros primatas (Figura 1) oferece útil testes de restrições ecológicas modelo, porque pode-se tentar prever mudanças temporais no subgrupo de tamanho a partir de medidas diretas de tamanho, densidade, e distribuição de recursos alimentares (Chapman, 1990, Chapman et al. 1995). Para macacos-aranha e chimpanzés, um modelo de regressão múltipla foi desenvolvido para mostrar que o tamanho, densidade e distribuição de patches de alimentos medidos a cada mês eram um bom preditor do tamanho de subgrupo. É difícil representar visualmente uma regressão múltipla, mas os métodos utilizados para macacos-aranha são retratados na Figura 2. Os macacos-aranha têm um tipo muito flexível de fissão-fusão de organização social, e no Parque Nacional Santa Rosa, Costa Rica, o tamanho de subgrupo pode variar de 1 a 35 indivíduos, mas em média cerca de 5 indivíduos são encontrados viajando juntos. Para esta população, 50% da variância no tamanho médio mensal do subgrupo pode ser prevista a partir de medidas relativamente cruas do tamanho, densidade e distribuição de patches de alimentos (Chapman 1990).

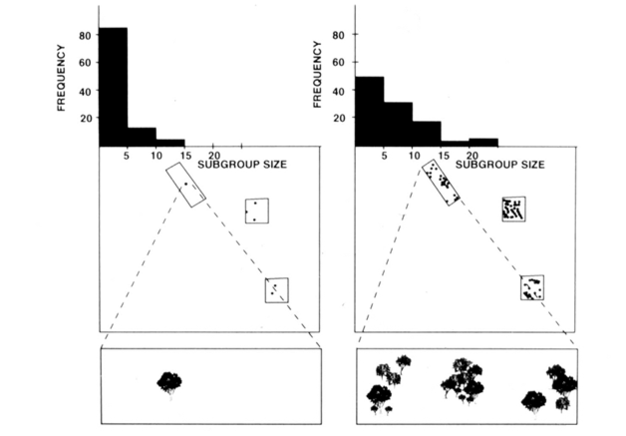
além das espécies mencionadas acima, a aplicabilidade das restrições ecológicas modelo tem sido, em geral, suportadas com a pesquisa vinda a partir de uma variedade de espécies (Snaith & Chapman, 2005) e situações (por exemplo, modelos gerais, Wrangham et al. 1993, and mixed species associations, Chapman & Chapman 2000c). Consideramos que, tendo em conta o amplo apoio que este modelo recebeu, chegou o momento de sugerir que as espécies devem normalmente estar em conformidade com as expectativas do modelo de restrições ecológicas. Isso não significa que todas as espécies se conformem, e assim se torna um momento emocionante para a pesquisa neste campo, porque os investigadores podem buscar exceções ao modelo. Suspeitamos que espécies que não se conformam o farão porque adotaram estratégias sociais que vão contra as expectativas ecológicas. Isto fornece uma “bitola” para avaliar a importância potencial de várias estratégias sociais (ou seja, quanto mais se afasta das expectativas do modelo ecológico, mais importantes são as pressões sociais seletivas). vejamos brevemente dois exemplos da nossa investigação anterior. As chimpanzés femininas eram mais solitárias do que as fêmeas dos macacos-aranha, mas ambas têm organizações sociais de fissão-fusão semelhantes. Além disso, embora pudéssemos prever com precisão o número de machos e chimpanzés subadultos em um subgrupo baseado em condições ecológicas, não fomos capazes de prever o número de chimpanzés fêmeas nesses subgrupos (Chapman et al. 1995). Mesmo quando os recursos eram extremamente abundantes e quase todos os machos estavam em um subgrupo grande, as fêmeas raramente entraram em grupos, sugerindo que o custo de estar em um subgrupo maior superava quaisquer benefícios, como evitar predadores. Isto é inesperado do ponto de vista de que os bebês dessas fêmeas seriam a classe idade/sexo mais ameaçada pela predação. Uma hipótese testável para explicar estas observações é que a natureza das coligações nestas duas espécies pode influenciar os benefícios da adesão ao grupo. Evidências sugerem que, ao contrário dos chimpanzés, as fêmeas de macacos-aranha formam coalizões que muitas vezes operam para permitir aos membros da coalizão acesso exclusivo a alimentos. Assim, os macacos-aranha, quando se juntam a indivíduos em particular, podem aumentar o seu acesso a alimentos excluindo outros, mas para as fêmeas chimpanzés não é o caso (Chapman et al. 1995).
identificamos outro desvio interessante, potencialmente causado por fatores sociais que afetam os custos e benefícios de estar em um grupo, e isso diz respeito ao colobo vermelho e ao macaco colobo preto-e-branco (também conhecido como. guerezas, Colobus guereza) no Parque Nacional de Kibale, Uganda. O colobo Vermelho Forma grandes grupos com uma média de 65 indivíduos (25-127 indivíduos, Snaith et al. 2008), while guerezas live in small groups with an average of 6.5 individuals (4-11 individuals, Harris & Chapman 2007). Apesar desta diferença, há uma grande semelhança nas plantas comidas pelas duas espécies. Se as condições ecológicas fossem responsáveis pela diferença de tamanho do grupo entre as duas espécies de colobina, seria de esperar que as suas dietas diferissem e que a densidade das árvores alimentares fosse menor nas gamas domésticas dos guarezas, uma vez que têm o tamanho menor do grupo. No entanto, suas dietas são muito semelhantes; a sobreposição dietética entre um colobo vermelho e um grupo de guareza que tinha sua gama de casa inteiramente dentro da Gama de casa do grupo colobo vermelho era de 43.2%, enquanto para os dois grupos vizinhos de colobo vermelho, dieta sobreposta por apenas 37,3% (Chapman et al. 2002). Parece que o sucesso reprodutivo feminino de guereza é maximizado em pequenos e médios grupos, seja porque grupos maiores experimentam maiores taxas de tomada-overs e infanticídio ou mais competição de alimentação (ver evidências de competição de corrida na Folívora Trachypithecus phayrei e Semnopithecus sp. , mas a falta de evidência de guerezas esgotando patches de alimentos ). Temos testemunhado um número de homens take-overs e infantil assassinatos na guerezas (Onderdonk 2000) — ver Teichroeb & Sicotte (2008) para uma avaliação da teoria sobre o infanticídio em colobines. O que não está claro é como o risco de infanticídio limitaria o tamanho dos grupos de guareza, quando eles têm acesso aparente a uma alta densidade de alimentos que deveria permitir a formação de grupos multi-masculinos. Em várias espécies, grupos femininos maiores são mais um alvo para a imigração de machos, e esta situação pode aumentar as taxas de infanticídio-por exemplo, Semnopithecus sp. (Borries 1997), Theropithecus gelada (Dunbar 1984), Alouatta seniculus (Crockett & Janson 2000), Presbytis thomasi (Steenbeek & van Schaik, 2001). No entanto, o infanticídio é esperado para ser menos freqüente se um grupo contiver vários reprodutivamente ativas homens, porque masculino imigração e subsequente violento assumir e o infanticídio são menos prováveis de ocorrer quando o recém-chegado é confrontado com vários pais de futuros bebês (Janson & van Schaik, 2000). Guerezas parecem ter amplos recursos alimentares para formar grupos maiores (Tombak et al. 2012), que diminuiria o risco de infanticídio, mas não formam grandes grupos. É possível que a natureza das interações homem-homem em guerezas torne grandes grupos instáveis. Este parece ser o caso em ursina colobus (Colobus vellerosus), onde multi-grupos do sexo masculino atrair imigrantes do sexo masculino e têm maiores taxas de infanticídio de grupos com um forte adultos do sexo masculino em seu auge (Teichroeb, Wikberg, Badescu, & Sicotte, dados não publicados); Figura 3). Thus, even when ecological conditions would permit large groups to form, social conditions preclude their formation (Chapman & Pavelka 2005).

Se as restrições ecológicas modelo é delinear as pressões que geralmente influência primata do tamanho do grupo e se os desvios a partir desta esperado do tamanho do grupo de resultado de pressões sociais, será um momento emocionante nesta área de investigação, porque levanta uma série de questões interessantes. Por exemplo: Qual é a natureza das pressões sociais sobre a dimensão dos grupos? Por que razão estas limitações sociais estão presentes nestas espécies e não estão intimamente relacionadas? E quais são as forças evolucionárias selecionando para essas pressões sociais? O tamanho do grupo é um elemento crítico que influencia o tipo de organização social que as espécies adotam, assim examinando estas questões levará a aperfeiçoamentos emocionantes de modelos socioecológicos.
Leave a Reply