Frontiere in Neuroanatomia
Introduzione
Oftalmico nevralgia posterpetica (PHN) è una disattivazione e ampiamente studiato dolore neuropatico condizione causata da herpes zoster e persistenti o ricorrenti per almeno 3 mesi in aree forniti da la branca oftalmica del nervo trigemino (Classificazione IHS, 2013).1
Gli studi che valutano l’innervazione cutanea in campioni di biopsia cutanea hanno fornito nuove informazioni sui meccanismi alla base del dolore neuropatico in diverse condizioni (Sommer e Lauria, 2007). La biopsia cutanea è uno strumento diagnostico minimamente invasivo utilizzato per valutare la fibra nervosa nell’epidermide e nel derma umani. L’innervazione epidermica consiste pricipalmente dei terminali della C-fibra unmyelinated, con relativamente poche piccole fibre myelinated di Aδ che perdono la loro guaina mielinica e raggiungono l’epidermide come terminazioni nervose libere unmyelinated. Al contrario, l’innervazione cutanea consiste principalmente di grandi fibre mielinizzate Aß che inviano rami ai corpuscoli dermici e ai follicoli piliferi (Nolano et al., 2003, 2013).
La maggior parte degli studi morfometrici ha utilizzato immunoistochimica a campo luminoso con immunostenante protein gene product (PGP) 9.5 e ha valutato l’innervazione epidermica da sola. Un approccio basato su immunofluorescenza e microscopia confocale utilizzando doppia e tripla immunotaining con un ampio pannello di anticorpi tra cui il marcatore pan-neuronale PGP 9.5, il marcatore della membrana basale, il collagene IV (ColIV) e gli anticorpi per varie popolazioni di fibre nervose mielinizzate e non mielinizzate, hanno dimostrato di fornire informazioni distinte sulle fibre nervose sensoriali e autonome e possibilmente valutare l’innervazione cutanea in modo più accurato (Doppler et al., 2012; Nolano et al., 2013).
Sebbene precedenti studi di biopsia cutanea abbiano mostrato una grave perdita di fibre nervose epidermiche (ENF) nei dermatomi toracici interessati di pazienti con PHN (Oaklander, 2001; Petersen et al., 2010), non hanno studiato direttamente il PHN oftalmico, né hanno distinto le fibre mielinizzate epidermiche non mielinizzate e dermiche, o dettagliano accuratamente il coinvolgimento delle fibre nervose autonome. Avere queste informazioni potrebbe definire più precisamente i meccanismi fisiopatologici alla base del PHN, migliorando così il modo in cui diagnostichiamo e curiamo questa condizione di dolore neuropatico eccezionalmente resistente ai farmaci.
Continuando il nostro interesse di ricerca sui meccanismi alla base del dolore neuropatico nelle malattie dei nervi periferici (Truini et al., 2014) tra cui PHN (Truini et al., 2008), in questo studio clinico e morfometrico, abbiamo mirato a indagare come il PHN oftalmico influisce sulle fibre nervose sensoriali e autonomiche della pelle mielinizzate e non mielinizzate. Per fare ciò abbiamo preso biopsie cutanee di punch sopraorbitale da 2 mm dal lato interessato e dal lato specchio non affetto in dieci pazienti con PHN oftalmico. Abbiamo elaborato i campioni di pelle con immunofluorescenza indiretta, esaminato i campioni mediante microscopia confocale, distinto epidermico unmyelinated e dermal myelinated innervazione, e descritto il coinvolgimento delle fibre nervose autonome.
Materiali e metodi
Abbiamo arruolato 10 pazienti (3 F, 7 M; 74,5 ± 4,4 anni) con PHN oftalmico presso il Dipartimento di Neurologia, Università Sapienza, Roma. Il PHN oftalmico è stato diagnosticato secondo i criteri diagnostici della International Headache Society: dolore persistente o ricorrente per almeno 3 mesi nell’area fornita dalla divisione oftalmica del nervo trigemino e causato da herpes zoster. I criteri di esclusione erano il deterioramento cognitivo, altre malattie del sistema nervoso centrale e periferico. Nessun paziente è stato trattato con farmaci antidolorifici topici (es., lidocaina e capsaicina).
L’Institutional Review Board del Dipartimento di Neurologia, Policlinico Umberto I, Roma, ha approvato lo studio e i pazienti hanno dato il loro consenso informato.
Valutazione clinica e neurofisiologica
Tutti i partecipanti sono stati sottoposti a un esame generale e un esame neurologico, con test sensoriali completi che includevano sintomi negativi (tattile, puntura di spillo e ipoestesia termica) e positivi (dolore spontaneo in corso, dolore parossistico) e segni (allodinia dinamica meccanica e iperalgesia della puntura di spillo). La presenza e la gravità dei sintomi negativi sono stati valutati confrontando il lato interessato con l’immagine speculare sul lato sano. La gravità dei diversi tipi di dolore (ad esempio, dolore spontaneo in corso, dolore parossistico, allodinia dinamica meccanica, iperalgesia da puntura di spillo) è stata valutata su una scala di valutazione numerica 0-10 (NRS; 0 = nessuna sensazione, 10 = dolore peggiore possibile).
In tutti i pazienti, abbiamo registrato il riflesso blink mediato da fibre mielinizzate Aß, con metodi aderenti alle raccomandazioni della Federazione Internazionale delle linee guida di neurofisiologia clinica (Deuschl e Eisen, 1999). Per studiare la funzione della fibra Aδ e C abbiamo registrato potenziali evocati dal laser, secondo una tecnica precedentemente riportata (Truini et al., 2008).
Biopsia cutanea
Le biopsie cutanee con punzone di due mm sono state prelevate immediatamente sopra il sopracciglio dal lato dello specchio interessato e non interessato. La ferita è guarita in pochi giorni senza una cicatrice visibile (Figura 1). I campioni di pelle sono stati elaborati con tecniche immunoistochimiche, come precedentemente descritto (Nolano et al., 2013). I campioni sono stati fissati durante la notte in soluzione di Zamboni, crioprotetti in saccarosio al 20% in soluzione salina tamponata con fosfato e tagliati in sezioni spesse 50 µm su un microtomo congelante (Leica 2000R, Germania). Le sezioni free-floating sono state elaborate per l’immunofluorescenza indiretta utilizzando un pannello anticorpale per macchiare l’innervazione sensoriale, autonomica della pelle e le strutture vascolari, tra cui PGP9.5, peptide correlato al gene della calcitonina (CGRP), sostanza P (SubP) e anticorpi del peptide intestinale vasoattivo (VIP) (Tabella 1). Le immagini digitali sono state acquisite con microscopia confocale non laser (CARV confocal system; ATTO Biosciences, USA e Apotome confocal system; Zeiss, Germania).
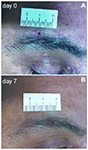
Figura 1. Biopsia della pelle del punzone sopraorbitale di due mm. (A) Fotografia di un paziente con nevralgia post-erpetica (PHN) che mostra la ferita cutanea di 2 mm subito dopo il pugno. (B) Dopo 1 settimana, la cicatrice è appena visibile.

Tabella 1. Abbreviazione, fonte e diluizione di marcatori immunoistochimici.
La densità ENF è stata valutata nei campioni bioptici di punch cutaneo da 2 mm applicando il software Neurolucida (MicroBrightField Bioscience, USA) a quattro immagini confocali della serie 20× z (incrementi di 2 µm × 16), ottenute da quattro sezioni selezionate casualmente per ciascun campione. Le fibre nervose mielinizzate dermiche sono state quantificate utilizzando anticorpi proteici anti-mielina di base in tutta la superficie cutanea, incluso 1 mm di profondità dalla membrana basale, in tre sezioni casuali per ciascun campione, seguendo la procedura precedentemente pubblicata (Nolano et al., 2013). Una griglia calibrata (2 × 1 mm) con una serie di sette linee parallele equidistanti è stata applicata su un’immagine digitale di ingrandimento originale 5× non confocale di sezioni macchiate di proteine di base della mielina. Sono stati contati tutti gli intercetti tra le fibre mielinizzate e le linee della griglia. La densità delle fibre nervose mielinizzate dermiche è stata calcolata come il numero di fibre che intercettano la griglia per area dermica (intercetta per mm2). Un singolo operatore ha quantificato ciecamente la fibra nervosa della pelle in ogni campione. La densità della lunghezza del nervo sudomotorio VIP-ir (nm / mm3) è stata calcolata utilizzando il modulo di tracciamento del nervo Autoneuron, una parte del software Neurolucida , come descritto in precedenza (Provitera et al., 2014). Per valutare le fibre peptidergiche (SubP, CGRP e VIP-ir) nel plesso neurale subepidermico, entro 100 µm dalla membrana basale, è stato applicato un punteggio semiquantitativo (0 = assenza di fibre, 1 = segmenti di fibre rare, inferiori a 10 µm, 2 = poche fibre, che popolano il derma in gran parte denervato, 3 = normale, diverse fibre che coprono la maggior parte del plesso neurale subepidermico).
I risultati della biopsia cutanea nei 10 pazienti sono stati confrontati con un campione abbinato di 10 soggetti sani (densità delle fibre nervose epidermiche: 18,9 ± 3,7/mm, densità delle fibre mielinizzate dermiche: 6,7 ± 1,4 / mm; Nolano et al., 2013).
Analisi statistica
Tutti i dati sono espressi come media ± SD. La distribuzione normale della densità delle fibre mielinizzate epidermiche e dermiche è stata valutata utilizzando il test di normalità omnibus di D’Agostino e Pearson. Il test Wilcoxon matched-pair è stato utilizzato per confrontare le variabili neurofisiologiche e della biopsia cutanea tra lati non affetti e interessati. Il test di Mann Whitney è stato utilizzato per confrontare le variabili della biopsia cutanea tra pazienti con PHN e controlli normali. Le correlazioni tra la densità ENF e la durata del PHN sono state calcolate con il coefficiente di correlazione r di Pearson. Valori di P inferiori o uguali a 0,05 sono stati considerati indicativi di significatività statistica.
Risultati
All’esame clinico tutti e dieci i pazienti hanno lamentato deficit sensoriali che coinvolgono tutte le modalità sensoriali e hanno riportato dolore spontaneo in corso (NRS: 4,3 ± 1,4); cinque pazienti hanno anche lamentato allodinia dinamica meccanica (NRS: 3,5 ± 0,7).
Test neurofisiologici hanno mostrato gravi anomalie che coinvolgono tutte le variabili testate. In tutti i pazienti il riflesso lampeggiante mediato da fibre Aß, stimolando il lato interessato, ha suscitato risposte anormali (ritardate o assenti). Le soglie percettive del laser erano più alte e il laser Aδ e C evocava ampiezze potenziali più basse dopo aver stimolato il lato interessato che dopo aver stimolato il lato non affetto (p< 0.05, test di Wilcoxon). In 2 dei 10 pazienti, i potenziali evocati dal laser relativi alla stimolazione della fibra C erano assenti anche nel lato non interessato (Tabella 2).

Tabella 2. Abbreviazione, fonte e diluizione di marcatori immunoistochimici.
L’analisi di immunofluorescenza confocale ha mostrato che l’innervazione cutanea nelle biopsie cutanee del punzone sopraorbitale di pazienti con PHN differiva in modo sorprendente tra i lati non affetti (Figure 2A,C,E) e colpiti (Figure 2B,D,F). Mentre i campioni di biopsia cutanea dal lato non interessato mostravano un’innervazione abbastanza densa e regolare, l’epidermide nel lato interessato appariva scarsamente e in modo non uniforme innervata con grappoli e lunghi tratti privi di fibre nervose (Figure 2A–D). L’analisi semiquantitativa ha mostrato che il plesso subepidermico appariva povero e squilibrato e, rispetto al lato non interessato, conteneva meno (p < 0.001) CGRP (1.4 ± 0.8 vs. 2.5 ± 0.5), SubP (1.1 ± 0.6 vs. 2.3 ± 0.7) e VIP (1.0 ± 0.7 vs. 2.2 0.8) fibre nervose immunoreattive (IR). I follicoli piliferi apparivano scarsamente innervati con poche fibre non mielinizzate e mielinizzate (Figure 2F,E). La perdita di fibre mielinizzate epidermiche e dermiche variava da moderata a grave e 3 dei 10 pazienti avevano una denervazione cutanea completa. I pochi assoni epidermici sopravvissuti sono stati raggruppati tra aree di epidermide denervata. Le fibre mielinizzate hanno mostrato diverse anomalie morfologiche, come la frammentazione, il frequente verificarsi di una lunghezza nodale più lunga del normale (7 µm o più; Nolano et al., 2003) e irregolarità del calibro con allargamento e restringimento (variazione di diametro superiore al 100%) all’interno dello stesso internodo. Queste caratteristiche sono state osservate raramente nel lato non interessato. In contrasto con l’innervazione sensoriale, entrambi i componenti, adrenergici e colinergici, dell’innervazione autonomica agli allegati dermici apparivano relativamente conservati (Figura 3). I lati non affetti e colpiti mostravano numerose fibre pilomotorie colinergiche (VIP-ir) (Figure 3C,D) e adrenergiche (DbH-ir) (Figure 3E,F). La densità della fibra nervosa sudomotoria colinergica non differiva tra gli interessati (1,9 ± 0.7 nm/mm3) e lato inalterato (2,0 ± 0,5 nm/mm3).
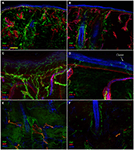
Figura 2. Innervazione cutanea. Immagini confocali che mostrano innervazione cutanea nel lato non interessato (A,C,E) e interessato (B,D,F) in un paziente rappresentativo con PHN. Grave perdita di fibre nervose epidermiche e dermiche è visibile nei campioni di biopsia cutanea dal lato interessato (B vs. A). L’epidermide nel lato interessato mostra un lungo tratto privo di fibre nervose e cluster di fibre nervose (D vs. C). Colpisce la perdita di fibre nervose non mielinizzate e mielinizzate intorno ai follicoli piliferi (F vs. E). Barre: 100 µm in (A, B,E, F); 25 µm in (C, D).
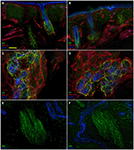
Figura 3. Innervazione cutanea autonoma. Immagini confocali che mostrano innervazione autonomica agli allegati dermici nel lato interessato (A,C,E) e non affetto (B,D,F). Il derma superiore intorno ai follicoli piliferi nel lato interessato contiene meno fibre peptide-immunoreattive intestinali vasoattive (VIP-IR) rispetto alla stessa area dermica nel lato non affetto (A vs. B) mentre l’innervazione pilomotoria VIP-ir e DbH-ir è ben dotata (D e F vs. C ed E). Bar: 100 µm in (A, B); 50 µm in (C,D), 25 µm in (E,F).
analisi Quantitativa (sulla base di analisi di PGP9.5 e proteina basica della mielina (MBP) immunoreattività) della pelle campioni di biopsia ha mostrato una significativa riduzione del epidermico e dermico fibre mieliniche densità del lato colpito rispetto al lato inalterato (3.1 ± 3.3 e 2.1 ± 2.8 vs 17.2 ± 8,9 e 6.6 ± 5.0/mm2; p < 0.01, Tabella 2). Il rapporto tra le fibre nervose mielinizzate epidermiche e dermiche era significativamente inferiore nel lato affetto rispetto al lato non affetto (1,1 ± 1,0 vs. 4.3 ± 5.3; p < 0.01).
Sebbene la densità ENF sia aumentata con la durata del PHN, questa correlazione non è riuscita a raggiungere la significatività statistica (r: 0,5574, p = 0,09; Figura 4).
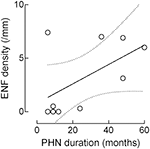
Figura 4. Correlazione tra densità della fibra nervosa epidermica (ENF) e durata del PHN. Sebbene la densità ENF sia aumentata con la durata del PHN, questa correlazione ha mancato la significatività statistica (fibra nervosa epidermica: r: 0,5574, p = 0,09).
I valori medi per le densità delle fibre nervose non mielinizzate e mielinizzate nel lato non affetto non differivano dai controlli (densità delle fibre nervose epidermiche: 17,2 ± 8,9/mm vs. 18,9 ± 3,7/mm; densità delle fibre mielinizzate dermiche: 6,6 ± 5,0/mm vs. 6,7 ± 1,4/mm;> 0.3, di Mann-Whitney test). Tuttavia, nei due pazienti con potenziali evocati laser mediati da fibre C anormali, la biopsia cutanea ha mostrato una perdita di fibre nervose mielinizzate epidermiche e dermiche anche nel lato non affetto (0,8 e 3,6/mm nel non affetto e 0,0 e 0.3 / mm nel lato interessato).
Discussione
Il nostro studio clinico e morfometrico, che valuta l’innervazione cutanea nelle biopsie cutanee sopraorbitali con immunofluorescenza indiretta e microscopia confocale, fornisce nuove informazioni specificando che, sebbene il PHN oftalmico colpisca sia le fibre nervose epidermiche non mielinizzate che quelle dermiche mielinizzate, danneggia prevalentemente le fibre nervose non mielinizzate e risparmia l’innervazione cutanea autonoma.
L’esame clinico ha mostrato che tutti i pazienti presentavano ipoestesia tattile, pungente e calda. Di conseguenza, tutte e tre le variabili neurofisiologiche che abbiamo registrato (il riflesso di lampeggio mediato da fibre Aß, i potenziali evocati da laser Aδ e C) erano anormali. Mentre la valutazione clinica e i test neurofisiologici hanno mostrato sia danni alle fibre mielinizzate che non mielinizzate, la valutazione della biopsia cutanea ha specificato che il danno correlato al PHN all’innervazione cutanea differiva nelle fibre mielinizzate e non mielinizzate. Più specificamente, il rapporto unmyelinated/myelinated più basso nel lato commovente che nel lato inalterato dello specchio suggerisce una perdita epidermica predominante della fibra del nervo unmyelinated. Questa nuova scoperta morfometrica concorda con studi precedenti che hanno studiato l’innervazione epidermica da sola e hanno mostrato una perdita di fibre non mielinizzate variabile (Oaklander, 2001; Petersen et al., 2010; Reda et al., 2013). Il coinvolgimento predominante delle fibre nervose non mielinizzate che descriviamo nei pazienti con PHN si adatta al loro dolore tipicamente in corso. Questo tipo di dolore probabilmente riflette cambiamenti neuroplastici secondari e iperattività spontanea nei neuroni nocicettivi anatomicamente denervati del secondo ordine (Truini et al., 2013). A causa del piccolo campione di studio non abbiamo potuto indagare in modo affidabile possibili correlazioni tra dolore e anomalie cliniche, neurofisiologiche e morfologiche. Questa domanda merita indagine in un ulteriore studio arruolando più pazienti.
In questo studio di biopsia cutanea, utilizzando immunofluorescenza indiretta e microscopia confocale, forniamo informazioni dettagliate precedentemente non dichiarate sull’innervazione autonomica cutanea in pazienti con PHN oftalmico. Mentre l’innervazione autonomica alle ghiandole sudoripare e ai muscoli erettori pilorum è stata risparmiata, abbiamo osservato una scarsa rappresentazione delle fibre VIP-IR nel derma superiore, intorno ai vasi e ai follicoli piliferi, dove c’era anche una scarsa rappresentazione di CGRP e SubP. Alcune di queste fibre modulano la funzione del follicolo pilifero e il controllo vasomotorio facciale e possono provenire dal nervo trigemino sensoriale (Izumi, 1995, 1999). Questa origine può spiegare il loro coinvolgimento nel PHN mentre le fibre nervose sudomotorie e pilomotorie VIP-IR non coinvolte provengono probabilmente dai gangli simpatici cervicali superiori e dai nervi parasimpatici cranici che il PHN lascia intatti. Dato che molti studi suggeriscono che il sistema nervoso autonomo potrebbe partecipare allo sviluppo del dolore (Fields et al., 1998), il risparmio di fibre nervose autonomiche che descriviamo qui potrebbe supportare l’accoppiamento indiretto proposto tra neuroni non mielinati afferenti primari postganglionici simpatici intatti e danneggiati (Drummond et al., 2014).
Nei nostri pazienti con biopsia cutanea PHN oftalmica i risultati hanno mostrato che i pochi assoni sopravvissuti nel lato interessato erano raggruppati tra aree di epidermide denervata e che la densità dell’ENF tendeva ad aumentare con la durata della malattia. Questa osservazione ci porta a ipotizzare che la pelle potrebbe subire qualche rimodellamento nervoso nel tempo. Questi cambiamenti potrebbero avvenire quando gli assoni sopravvissuti germogliano collaterali nel tentativo di occupare il territorio denervato. Questo rimodellamento anatomico può anche portare qualche miglioramento funzionale. Certo, la nostra ipotesi che suggerisce una parziale reinnervazione nel tempo in pazienti con PHN oftalmico argomenta contro gli studi pivotal che affrontano la storia naturale del PHN toracico (Petersen et al., 2010; Reda et al., 2013). Questi studi che utilizzano misure funzionali e biopsia cutanea concludono che anche a 7,7 anni, c’è solo un modesto recupero della funzione sensoriale e nessun recupero anatomico nonostante la risoluzione del dolore nella maggior parte dei pazienti. In particolare, lo studio di Reda e colleghi ha dimostrato che sebbene il dolore e la maggior parte delle misure della funzione sensoriale, dei sintomi sensoriali e della risposta alla capsaicina continuassero una tendenza al miglioramento durante un follow-up a lungo termine, molti soggetti hanno ancora sperimentato anomalie sensoriali. Anche se non possiamo escludere che l’affidabilità dei nostri risultati possa essere influenzata dal piccolo campione di pazienti, se il sistema trigemino, un territorio particolare, sia più predisposto alla reinnervazione cutanea rispetto ad altre aree del corpo rimane una domanda interessante per la ricerca futura.
La densità media delle fibre mielinizzate epidermiche e dermiche e il loro rapporto nel lato specchio non influenzato non differivano dai controlli. Tuttavia, in due dei dieci pazienti che abbiamo studiato, i potenziali evocati laser correlati alla fibra C erano assenti dopo aver stimolato il lato non affetto ed entrambi i pazienti avevano una lieve perdita di fibre epidermiche, anche se meno grave nel lato non affetto rispetto al lato interessato. Questa scoperta è in linea con precedenti studi clinici, neurofisiologici e di biopsia cutanea che mostrano danni alle fibre nervose bilaterali e supporta l’ipotesi che il PHN possa occasionalmente causare un lieve coinvolgimento afferente sensoriale subclinico nel lato non affetto (Haanpää et al., 1997; Oaklander et al., 1998; Truini et al., 2008).
Il nostro studio di biopsia cutanea che mostra che il PHN oftalmico influenza in modo differenziato le fibre mielinizzate epidermiche e dermiche e risparmia l’innervazione cutanea autonomica fornisce nuove informazioni per comprendere i meccanismi alla base di questa condizione invalidante.
Contributi dell’autore
Dichiarazione sul conflitto di interessi
Gli autori dichiarano che la ricerca è stata condotta in assenza di relazioni commerciali o finanziarie che potrebbero essere interpretate come un potenziale conflitto di interessi.
Note a piè di pagina
- ^ http://www.ihs-classification.org/_downloads/mixed/International-Headache-Classification-III-ICHD-III-2013-Beta.pdf
Deuschl, G., e Eisen, A. (1999). Riflessi a lunga latenza a seguito di stimolazione nervosa elettrica. La federazione internazionale di neurofisiologia clinica. Elettroencefalogr. Clin. Neurofisiolo. Suppl. 52, 263–268.
PubMed Abstract/Google Scholar
Oaklander, A. L. (2001). La densità delle terminazioni nervose rimanenti nella pelle umana con e senza nevralgia post-erpetica dopo l’herpes zoster. Dolore 92, 139-145. doi: 10.1016/s0304-3959(00)00481-4
PubMed Abstract / CrossRef Full Text / Google Scholar
Leave a Reply