diferença entre ligações duplas e triplas
diferença principal-ligações simples vs Duplas vs ligações triplas
ligações químicas mantêm átomos numa molécula juntos, estabelecendo forças entre os elétrons e núcleos de dois átomos. As reações químicas são governadas pelo estabelecimento ou quebra das ligações químicas. Existem vários tipos de ligações, tais como covalente, Jônico, van der Waal, etc. As propriedades das ligações variam dependendo de vários aspectos, tais como a natureza da molécula, tipo sólido (cristalino ou amorfo), etc. Ligações covalentes são formadas pela partilha de dois ou mais elétrons. O número de elétrons compartilhados entre átomos determina o número de ligações; Se é simples, dupla ou tripla. Portanto, as ligações simples, duplas e triplas são ligações covalentes. A principal diferença entre a ligação dupla e tripla é o número de elétrons compartilhados. Se o número compartilhado for um par de elétrons, a ligação será uma única ligação, enquanto que se dois átomos se ligarem por dois pares (quatro elétrons), ela formará uma ligação dupla. As ligações triplas são formadas pela partilha de três pares (seis átomos) de electrões. Estes elétrons compartilhados são comumente conhecidos como elétrons de Valência. Este artigo vai olhar para,
1. O que é uma única ligação?
– Definition, Properties, Examples
2. O que é um laço duplo?
– Definition, Properties, Examples
3. O que é uma tripla ligação?
– Definition, Properties, Examples
4. Qual é a diferença entre obrigações duplas e triplas?
o Que é um Único título
Uma única ligação é formada pelo compartilhamento de um par de elétrons de valência entre dois átomos adjacentes. Uma única ligação é a forma mais simples de uma ligação covalente, onde cada átomo fornece um elétron de Valência. Estes elétrons de Valência estão localizados na camada externa dos átomos. Aqui, os elétrons compartilhados carregados negativamente estão sendo puxados pelos núcleos carregados positivamente dos átomos. Estas forças de tracção mantêm os átomos juntos. Este arranjo é conhecido como uma única ligação. As moléculas com ligações únicas são menos reativas ao contrário das moléculas com múltiplas ligações. Além disso, eles são mais fracos do que múltiplas ligações e têm comprimentos de ligação mais elevados devido à baixa força de tracção entre átomos quando comparados com múltiplas ligações. Uma única ligação é denotada por apenas um traço; ex: C C. alcanos como metano, etano, propano são alguns exemplos para compostos com ligações únicas.
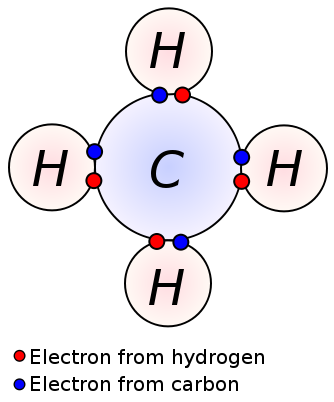
Metano
o Que é uma ligação Dupla
Uma ligação dupla é formada pelo compartilhamento de dois pares de elétrons de valência localizado na órbita mais externa do átomo. Compostos com ligações duplas são altamente reativos do que compostos unicos ligados, mas menos reativos do que compostos com ligações triplas. As ligações duplas são assinaladas por dois traços paralelos; ex: C=C. Alguns exemplos de compostos com ligações duplas incluem alquenos como etileno, propeno, compostos carbonílicos (C=o), compostos azo (N=N), Minas (C=N) e sulfóxidos (S=o).
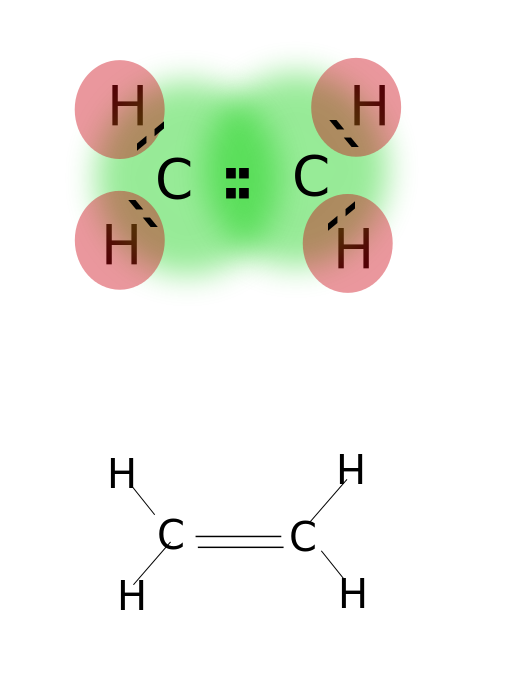
Etileno
o Que é uma ligação Tripla
Quando dois átomos compartilham três pares de elétrons de valência (seis elétrons de valência), estabelecido títulos são chamados de triplas. As ligações triplas são as ligações covalentes mais fortes e reativas. Quando comparado com ligações simples e duplas, as ligações triplas têm o menor comprimento de ligação devido à força de tracção mais elevada entre dois átomos. Uma ligação tripla é indicado por três traços paralelos entre dois átomos; ex: C≡C. Alguns exemplos de compostos com ligações triplas incluem o gás nitrogênio (N≡N), íon cianeto (C≡N), acetileno (CH≡CH) e o monóxido de carbono (C≡O).
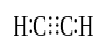
Acetileno
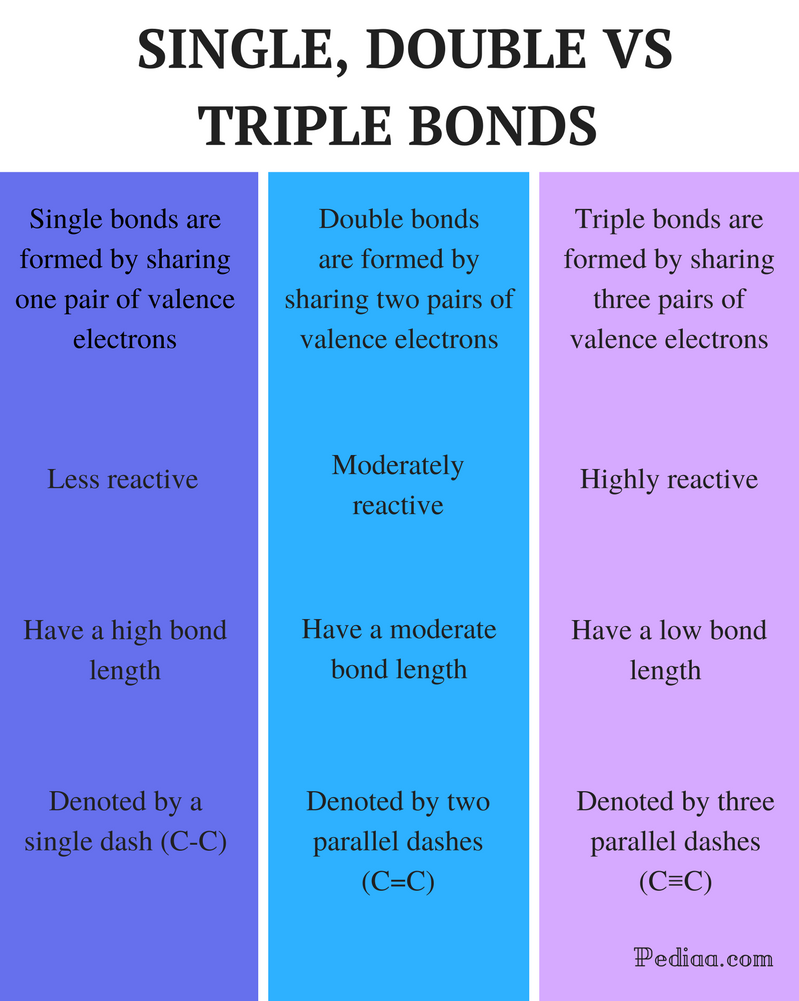
Diferença Entre individuais, Duplos e Triplos Obrigações
Definição:
Single Bond: Uma única ligação é formada pela partilha de um par de elétrons de Valência.uma ligação dupla é formada pela partilha de dois pares de elétrons de Valência. ligação tripla: uma ligação tripla é formada pela partilha de três pares de electrões de Valência.
reactividade:
ligação única: as ligações únicas são menos reactivas. ligações duplas: ligações duplas são moderadamente reativas. ligações triplas: as ligações triplas são altamente reactivas.
Comprimento da ligação:
ligação única: as ligações únicas têm um comprimento da ligação elevado. ligação dupla: as ligações duplas têm um comprimento de ligação moderado. obrigações triplas: As ligações triplas têm uma força de ligação baixa.
denotado por:
ligação única: as ligações únicas são denotadas por um único traço (C-C).ligações duplas: as ligações duplas são denotadas por dois traços paralelos (C=C).obrigações triplas: as obrigações triplas são denotadas por três traços paralelos (C≡C).exemplos:
exemplos:
ligação única: exemplos incluem alcanos tais como metano, etano, propano, butano, etc.ligações duplas: exemplos incluem etileno, propeno, compostos carbonílicos( C = o), compostos azóicos (N=N), Minas (C=N) e sulfóxidos (S=o). obrigações triplas: Exemplos incluem gás nitrogênio( n≡n), ião cianeto (C≡n), acetileno (CH≡CH) e monóxido de carbono (C≡o).Clowes, Martin . O básico da Química Orgânica . N. p.: The Rosen Publishing Group, 2013. Imprimir.
![]()
Leave a Reply