15.3: Fyzikální Vlastnosti Karboxylových Kyselin
Vzdělávací Cíle
- Porovnat body varu karboxylových kyselin s alkoholy podobné molární hmotnost.
- Porovnejte rozpustnosti karboxylových kyselin ve vodě s rozpustnostmi srovnatelných alkanů a alkoholů ve vodě.
mnoho karboxylových kyselin jsou bezbarvé kapaliny s nepříjemnými pachy. Karboxylové kyseliny s 5 až 10 atomy uhlíku mají všechny“ kozí “ pachy (vysvětlující zápach sýra Limburger). Tyto kyseliny jsou také produkovány působením kožních bakterií na lidský MAZ (kožní oleje), což odpovídá zápachu špatně větraných šaten. Kyseliny s více než 10 atomy uhlíku jsou voskové pevné látky, a jejich zápach se snižuje se zvyšující se molární hmotností a výslednou klesající těkavostí.
karboxylové kyseliny vykazují silnou vodíkovou vazbu mezi molekulami. Proto mají vysoké body varu ve srovnání s jinými látkami srovnatelné molární hmotnosti.
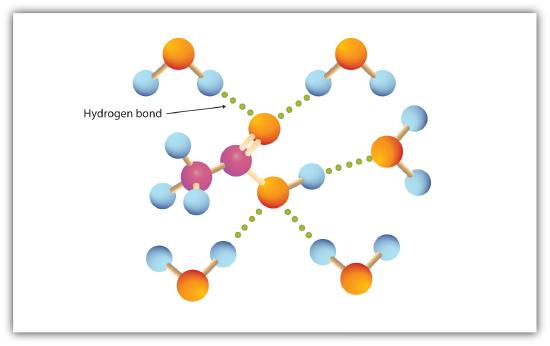
karboxylová skupina se snadno zapojuje do vodíkové vazby s molekulami vody (obrázek \(\PageIndex{1}\)). Kyseliny s jedním až čtyřmi atomy uhlíku jsou zcela mísitelné s vodou. Rozpustnost se snižuje se zvyšující se délkou uhlíkového řetězce, protože dipólové síly se stávají méně důležitými a disperzní síly převládají. Kyselina hexanová je sotva rozpustná ve vodě (asi 1,0 g / 100 g vody). Kyselina palmitová se svou velkou nepolární uhlovodíkovou složkou je v podstatě nerozpustná ve vodě. Karboxylové kyseliny jsou obecně rozpustné v takových organických rozpouštědlech, jako je ethanol, toluen a diethylether.
tabulka 15.4.1 uvádí některé fyzikální vlastnosti vybraných karboxylových kyselin. Prvních šest jsou homologové. Všimněte si, že body varu se zvyšují se zvyšující se molární hmotností, ale teploty tání nevykazují žádný pravidelný vzorec.
| Condensed Structural Formula | Name of Acid | Melting Point (°C) | Boiling Point (°C) | Solubility (g/100 g of Water) |
|---|---|---|---|---|
| HCOOH | formic acid | 8 | 100 | miscible |
| CH3COOH | acetic acid | 17 | 118 | miscible |
| CH3CH2COOH | propionic acid | –22 | 141 | miscible |
| CH3(CH2)2COOH | butyric acid | –5 | 163 | miscible |
| CH3(CH2)3COOH | valeric acid | –35 | 187 | 5 |
| CH3(CH2)4COOH | caproic acid | –3 | 205 | 1.1 |
| C6H5COOH | benzoic acid | 122 | 249 | 0.29 |
Concept Review Exercises
- Which compound has the higher boiling point—butanoic acid (molar mass 88) or 2-pentanone (molar mass 86)? Explain.
- Would you expect butyric acid (butanoic acid) to be more or less soluble than 1-butanol in water? Explain.
Odpovědi
- kyselina máselná, protože vodíkové vazby (nemáme žádné mezimolekulární vodíkové vazby v 2-z.)
- více rozpustné, protože tam je více rozsáhlé vodíkové vazby
Klíčové Takeaways
- Karboxylové kyseliny mají vysoké body varu ve srovnání s jinými látkami srovnatelnou molární hmotnost. Body varu se zvyšují s molární hmotností.
- karboxylové kyseliny s jedním až čtyřmi atomy uhlíku jsou zcela mísitelné s vodou. Rozpustnost klesá s molární hmotností.
Cvičení
-
,
, Která sloučenina má vyšší bod varu—CH3CH2CH2OCH2CH3 nebo CH3CH2CH2COOH? Vysvětlit.
-
která sloučenina má vyšší bod varu-CH3CH2CH2CH2CH2OH nebo CH3CH2CH2COOH? Vysvětlit.
-
která sloučenina je rozpustnější ve vodě-CH3COOH nebo CH3CH2CH2CH3? Vysvětlit.
-
která sloučenina je rozpustnější ve vodě-CH3CH2COOH nebo CH3CH2CH2CH2CH2COOH? Vysvětlit.
Odpovědi
-
CH3CH2CH2COOH, protože vodíkové vazby (nemáme žádné mezimolekulární vodíkové vazby s CH3CH2CH2OCH2CH3.)
-
CH3COOH, protože zaměstnává ve vodíkové vazby s vodou (není mezimolekulární vodíkové vazby s CH3CH2CH2CH3.)
Leave a Reply