15.3: Fysiske Egenskaper Av Karboksylsyrer
Læringsmål
- Sammenlign kokepunktene av karboksylsyrer med alkoholer av lignende molar masse.
- Sammenlign oppløseligheten av karboksylsyrer i vann med oppløseligheten av sammenlignbare alkaner og alkoholer i vann.
Mange karboksylsyrer er fargeløse væsker med ubehagelige lukt. Karboksylsyrene med 5 til 10 karbonatomer har alle» goaty » lukt(forklarer lukten Av Limburgerost). Disse syrer produseres også av virkningen av hudbakterier på menneskelig talg (hudoljer), som står for lukten av dårlig ventilerte garderober. Syrene med mer enn 10 karbonatomer er vokslignende faste stoffer, og deres lukt reduseres med økende molar masse og resulterende avtagende volatilitet.
Karboksylsyrer utviser sterk hydrogenbinding mellom molekyler. De har derfor høye kokepunkter sammenlignet med andre stoffer med sammenlignbar molar masse.
karboksylgruppen engasjerer seg lett i hydrogenbinding med vannmolekyler (Figur \(\PageIndex{1}\)). Syrene med ett til fire karbonatomer er helt blandbare med vann. Løselighet reduseres etter hvert som karbonkjedelengden øker fordi dipolkrefter blir mindre viktige og dispersjonskrefter blir mer dominerende. Heksansyre er knapt løselig i vann (ca 1,0 g/100 g vann). Palmitinsyre, med sin store ikke-polare hydrokarbonkomponent, er i det vesentlige uoppløselig i vann. Karboksylsyrene er generelt oppløselige i slike organiske løsningsmidler som etanol, toluen og dietyleter.
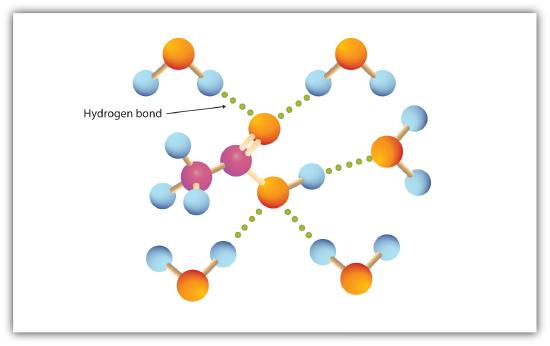
Tabell 15.4.1 viser noen fysiske egenskaper for utvalgte karboksylsyrer. De første seks er homologer. Legg merke til at kokepunktene øker med økende molar masse, men smeltepunktene viser ikke noe vanlig mønster.
| Condensed Structural Formula | Name of Acid | Melting Point (°C) | Boiling Point (°C) | Solubility (g/100 g of Water) |
|---|---|---|---|---|
| HCOOH | formic acid | 8 | 100 | miscible |
| CH3COOH | acetic acid | 17 | 118 | miscible |
| CH3CH2COOH | propionic acid | –22 | 141 | miscible |
| CH3(CH2)2COOH | butyric acid | –5 | 163 | miscible |
| CH3(CH2)3COOH | valeric acid | –35 | 187 | 5 |
| CH3(CH2)4COOH | caproic acid | –3 | 205 | 1.1 |
| C6H5COOH | benzoic acid | 122 | 249 | 0.29 |
Concept Review Exercises
- Which compound has the higher boiling point—butanoic acid (molar mass 88) or 2-pentanone (molar mass 86)? Explain.
- Would you expect butyric acid (butanoic acid) to be more or less soluble than 1-butanol in water? Explain.
Svar
- smørsyre på grunn av hydrogenbinding (det er ingen intermolekylær hydrogenbinding i 2-pentanon.)
- mer løselig fordi det er mer omfattende hydrogenbinding
Nøkkel Takeaways
- Karboksylsyrer har høye kokepunkter sammenlignet med andre stoffer med sammenlignbar molar masse. Kokepunkter øker med molar masse.
- Karboksylsyrer med ett til fire karbonatomer er helt blandbare med vann. Løseligheten reduseres med molar masse.
Øvelser
-
hvilken forbindelse har høyere kokepunkt-CH3CH2CH2OCH2CH3 ELLER CH3CH2CH2COOH? Forklare.
-
hvilken forbindelse har høyere kokepunkt—CH3CH2CH2CH2CH2OH eller CH3CH2CH2COOH? Forklare.
-
hvilken forbindelse er mer løselig i vann—CH3COOH eller CH3CH2CH2CH3? Forklare.
-
hvilken forbindelse er mer løselig i vann—CH3CH2COOH eller CH3CH2CH2CH2CH2COOH? Forklare.
Svar
-
CH3CH2CH2COOH på grunn av hydrogenbinding (det er ingen intermolekylær hydrogenbinding MED CH3CH2CH2OCH2CH3.)
-
CH3COOH FORDI DET engasjerer seg i hydrogenbinding med vann (det er ingen intermolekylær hydrogenbinding MED CH3CH2CH2CH3.)
Leave a Reply