15.3: fysische eigenschappen van carbonzuren
leerdoelstellingen
- vergelijk het kookpunt van carbonzuren met alcoholen met een vergelijkbare Molaire massa.
- vergelijk de oplosbaarheid van carbonzuren in water met de oplosbaarheid van vergelijkbare alkanen en alcoholen in water.
veel carbonzuren zijn kleurloze vloeistoffen met onaangename geuren. De carbonzuren met 5 tot 10 koolstofatomen hebben allemaal “goaty” geuren (wat de geur van Limburger kaas verklaart). Deze zuren worden ook geproduceerd door de werking van huidbacteriën op menselijke talg (huidoliën), die verantwoordelijk is voor de geur van slecht geventileerde kleedkamers. De zuren met meer dan 10 koolstofatomen zijn waxachtige vaste stoffen, en hun geur vermindert met toenemende Molaire massa en resulterende afnemende vluchtigheid.
carbonzuren vertonen een sterke waterstofbinding tussen moleculen. Zij hebben daarom een hoog kookpunt in vergelijking met andere stoffen met een vergelijkbare Molaire massa.
de carboxylgroep bindt gemakkelijk waterstof met watermoleculen (figuur \(\Paginindex{1}\)). De zuren met één tot vier koolstofatomen zijn volledig mengbaar met water. De oplosbaarheid neemt af naarmate de lengte van de koolstofketen toeneemt omdat de dipoolkrachten minder belangrijk worden en de dispersiekrachten meer overheersen. Hexaanzuur is nauwelijks oplosbaar in water (ongeveer 1,0 g/100 g water). Palmitinezuur, met zijn grote niet-polaire koolwaterstofcomponent, is in wezen onoplosbaar in water. De carbonzuren zijn over het algemeen oplosbaar in organische oplosmiddelen zoals ethanol, tolueen en diethylether.
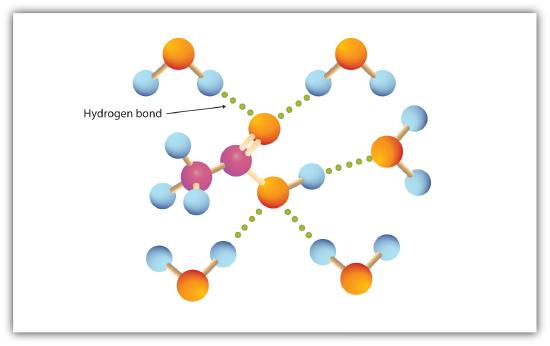
tabel 15.4.1 bevat enkele fysische eigenschappen voor geselecteerde carbonzuren. De eerste zes zijn homologen. Merk op dat de kookpunten toenemen met toenemende Molaire massa, maar de smeltpunten vertonen geen regelmatig patroon.
| Condensed Structural Formula | Name of Acid | Melting Point (°C) | Boiling Point (°C) | Solubility (g/100 g of Water) |
|---|---|---|---|---|
| HCOOH | formic acid | 8 | 100 | miscible |
| CH3COOH | acetic acid | 17 | 118 | miscible |
| CH3CH2COOH | propionic acid | –22 | 141 | miscible |
| CH3(CH2)2COOH | butyric acid | –5 | 163 | miscible |
| CH3(CH2)3COOH | valeric acid | –35 | 187 | 5 |
| CH3(CH2)4COOH | caproic acid | –3 | 205 | 1.1 |
| C6H5COOH | benzoic acid | 122 | 249 | 0.29 |
Concept Review Exercises
- Which compound has the higher boiling point—butanoic acid (molar mass 88) or 2-pentanone (molar mass 86)? Explain.
- Would you expect butyric acid (butanoic acid) to be more or less soluble than 1-butanol in water? Explain.
antwoorden
- boterzuur vanwege waterstofbindingen (er is geen intermoleculaire waterstofbindingen in 2-pentanon.)
- oplosbaarder omdat er een uitgebreidere waterstofbinding is
belangrijke afhaalpunten
- carbonzuren hebben een hoog kookpunt in vergelijking met andere stoffen met een vergelijkbare Molaire massa. Kookpunten nemen toe met de molaire massa.
- carbonzuren met één tot vier koolstofatomen zijn volledig mengbaar met water. Oplosbaarheid neemt af met Molaire massa.
oefeningen
-
welke verbinding heeft het hogere kookpunt-CH3CH2CH2OCH2CH3 of CH3CH2CH2COOH? Leggen.
-
welke verbinding heeft het hogere kookpunt-CH3CH2CH2CH2CH2OH of CH3CH2CH2COOH? Leggen.
-
welke verbinding is oplosbaar in water-CH3COOH of CH3CH2CH2CH3? Leggen.
-
welke verbinding is oplosbaar in water-CH3CH2COOH of CH3CH2CH2CH2CH2COOH? Leggen.
antwoorden
-
CH3CH2CH2COOH vanwege waterstofbinding (er is geen intermoleculaire waterstofbinding met CH3CH2CH2OCH2CH3.)
-
CH3COOH omdat het waterstof bindt met water (er is geen intermoleculaire waterstofbinding met CH3CH2CH2CH3.)
Leave a Reply