15.3: Physikalische Eigenschaften von Carbonsäuren
Lernziele
- Vergleichen Sie die Siedepunkte von Carbonsäuren mit Alkoholen ähnlicher Molmasse.
- Vergleichen Sie die Löslichkeiten von Carbonsäuren in Wasser mit den Löslichkeiten vergleichbarer Alkane und Alkohole in Wasser.
Viele Carbonsäuren sind farblose Flüssigkeiten mit unangenehmen Gerüchen. Die Carbonsäuren mit 5 bis 10 Kohlenstoffatomen haben alle „ziegenartige“ Gerüche (was den Geruch von Limburger Käse erklärt). Diese Säuren werden auch durch die Einwirkung von Hautbakterien auf menschliches Talg (Hautöle) erzeugt, was für den Geruch von schlecht belüfteten Umkleideräumen verantwortlich ist. Die Säuren mit mehr als 10 Kohlenstoffatomen sind wachsartige Feststoffe, deren Geruch mit zunehmender Molmasse und damit abnehmender Flüchtigkeit abnimmt.
Carbonsäuren weisen eine starke Wasserstoffbindung zwischen Molekülen auf. Sie weisen daher im Vergleich zu anderen Substanzen vergleichbarer Molmasse hohe Siedepunkte auf.
Die Carboxylgruppe bindet leicht Wasserstoff an Wassermoleküle (Abbildung \(\pageIndex{1}\)). Die Säuren mit einem bis vier Kohlenstoffatomen sind vollständig mit Wasser mischbar. Die Löslichkeit nimmt mit zunehmender Kohlenstoffkettenlänge ab, da die Dipolkräfte weniger wichtig und die Dispersionskräfte vorherrschender werden. Hexansäure ist in Wasser kaum löslich (etwa 1,0 g / 100 g Wasser). Palmitinsäure mit ihrer großen unpolaren Kohlenwasserstoffkomponente ist in Wasser im Wesentlichen unlöslich. Die Carbonsäuren sind im Allgemeinen in organischen Lösungsmitteln wie Ethanol, Toluol und Diethylether löslich.
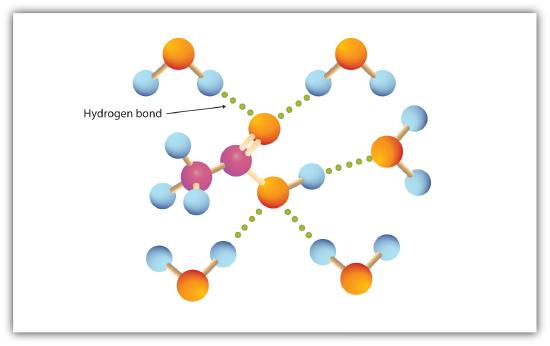
Tabelle 15.4.1 listet einige physikalische Eigenschaften für ausgewählte Carbonsäuren auf. Die ersten sechs sind Homologe. Beachten Sie, dass die Siedepunkte mit zunehmender Molmasse ansteigen, die Schmelzpunkte jedoch kein regelmäßiges Muster aufweisen.
| Condensed Structural Formula | Name of Acid | Melting Point (°C) | Boiling Point (°C) | Solubility (g/100 g of Water) |
|---|---|---|---|---|
| HCOOH | formic acid | 8 | 100 | miscible |
| CH3COOH | acetic acid | 17 | 118 | miscible |
| CH3CH2COOH | propionic acid | –22 | 141 | miscible |
| CH3(CH2)2COOH | butyric acid | –5 | 163 | miscible |
| CH3(CH2)3COOH | valeric acid | –35 | 187 | 5 |
| CH3(CH2)4COOH | caproic acid | –3 | 205 | 1.1 |
| C6H5COOH | benzoic acid | 122 | 249 | 0.29 |
Concept Review Exercises
- Which compound has the higher boiling point—butanoic acid (molar mass 88) or 2-pentanone (molar mass 86)? Explain.
- Would you expect butyric acid (butanoic acid) to be more or less soluble than 1-butanol in water? Explain.
- Buttersäure wegen Wasserstoffbindung (In 2-Pentanon gibt es keine intermolekulare Wasserstoffbindung.)
- löslicher, weil es eine umfangreichere Wasserstoffbindung gibt
- Buttersäure wegen Wasserstoffbindung (In 2-Pentanon gibt es keine intermolekulare Wasserstoffbindung.)
- löslicher, weil es eine umfangreichere Wasserstoffbindung gibt
Wichtige Erkenntnisse
- Carbonsäuren haben im Vergleich zu anderen Substanzen vergleichbarer Molmasse hohe Siedepunkte. Die Siedepunkte nehmen mit der Molmasse zu.
- Carbonsäuren mit einem bis vier Kohlenstoffatomen sind vollständig mit Wasser mischbar. Die Löslichkeit nimmt mit der Molmasse ab.
-
Welche Verbindung hat den höheren Siedepunkt —CH3CH2CH2OCH2CH3 oder CH3CH2CH2COOH? Erklären.
-
Welche Verbindung hat den höheren Siedepunkt – CH3CH2CH2CH2CH2OH oder CH3CH2CH2COOH? Erklären.
-
Welche Verbindung ist in Wasser löslicher – CH3COOH oder CH3CH2CH2CH3? Erklären.
-
Welche Verbindung ist in Wasser löslicher – CH3CH2COOH oder CH3CH2CH2CH2CH2COOH? Erklären.
Welche Verbindung hat den höheren Siedepunkt —CH3CH2CH2OCH2CH3 oder CH3CH2CH2COOH? Erklären.
Welche Verbindung hat den höheren Siedepunkt – CH3CH2CH2CH2CH2OH oder CH3CH2CH2COOH? Erklären.
Welche Verbindung ist in Wasser löslicher – CH3COOH oder CH3CH2CH2CH3? Erklären.
Welche Verbindung ist in Wasser löslicher – CH3CH2COOH oder CH3CH2CH2CH2CH2COOH? Erklären.
-
CH3CH2CH2COOH wegen Wasserstoffbindung (Es gibt keine intermolekulare Wasserstoffbindung mit CH3CH2CH2OCH2CH3.)
-
CH3COOH weil es in Wasserstoffbindung mit Wasser eingreift (Es gibt keine intermolekulare Wasserstoffbindung mit CH3CH2CH2CH3.)
CH3CH2CH2COOH wegen Wasserstoffbindung (Es gibt keine intermolekulare Wasserstoffbindung mit CH3CH2CH2OCH2CH3.)
CH3COOH weil es in Wasserstoffbindung mit Wasser eingreift (Es gibt keine intermolekulare Wasserstoffbindung mit CH3CH2CH2CH3.)
Leave a Reply