15.3: Propiedades físicas de los Ácidos Carboxílicos
Objetivos de aprendizaje
- Comparar los puntos de ebullición de los ácidos carboxílicos con alcoholes de masa molar similar.
- Compare las solubilidades de ácidos carboxílicos en agua con las solubilidades de alcanos y alcoholes comparables en agua.
Muchos ácidos carboxílicos son líquidos incoloros con olores desagradables. Los ácidos carboxílicos con 5 a 10 átomos de carbono tienen olores «de cabra» (que explican el olor del queso Limburger). Estos ácidos también se producen por la acción de las bacterias de la piel sobre el sebo humano (aceites de la piel), lo que explica el olor de los vestuarios mal ventilados. Los ácidos con más de 10 átomos de carbono son sólidos similares a la cera, y su olor disminuye con el aumento de la masa molar y la consiguiente disminución de la volatilidad.
Los ácidos carboxílicos exhiben fuertes enlaces de hidrógeno entre moléculas. Por lo tanto, tienen altos puntos de ebullición en comparación con otras sustancias de masa molar comparable.
El grupo carboxilo participa fácilmente en enlaces de hidrógeno con moléculas de agua (Figura \(\pageIndex{1}\)). Los ácidos con uno a cuatro átomos de carbono son completamente miscibles con agua. La solubilidad disminuye a medida que aumenta la longitud de la cadena de carbono porque las fuerzas dipolares se vuelven menos importantes y las fuerzas de dispersión se vuelven más predominantes. El ácido hexanoico es apenas soluble en agua (aproximadamente 1,0 g / 100 g de agua). El ácido palmítico, con su gran componente hidrocarburo no polar, es esencialmente insoluble en agua. Los ácidos carboxílicos generalmente son solubles en solventes orgánicos como etanol, tolueno y éter dietílico.
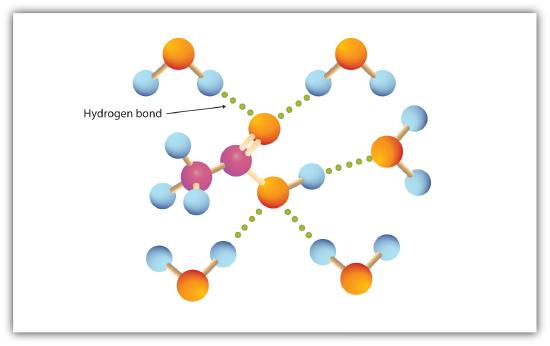
La tabla 15.4.1 enumera algunas propiedades físicas de ácidos carboxílicos seleccionados. Los primeros seis son homólogos. Observe que los puntos de ebullición aumentan con el aumento de la masa molar, pero los puntos de fusión no muestran un patrón regular.
| Condensed Structural Formula | Name of Acid | Melting Point (°C) | Boiling Point (°C) | Solubility (g/100 g of Water) |
|---|---|---|---|---|
| HCOOH | formic acid | 8 | 100 | miscible |
| CH3COOH | acetic acid | 17 | 118 | miscible |
| CH3CH2COOH | propionic acid | –22 | 141 | miscible |
| CH3(CH2)2COOH | butyric acid | –5 | 163 | miscible |
| CH3(CH2)3COOH | valeric acid | –35 | 187 | 5 |
| CH3(CH2)4COOH | caproic acid | –3 | 205 | 1.1 |
| C6H5COOH | benzoic acid | 122 | 249 | 0.29 |
Concept Review Exercises
- Which compound has the higher boiling point—butanoic acid (molar mass 88) or 2-pentanone (molar mass 86)? Explain.
- Would you expect butyric acid (butanoic acid) to be more or less soluble than 1-butanol in water? Explain.
Responde a
- ácido butírico debido al enlace de hidrógeno (No hay enlace de hidrógeno intermolecular en la 2-pentanona.)
- más soluble porque hay enlaces de hidrógeno más extensos
Los ácidos carboxílicos tienen altos puntos de ebullición en comparación con otras sustancias de masa molar comparable. Los puntos de ebullición aumentan con la masa molar.
Ejercicios
-
¿Qué compuesto tiene el punto de ebullición más alto—CH3CH2CH2OCH2CH3 o CH3CH2CH2COOH? Explicar.
-
¿Qué compuesto tiene el punto de ebullición más alto—CH3CH2CH2CH2CH2OH o CH3CH2CH2COOH? Explicar.
-
Que el compuesto es más soluble en agua—CH3COOH o CH3CH2CH2CH3? Explicar.
-
¿Qué compuesto es más soluble en agua—CH3CH2COOH o CH3CH2CH2CH2CH2COOH? Explicar.
Responde
-
CH3CH2CH2COOH debido al enlace de hidrógeno (No hay enlace de hidrógeno intermolecular con CH3CH2CH2OCH2CH3.)
-
CH3COOH porque se une al hidrógeno con el agua (No hay enlaces de hidrógeno intermoleculares con CH3CH2CH2CH3.)
Leave a Reply