15.3: Propriétés Physiques des Acides Carboxyliques
Objectifs d’apprentissage
- Comparer les points d’ébullition des acides carboxyliques avec des alcools de masse molaire similaire.
- Comparer les solubilités des acides carboxyliques dans l’eau avec les solubilités d’alcanes et d’alcools comparables dans l’eau.
De nombreux acides carboxyliques sont des liquides incolores aux odeurs désagréables. Les acides carboxyliques de 5 à 10 atomes de carbone ont tous des odeurs « de chèvre » (expliquant l’odeur du fromage Limburger). Ces acides sont également produits par l’action de bactéries cutanées sur le sébum humain (huiles cutanées), ce qui explique l’odeur des vestiaires mal ventilés. Les acides ayant plus de 10 atomes de carbone sont des solides ressemblant à de la cire, et leur odeur diminue avec l’augmentation de la masse molaire et la diminution de la volatilité qui en résulte.
Les acides carboxyliques présentent une forte liaison hydrogène entre les molécules. Ils ont donc des points d’ébullition élevés par rapport à d’autres substances de masse molaire comparable.
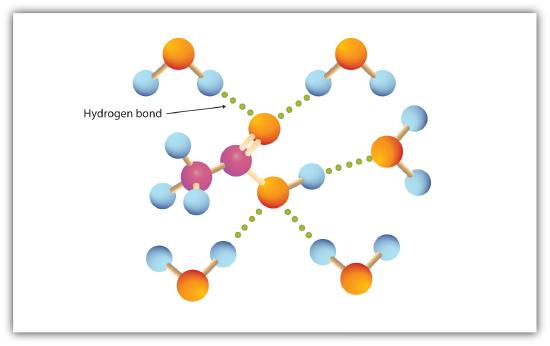
Le groupe carboxyle s’engage facilement dans la liaison hydrogène avec des molécules d’eau (Figure\(\PageIndex{1}\)). Les acides avec un à quatre atomes de carbone sont complètement miscibles avec l’eau. La solubilité diminue à mesure que la longueur de la chaîne carbonée augmente, car les forces dipolaires deviennent moins importantes et les forces de dispersion deviennent plus prédominantes. L’acide hexanoïque est à peine soluble dans l’eau (environ 1,0 g / 100 g d’eau). L’acide palmitique, avec son gros composant hydrocarboné non polaire, est essentiellement insoluble dans l’eau. Les acides carboxyliques sont généralement solubles dans des solvants organiques tels que l’éthanol, le toluène et l’éther diéthylique.
Le tableau 15.4.1 énumère certaines propriétés physiques pour certains acides carboxyliques. Les six premiers sont des homologues. Notez que les points d’ébullition augmentent avec l’augmentation de la masse molaire, mais les points de fusion ne présentent pas de motif régulier.
| Condensed Structural Formula | Name of Acid | Melting Point (°C) | Boiling Point (°C) | Solubility (g/100 g of Water) |
|---|---|---|---|---|
| HCOOH | formic acid | 8 | 100 | miscible |
| CH3COOH | acetic acid | 17 | 118 | miscible |
| CH3CH2COOH | propionic acid | –22 | 141 | miscible |
| CH3(CH2)2COOH | butyric acid | –5 | 163 | miscible |
| CH3(CH2)3COOH | valeric acid | –35 | 187 | 5 |
| CH3(CH2)4COOH | caproic acid | –3 | 205 | 1.1 |
| C6H5COOH | benzoic acid | 122 | 249 | 0.29 |
Concept Review Exercises
- Which compound has the higher boiling point—butanoic acid (molar mass 88) or 2-pentanone (molar mass 86)? Explain.
- Would you expect butyric acid (butanoic acid) to be more or less soluble than 1-butanol in water? Explain.
Réponses
- acide butyrique en raison de la liaison hydrogène (Il n’y a pas de liaison hydrogène intermoléculaire dans la 2-pentanone.)
- plus soluble car il y a une liaison hydrogène plus étendue
Principaux points à retenir
- Les acides carboxyliques ont des points d’ébullition élevés par rapport à d’autres substances de masse molaire comparable. Les points d’ébullition augmentent avec la masse molaire.
- Les acides carboxyliques ayant un à quatre atomes de carbone sont complètement miscibles avec l’eau. La solubilité diminue avec la masse molaire.
Exercices
-
Quel composé a le point d’ébullition le plus élevé – CH3CH2CH2OCH2CH3 ou CH3CH2CH2COOH? Expliquer.
-
Quel composé a le point d’ébullition le plus élevé — CH3CH2CH2CH2OH ou CH3CH2CH2COOH? Expliquer.
-
Quel composé est le plus soluble dans l’eau — CH3COOH ou CH3CH2CH2CH3? Expliquer.
-
Quel composé est le plus soluble dans l’eau — CH3CH2COOH ou CH3CH2CH2CH2COOH? Expliquer.
Réponses
-
CH3CH2CH2COOH en raison de la liaison hydrogène (Il n’y a pas de liaison hydrogène intermoléculaire avec CH3CH2CH2OCH2CH3.)
-
CH3COOH parce qu’il s’engage dans une liaison hydrogène avec l’eau (Il n’y a pas de liaison hydrogène intermoléculaire avec CH3CH2CH2CH3.)
Leave a Reply