15.3: proprietățile fizice ale acizilor carboxilici
obiective de învățare
- comparați punctele de fierbere ale acizilor carboxilici cu alcooli de masă molară similară.
- comparați solubilitățile acizilor carboxilici din apă cu solubilitățile alcanilor și alcoolilor comparabili din apă.
mulți acizi carboxilici sunt lichide incolore cu mirosuri dezagreabile. Acizii carboxilici cu 5 până la 10 atomi de carbon au mirosuri „goaty” (explicând mirosul brânzei Limburger). Acești acizi sunt, de asemenea, produși prin acțiunea bacteriilor pielii asupra sebumului uman (uleiuri de piele), care reprezintă mirosul vestiarelor slab ventilate. Acizii cu mai mult de 10 atomi de carbon sunt solizi asemănători cerurilor, iar mirosul lor se diminuează odată cu creșterea masei molare și cu volatilitatea în scădere rezultată.
acizii carboxilici prezintă legături puternice de hidrogen între molecule. Prin urmare, au puncte de fierbere ridicate în comparație cu alte substanțe cu masă molară comparabilă.
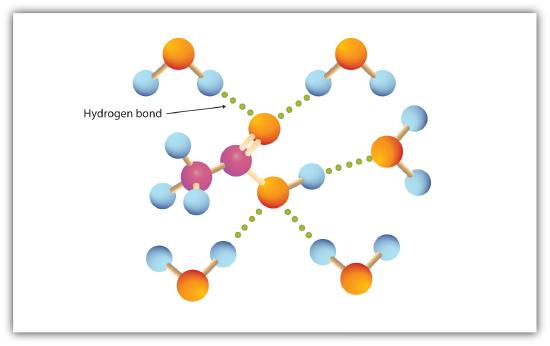
gruparea carboxil se angajează ușor în legarea hidrogenului cu moleculele de apă (figura \(\PageIndex{1}\)). Acizii cu unu până la patru atomi de carbon sunt complet miscibili cu apa. Solubilitatea scade pe măsură ce lungimea lanțului de carbon crește, deoarece forțele dipol devin mai puțin importante și forțele de dispersie devin mai predominante. Acidul Hexanoic este abia solubil în apă (aproximativ 1,0 g/100 g de apă). Acidul Palmitic, cu componenta sa mare de hidrocarburi nepolare, este în esență insolubil în apă. Acizii carboxilici sunt în general solubili în solvenți organici precum etanol, toluen și dietil eter.
tabelul 15.4.1 enumeră câteva proprietăți fizice pentru acizii carboxilici selectați. Primele șase sunt omologi. Observați că punctele de fierbere cresc odată cu creșterea masei molare, dar punctele de topire nu prezintă un model regulat.
Concept Review Exercises
- Which compound has the higher boiling point—butanoic acid (molar mass 88) or 2-pentanone (molar mass 86)? Explain.
- Would you expect butyric acid (butanoic acid) to be more or less soluble than 1-butanol in water? Explain.
răspunde
- acid butiric din cauza legăturii de hidrogen (nu există o legătură intermoleculară de hidrogen în 2-pentanonă.)
- mai solubil, deoarece există o legătură mai extinsă de hidrogen
Takeaways cheie
- acizii carboxilici au puncte de fierbere ridicate în comparație cu alte substanțe cu masă molară comparabilă. Punctele de fierbere cresc cu masa molară.
- acizii carboxilici având unul până la patru atomi de carbon sunt complet miscibili cu apa. Solubilitatea scade odată cu masa molară.
exerciții
-
care compus are punctul de fierbere mai mare—CH3CH2CH2OCH2CH3 sau CH3CH2CH2COOH? Explică.
-
care compus are punctul de fierbere mai mare—CH3CH2CH2CH2CH2OH sau CH3CH2CH2COOH? Explică.
-
care compus este mai solubil în apă—CH3COOH sau CH3CH2CH2CH3? Explică.
-
care compus este mai solubil în apă—CH3CH2COOH sau CH3CH2CH2CH2CH2COOH? Explică.
răspunsuri
-
CH3CH2CH2COOH din cauza legăturii de hidrogen (nu există o legătură intermoleculară de hidrogen cu CH3CH2CH2OCH2CH3.)
-
CH3COOH deoarece se angajează în legarea hidrogenului cu apa (nu există o legătură intermoleculară de hidrogen cu CH3CH2CH2CH3.)
Leave a Reply