Svalové kontrakce

U obratlovců existují tři typy svalových tkání: kosterní, hladké a srdeční. Kosterní sval tvoří většinu svalové hmoty v těle a je zodpovědný za pohybovou aktivitu. Hladký sval tvoří krevní cévy, gastrointestinální trakt a další oblasti v těle, které způsobují trvalé kontrakce. Srdeční sval tvoří srdce, které pumpuje krev. Kosterní a srdeční svaly se nazývají pruhované svaly kvůli jejich pruhovanému vzhledu pod mikroskopem,což je způsobeno vysoce organizovaným střídavým vzorem pásů a A i pásů.
kosterní svalyeditovat

Kromě reflexy, všechny kosterní svaly kontrakce se vyskytují jako výsledek vědomého úsilí, pocházející z mozku. Mozek vysílá elektrochemické signály nervovým systémem do motorického neuronu, který inervuje několik svalových vláken. V případě některých reflexů může signál ke kontrakci pocházet z míchy prostřednictvím zpětné vazby s šedou hmotou. Jiné akce, jako je pohyb, dýchání a žvýkání, mají reflexní aspekt: kontrakce mohou být zahájeny vědomě i nevědomě.
Neuromuskulární junctionEdit

neuromuskulární spojení je chemická synapse vytvořená kontaktem mezi motorickým neuronem a svalovým vláknem. Je to místo, ve kterém motorický neuron přenáší signál na svalové vlákno, aby zahájil svalovou kontrakci. Sled událostí, které vyústí v depolarizace svalových vláknech na nervosvalové ploténce začíná, když akční potenciál je zahájen v buňce těla motoneuronu, který je pak šíří skokově tzv. saltatorním vedení vzruchu podél axonu k nervosvalové ploténce. Jakmile dosáhne terminální bouton, akční potenciál způsobí Ca2+
ion příliv do terminálu pomocí napětí-gated vápník kanály. Na Ca2+
příliv způsobuje synaptické vezikuly obsahující neurotransmiter acetylcholin pojistky s plasmatickou membránu, uvolnění acetylcholinu do synaptické štěrbiny mezi motorických neuronů terminálu a nervosvalových ploténkách kosterních svalových vláken. Acetylcholin difunduje přes synapse a váže se a aktivuje nikotinové acetylcholinové receptory na neuromuskulárním spojení. Aktivace nikotinového receptoru otevírá svůj vnitřní sodíkový / draselný kanál, což způsobuje, že sodík spěchá a draslík vytéká. Jako výsledek, sarcolemma obrátí polaritu a jeho napětí rychle skáče z klidového membránového potenciálu -90mV až +75mV jako sodík vstupuje. Membránový potenciál se poté hyperpolarizuje, když draslík opouští, a poté se upraví zpět na klidový membránový potenciál. Tato rychlá fluktuace se nazývá potenciál koncové desky napěťově řízené iontové kanály sarkolemmy vedle koncové desky otevřené v reakci na potenciál koncové desky. Jsou specifické pro sodík a draslík a umožňují pouze jeden průchod. Tato vlna iontových pohybů vytváří akční potenciál, který se šíří z koncové desky motoru ve všech směrech. Pokud akční potenciály přestanou přicházet, acetylcholin přestane být uvolňován z terminálního boutonu. Zbývající acetylcholinu v synaptické štěrbině je buď degradován aktivní acetylcholin esterázy nebo reabsorbovány synaptický knoflík a nikdo je vlevo nahradit znehodnocené acetylcholinu.
buzení-kontrakce spojka
buzení-kontrakce spojka je proces, při kterém svalový akční potenciál ve svalových vláknech způsobuje kontrakci myofibril. V kosterním svalu, excitace–kontrakce tažné spoléhá na přímé spojení mezi klíčové proteiny, sarkoplazmatického retikula (SR) calcium release channel (označené jako ryanodine receptor, RyR) a napětí-gated L-typu vápníkové kanály (označené jako blokátory receptorů, DHPRs). DHPRs jsou umístěny na sarkolemmě (která zahrnuje povrchovou sarkolemmu a příčné tubuly), zatímco RyRs jsou umístěny přes membránu SR. V blízkosti přístavku příčné tubulu a dvou SR regiony obsahující RyRs je popisován jako triáda a je převážně tam, kde excitace–kontrakce tažné koná. Excitace–kontrakce tažné nastane, když depolarizace kosterní svalové buňky následek svalový akční potenciál, který se šíří po povrchu buňky a do svalových vláken sítě T-tubulech, čímž depolarizují vnitřní část svalových vláken. Depolarizace vnitřní části aktivuje dihydropyridinové receptory v terminálu cisternae, které jsou v těsné blízkosti ryanodine receptors v přilehlé sarkoplazmatického retikula. Aktivní dihydropyridinové receptory fyzicky interagují s ryanodine receptors je aktivovat přes nohu procesy (zahrnující konformační změny, které allosterically aktivuje ryanodine receptors). Jako ryanodine receptors otevřít, Ca2+
je propuštěn ze sarkoplazmatického retikula do místní junkční prostor a difunduje do hromadné cytoplazmě způsobí vápníku jiskra. Všimněte si, že sarkoplazmatické retikulum má velkou pufrovací kapacitu vápníku částečně díky proteinu vázajícímu vápník zvanému kalsequestrin. Téměř synchronní aktivace tisíců jisker vápníku akčním potenciálem způsobuje celulární zvýšení vápníku, což vede k nárůstu přechodného vápníku. Na Ca2+
uvolnění do cytosolu se váže na Troponin C na aktinová filamenta, aby crossbridge jízda na kole, produkující síly a, v některých situacích, pohybu. Sarko / endoplazmatické retikulum kalcium-ATPáza (SERCA) aktivně pumpuje Ca2+
Zpět do sarkoplazmatického retikula. Jak Ca2 +
klesá zpět na klidovou úroveň, síla klesá a dochází k relaxaci.
Posuvné vlákna theoryEdit

sliding filament teorie popisuje proces, používané svaly ke kontraktu. Jedná se o cyklus opakujících se událostí, které způsobují, že tenké vlákno sklouzne přes silné vlákno a vytváří napětí ve svalu. To bylo nezávisle vyvinuto Andrew Huxley a Rolf Niedergerke a Hugh Huxley a Jean Hanson v roce 1954. Fyziologicky není tato kontrakce jednotná napříč sarkomerem; centrální poloha tlustých vláken se stává nestabilní a může se během kontrakce posunout. Nicméně akce elastické bílkoviny jako titin jsou vyslovena hypotéza pro udržení rovnoměrné napětí přes sarcomere a vytáhněte tlusté vlákno, do centrální polohy.
Crossbridge cyclingEdit

Crossbridge jízda na kole je sekvence molekulárních událostí, které je základem posuvné nekonečných teorií. Křížový most je myosinová projekce, skládající se ze dvou myosinových hlav, která sahá od tlustých vláken. Každá hlava myosinu má dvě vazebná místa: jedno pro ATP a druhé pro aktin. Vazba ATP na myosinovou hlavu odděluje myosin od aktinu, což umožňuje myosinu vázat se na jinou molekulu aktinu. Jakmile je připojen, ATP se hydrolyzuje tím, myosin, který využívá vydanou energii přesunout do „polohy napnuté“, přičemž se váže slabě na část aktin vazebné místo. Zbytek vazebného místa aktinu je blokován tropomyosinem. S hydrolyzovanou ATP nyní natažená myosinová hlava obsahuje ADP + Pi. Dva ionty Ca2 +
se vážou na troponin C na aktinových vláknech. Komplex troponin-Ca2 +
způsobuje, že tropomyosin sklouzne a odblokuje zbytek vazebného místa aktinu. Odblokování zbytku vazebných míst aktinu umožňuje uzavření obou hlav myosinu a silnou vazbu myosinu na aktin. Myosinová hlava pak uvolňuje anorganický fosfát a iniciuje výkonový zdvih, který generuje sílu 2 pN. Výkonový zdvih pohybuje aktinovým vláknem dovnitř, čímž zkracuje sarkomeru. Myosin pak uvolňuje ADP, ale stále zůstává pevně vázán na aktin. Na konci zdvihu, ADP je propuštěn z myosin hlavy, takže myosin připojen k aktinu v přísnosti stavu až do dalšího ATP se váže na myosinovou. Nedostatek ATP by měl za následek stav přísnosti charakteristický pro rigor mortis. Jakmile se další ATP váže na myosin, myosinová hlava se opět oddělí od aktinu a dojde k dalšímu křížovému cyklu.
Crossbridge cycling je schopen pokračovat, pokud je v cytoplazmě dostatečné množství ATP a Ca2+
. Ukončení cyklování crossbridge může nastat, když je Ca2 +
aktivně čerpána zpět do sarkoplazmatického retikula. Když Ca2 +
již není přítomen na tenkém vlákně, tropomyosin změní konformaci zpět do předchozího stavu, aby znovu zablokoval vazebná místa. Myosin přestává vázat na tenké vlákno a sval se uvolňuje. Ionty Ca2 +
opouštějí molekulu troponinu, aby udržely koncentraci iontů Ca2 +
v sarkoplazmě. Aktivní čerpání iontů Ca2 +
do sarkoplazmatického retikula vytváří nedostatek tekutiny kolem myofibril. To způsobuje odstranění iontů Ca2 +
z troponinu. Tropomyosin-troponinový komplex tedy opět pokrývá vazebná místa na aktinových vláknech a kontrakce přestává.
Gradace kosterního svalstva contractionsEdit
síla kosterního svalové kontrakce mohou být široce rozděleny do škubnutí, shrnutí, a tetanu. Škubnutí je jediný kontrakční a relaxační cyklus produkovaný akčním potenciálem uvnitř samotného svalového vlákna. Čas mezi podnětem do motorického nervu a následné kontrakce inervovaných svalů, se nazývá latentní období, které obvykle trvá asi 10 ms a je to způsobeno tím, že čas potřebný pro nervový akční potenciál, šíření, čas pro chemický přenos na nervosvalové ploténce, pak následné kroky v excitace-kontrakce spojení.
Pokud další svalový akční potenciál měly být vyrobeny před úplné uvolnění sval škubnutí, pak další škubnutí, prostě částku na předchozí škubnutí, čímž vzniká sumace. Součtu lze dosáhnout dvěma způsoby: součtem frekvence a součtem více vláken. Při sčítání frekvence je síla vyvíjená kosterním svalem řízena změnou frekvence, při které jsou akční potenciály posílány do svalových vláken. Akční potenciály nedorazí na svaly synchronně, a během kontrakce, nějaký zlomek vláken ve svalu bude střílet v daném okamžiku. V typické situaci, kdy jsou lidé projevují své svaly tak těžké, jak jsou vědomě schopen, zhruba jedna třetina vláken v každé z těchto svalů bude oheň na jednou, i když tento poměr může být ovlivněna různými fyziologickými a psychologickými faktory (včetně Golgiho šlachové orgány a Renshaw buňky). Tato „nízká“ úroveň kontrakce je ochranným mechanismem, který zabraňuje avulzi šlachy—síla generovaná 95% kontrakcí všech vláken postačuje k poškození těla. Ve více vlákniny součtu, je-li centrální nervový systém vysílá slabý signál smlouvu sval, menší motorické jednotky, jsou více vzrušiví než ty větší, jsou stimulovány první. Jak se síla signálu zvyšuje, více motorových jednotek je excitováno kromě větších, přičemž největší motorové jednotky mají až 50krát větší kontraktilní sílu než menší. Jak se aktivuje více a větší motorické jednotky, síla svalové kontrakce se postupně zvyšuje. Koncept známý jako princip velikosti umožňuje gradaci svalové síly během slabé kontrakce v malých krocích, které se pak postupně zvětšují, když je vyžadováno větší množství síly.
konečně, pokud se frekvence svalových akčních potenciálů zvýší tak, že svalová kontrakce dosáhne své maximální síly a plošin na této úrovni, pak kontrakce je tetanus.
vztah délky a napnutíeditovat

Délka-napětí vztah vztahuje sílu izometrické kontrakci se délka svalu, při které kontrakci dochází. Svaly pracují s největším aktivním napětím, když se blíží ideální délce(často jejich klidová délka). Při protažení nebo zkrácení (ať už v důsledku působení samotného svalu nebo vnější síly) se maximální generované aktivní napětí snižuje. Toto snížení je minimální u malých odchylek, ale napětí rychle klesá, protože délka se dále odchyluje od ideálu. Vzhledem k přítomnosti elastických proteinů ve svalové buňce (jako titin) a extracelulární matrix, jako je sval natažené nad danou délku, je zcela pasivní napětí, které se staví proti prodloužení. Dohromady existuje silná odolnost proti prodloužení aktivního svalu daleko za vrchol aktivního napětí.
Síla-rychlost relationshipsEdit
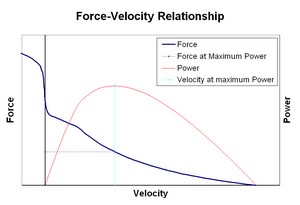
vztah síly a rychlosti se týká rychlosti, při které sval mění svou délku (obvykle regulovanou vnějšími silami, jako je zatížení nebo jiné svaly) na množství síly, kterou generuje. Síla klesá hyperbolickým způsobem vzhledem k izometrické síle, jak se rychlost zkrácení zvyšuje, nakonec dosáhne nuly při nějaké maximální rychlosti. Naopak platí, když je sval natažen-síla se zvyšuje nad izometrické maximum, až nakonec dosáhne absolutního maxima. Tato vnitřní vlastnost aktivní svalové tkáně hraje roli v aktivním tlumení kloubů, které jsou ovládány současně aktivními protichůdnými svaly. V takových případech profil síly a rychlosti zvyšuje sílu produkovanou prodlužujícím se svalem na úkor zkracujícího svalu. Toto zvýhodnění toho, který sval vrátí kloub do rovnováhy, účinně zvyšuje tlumení kloubu. Kromě toho se síla tlumení zvyšuje se svalovou silou. Motorický systém tak může aktivně řídit tlumení kloubů současnou kontrakcí (ko-kontrakcí) protichůdných svalových skupin.
Hladké muscleEdit
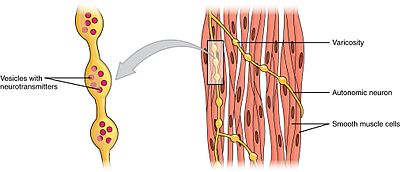
hladké svaly lze rozdělit do dvou podskupin: jednodílná (jednotková)a víceúrovňová. Jednodílné buňky hladkého svalstva se nacházejí ve střevech a krevních cévách. Protože jsou tyto buňky spojeny mezerami, jsou schopny se stahovat jako syncytium. Jednojednotkové buňky hladkého svalstva se myogenicky stahují, což může být modulováno autonomním nervovým systémem.
Na rozdíl od buněk hladkého svalstva s jednou jednotkou se buňky hladkého svalstva s více jednotkami nacházejí ve svalu oka a ve spodní části vlasových folikulů. Buňky hladkého svalstva s více jednotkami se stahují tím, že jsou Samostatně stimulovány nervy autonomního nervového systému. Jako takový, umožňují jemnou kontrolu a postupné reakce, podobně jako nábor motorických jednotek v kosterním svalu.
Mechanismy hladké svaloviny contractionEdit
kontraktilní aktivitu hladkého svalstva buněk je ovlivněna více vstupů, jako jsou spontánní elektrická aktivita, nervové a hormonální vstupy, místní změny v chemickém složení, a protáhnout. To je na rozdíl od kontraktilní aktivity buněk kosterního svalstva, která se spoléhá na jediný nervový vstup. Některé typy buněk hladkého svalstva jsou schopny spontánně generovat své vlastní akční potenciály, ke kterým obvykle dochází po potenciálu kardiostimulátoru nebo potenciálu pomalých vln. Tyto akční potenciály jsou generovány přílivem extracelulárního Ca2+
a ne Na +
. Stejně jako kosterní svaly jsou cytosolické ionty Ca2 +
také potřebné pro cyklování crossbridge v buňkách hladkého svalstva.
dva zdroje pro cytosolové Ca2+
v hladké svalové buňky jsou extracelulární Ca2+
zadání přes vápníkové kanály a Ca2+
ionty, které jsou uvolněny ze sarkoplazmatického retikula. Zvýšení cytosolického Ca2 +
vede k větší vazbě Ca2 +
Na kalmodulin, který se pak váže a aktivuje myosinovou kinázu s lehkým řetězcem. Kalcium-kalmodulin-myosin light-chain kinázy komplex fosforyluje myosin na 20 kilodalton (kDa) myosin světelné řetězy na aminokyselinové zbytky-serinu 19, zahájení kontrakce a aktivuje myosin Atpázy. Na rozdíl od buněk kosterního svalstva buňky hladkého svalstva postrádají troponin, I když obsahují tenký vláknitý protein tropomyosin a další pozoruhodné proteiny-kaldesmon a kalponin. To znamená, hladké svalové kontrakce jsou iniciovány Ca2+
-aktivuje fosforylaci myosinu, spíše než Ca2+
vazba na troponin komplex, který reguluje vazebná místa pro myosin na aktin jako v kosterní a srdeční svaly.
ukončení cyklování crossbridge (a ponechání svalu v západkovém stavu) nastává, když fosfatáza myosinového lehkého řetězce odstraní fosfátové skupiny z hlav myosinu. Fosforylace 20 kDa myosinových lehkých řetězců dobře koreluje se zkrácenou rychlostí hladkého svalstva. Během tohoto období dochází k rychlému výbuchu využití energie měřeného spotřebou kyslíku. Během několika minut po zahájení, vápník úroveň výrazně klesá, 20 kDa myosin světelné řetězy‘ fosforylace snižuje, a energetické využití snižuje; nicméně, síla v tonikum hladké svaloviny je zachována. Při kontrakci svalu, rychle cyklistika crossbridges podobě mezi aktivuje aktin a fosforylovaný myosin, generování síly. To je předpokládal, že zachování platnosti výsledků z defosforylována „latch-mosty“, které se pomalu cyklu a udržení síly. Předpokládá se, že řada kináz, jako je rho kináza, DAPK3 a protein kináza C, se účastní trvalé fáze kontrakce a tok Ca2+
může být významný.
Neuromodulaceedit
ačkoli kontrakce hladkého svalstva jsou myogenní, rychlost a síla jejich kontrakcí může být modulována autonomním nervovým systémem. Postgangliových nervových vláken parasympatiku uvolnění neurotransmiteru acetylcholinu, který se váže na muskarinové acetylcholinové receptory (mAChRs) na hladké svalové buňky. Tyto receptory jsou metabotropní nebo G-proteinové receptory, které iniciují druhou messengerovou kaskádu. Naopak, postgangliová nervová vlákna sympatického nervového systému uvolnění neurotransmiterů adrenalinu a noradrenalinu, které se váží na adrenergní receptory, které jsou také metabotropní. Přesné účinky na hladký sval závisí na specifických vlastnostech aktivovaného receptoru-parasympatický vstup i sympatický vstup mohou být buď excitační (kontraktilní) nebo inhibiční (relaxační).
Srdeční muscleEdit

k Dispozici jsou dva typy buněk srdečního svalu: autorhythmic a kontraktilní. Autorytmické buňky se nesnižují, ale místo toho nastavují tempo kontrakce pro jiné buňky srdečního svalu, které mohou být modulovány autonomním nervovým systémem. Naproti tomu kontraktilní svalové buňky (kardiomyocyty) tvoří většinu srdečního svalu a jsou schopny se stahovat.
Excitace-kontrakce couplingEdit
V obou kosterní a srdeční svalové excitace-kontrakce (E-C), tažné, depolarizace vedení a Ca2+ uvolnění procesy se vyskytují. Ačkoli jsou zapojené proteiny podobné, mají odlišnou strukturu a regulaci. Dihydropyridinové receptory (DHPRs) jsou kódovány různými geny a ryanodinové receptory (RyRs) jsou odlišné izoformy. Kromě toho, DHPR kontakty s RyR1 (hlavní RyR izoformy v kosterním svalu) k regulaci Ca2+ uvolnění v kosterním svalu, zatímco L-typ kalciového kanálu (DHPR na srdeční myocyty) a RyR2 (hlavní RyR isoformy srdečního svalu) nejsou fyzicky spolu v srdečním svalu, ale tvář se navzájem junkčním spojky.
na Rozdíl od kosterního svalstva, E-C spojky v srdečním svalu je, že závisí především na mechanismu tzv. vápníkem indukované uvolňování vápníku, který je založen na junkční struktury mezi T-tubulu a sarkoplazmatického retikula. Junctofilin-2 (JPH2) je nezbytný pro udržení této struktury, stejně jako integrity T-tubulu. Další protein, receptor accessory protein 5 (REEP5), funkce k udržení normální morfologie junkční SR. Vady junkční tažné mohou vyplývat z nedostatků obou proteinů. Během procesu uvolňování vápníku indukovaného vápníkem jsou RyR2s aktivovány spouštěčem vápníku, který je způsoben průtokem Ca2+ vápníkovými kanály typu L. Poté má srdeční sval tendenci vykazovat diad (nebo dyad) struktury spíše než triády.
Excitace-kontrakce tažné v srdeční svalové buňky nastane, když akční potenciál je iniciována kardiostimulátor buňky v sinoatriálním uzlu nebo Atrioventrikulárního uzlu a provedeny všechny buňky v srdci prostřednictvím gap junctions. Akční potenciál se šíří podél povrchu membrány do T-tubulů (tyto nejsou vidět ve všech srdečních buněk typy) a způsobuje depolarizaci extracelulární Ca2+
vstup do buňky prostřednictvím L-typu vápník kanálů a případně sodno-vápenatý výměník (NCX) během rané fáze plató. Ačkoli tento příliv Ca2+ se počítá pouze pro asi 10% Ca2+ potřebných pro aktivaci, je relativně větší než u kosterního svalu. Tento příliv Ca2 +
způsobuje malé lokální zvýšení intracelulárního Ca2 +
. Zvýšení intracelulární Ca2+
odstranění podle RyR2 v membráně sarkoplazmatického retikula, které uvolní Ca2+
v pozitivní zpětnou vazbu fyziologické reakce. Tato pozitivní zpětná vazba je známá jako uvolňování vápníku vyvolané vápníkem a vede ke vzniku jisker vápníku (Ca2+
jiskry). Prostorové a časové sumace ~30,000 Ca2+
jiskry dává buňce-široký nárůst cytoplasmatické koncentrace vápníku. Zvýšení cytosolického vápníku po toku vápníku přes buněčnou membránu a sarkoplazmatické retikulum je moderováno pufry vápníku, které vážou velkou část intracelulárního vápníku. Výsledkem je, že velké zvýšení celkového vápníku vede k relativně malému nárůstu volného Ca2 +
.
cytoplazmatické kalcium se naváže na Troponin C, pohybující se na tropomyosin komplex z aktin vazebné místo umožňuje myosin hlavy se váže na aktinová vlákna. Od tohoto okamžiku je kontraktilní mechanismus v podstatě stejný jako u kosterního svalu (výše). Krátce, pomocí hydrolýzy ATP, myosinová hlava táhne aktinové vlákno směrem ke středu sarkomery.

Následující systola, intracelulární vápník je převzat od sarco/endoplazmatického retikula Atpázy (SERCA) čerpadlo zpět do sarkoplazmatického retikula připraven pro další cyklus začít. Vápník je také vylučován z buňky hlavně výměníkem sodíku a vápníku (NCX) a v menší míře plazmatickou membránovou vápenatou Atpázou. Některé vápník jsou také přijímány mitochondriemi. Enzym, fosforečnan, slouží jako brzda pro SERCA. Při nízkých tepových frekvencích je fosforečnan aktivní a zpomaluje aktivitu ATPázy, takže Ca2+
nemusí zcela opustit buňku. Při vysokých tepových frekvencích je fosforylován a deaktivován, čímž se většina Ca2+
dostává z cytoplazmy zpět do sarkoplazmatického retikula. Opět, vápník nárazníky mírný pokles Ca2+
koncentrace, umožňující relativně malé snížení volného Ca2+
koncentrace v reakci na velkou změnu celkového vápníku. Klesající koncentrace Ca2 +
umožňuje, aby se troponinový komplex disocioval od aktinového vlákna, čímž končí kontrakce. Srdce se uvolňuje, což umožňuje komorám naplnit krví a znovu zahájit srdeční cyklus.
Leave a Reply