Contracția musculară

la animalele vertebrate, există trei tipuri de țesuturi musculare: scheletice, netede și cardiace. Mușchiul scheletic constituie majoritatea masei musculare din organism și este responsabil pentru activitatea locomotorie. Mușchiul neted formează vasele de sânge, tractul gastro-intestinal și alte zone din organism care produc contracții susținute. Mușchiul Cardiac formează inima, care pompează sângele. Mușchii scheletici și cardiaci sunt numiți mușchi striați datorită aspectului lor dungat la microscop, care se datorează modelului alternativ foarte organizat al benzilor A și I.
mușchi Scheleticedit

excluzând reflexele, toate contracțiile mușchilor scheletici apar ca urmare a efortului conștient originar din creier. Creierul trimite semnale electrochimice prin sistemul nervos către neuronul motor care inervează mai multe fibre musculare. În cazul unor reflexe, semnalul de contractare poate proveni din măduva spinării printr-o buclă de feedback cu materia cenușie. Alte acțiuni, cum ar fi locomoția, respirația și mestecarea, au un aspect reflex: contracțiile pot fi inițiate atât conștient, cât și inconștient.
joncțiune neuromusculară

o joncțiune neuromusculară este o sinapsă chimică formată prin contactul dintre un neuron motor și o fibră musculară. Este locul în care un neuron motor transmite un semnal către o fibră musculară pentru a iniția contracția musculară. Secvența de evenimente care are ca rezultat depolarizarea fibrei musculare la joncțiunea neuromusculară începe atunci când un potențial de acțiune este inițiat în corpul celular al unui neuron motor, care este apoi propagat prin conducerea salatorie de-a lungul axonului său către joncțiunea neuromusculară. Odată ce ajunge la butonul terminal, potențialul de acțiune determină un Ca2 +
aflux de ioni în terminal prin intermediul canalelor de calciu cu tensiune. Influxul Ca2 + determină veziculele sinaptice care conțin neurotransmițătorul acetilcolină să fuzioneze cu membrana plasmatică, eliberând acetilcolina în fanta sinaptică dintre terminalul neuronului motor și joncțiunea neuromusculară a fibrei musculare scheletice. Acetilcolina difuzează peste sinapsă și se leagă și activează receptorii nicotinici ai acetilcolinei pe joncțiunea neuromusculară. Activarea receptorului nicotinic deschide canalul său intrinsec de sodiu / potasiu, determinând sodiul să se grăbească și potasiul să se scurgă. Ca urmare, sarcolema inversează polaritatea și tensiunea sa sare rapid de la potențialul membranei de repaus de-90mV până la +75mv pe măsură ce sodiul intră. Potențialul membranei devine apoi hiperpolarizat atunci când potasiul iese și este apoi ajustat înapoi la potențialul membranei de repaus. Această fluctuație rapidă se numește potențialul plăcii de capăt canalele ionice cu tensiune ale sarcolemului de lângă placa de capăt deschise ca răspuns la potențialul plăcii de capăt. Sunt specifice sodiului și potasiului și permit doar o trecere. Acest val de mișcări ionice creează potențialul de acțiune care se răspândește de pe placa de capăt a motorului în toate direcțiile. Dacă potențialele de acțiune nu mai sosesc, atunci acetilcolina încetează să mai fie eliberată din butonul terminal. Acetilcolina rămasă în fisura sinaptică este fie degradată de esteraza activă a acetilcolinei, fie reabsorbită de butonul sinaptic și nu este lăsată niciuna pentru a înlocui acetilcolina degradată.
cuplarea excitație-contracție
cuplarea excitație–contracție este procesul prin care un potențial de acțiune musculară în fibra musculară determină contractarea miofibrilelor. În mușchiul scheletic, cuplarea excitație–contracție se bazează pe o cuplare directă între proteinele cheie, reticulul sarcoplasmic (SR) canalul de eliberare a calciului (identificat ca receptorul ryanodinei, RyR) și canalele de calciu de tip L cu tensiune (identificate ca receptori de dihidropiridină, DHPRs). Dhpr – urile sunt situate pe sarcolemă (care include sarcolema de suprafață și tubulii transversali), în timp ce RYR-urile se află pe membrana SR. Apoziția strânsă a unui tub transversal și a două regiuni SR care conțin RyRs este descrisă ca o triadă și este predominant acolo unde are loc cuplarea excitație–contracție. Cuplarea excitație-contracție are loc atunci când depolarizarea celulelor musculare scheletice are ca rezultat un potențial de acțiune musculară, care se răspândește pe suprafața celulei și în rețeaua de tuburi t a fibrei musculare, depolarizând astfel porțiunea interioară a fibrei musculare. Depolarizarea porțiunilor interioare activează receptorii dihidropiridinei în cisternele terminale, care se află în imediata apropiere a receptorilor ryanodinei din reticulul sarcoplasmic adiacent. Receptorii dihidropiridinici activi interacționează fizic cu receptorii ryanodinei pentru a-i activa prin procesele piciorului (implicând modificări conformaționale care activează alosteric receptorii ryanodinei). Pe măsură ce receptorii ryanodinei se deschid, Ca2+
este eliberat din reticulul sarcoplasmic în spațiul joncțional local și se difuzează în citoplasma în vrac pentru a provoca o scânteie de calciu. Rețineți că reticulul sarcoplasmic are o capacitate mare de tamponare a calciului parțial datorită unei proteine care leagă calciul numită calsequestrină. Activarea aproape sincronă a mii de scântei de calciu prin potențialul de acțiune determină o creștere la nivel celular a calciului, dând naștere la creșterea tranzitorie a calciului. Ca2 +
eliberat în citosol se leagă de troponina C de filamentele de actină, pentru a permite ciclismul crossbridge, producând forță și, în unele situații, mișcare. Sarco / reticulul endoplasmatic calcium-ATPase (SERCA) pompează activ Ca2+
înapoi în reticulul sarcoplasmic. Pe măsură ce Ca2+
scade înapoi la nivelurile de repaus, forța scade și apare relaxarea.
teoria filamentului Glisantedit

teoria filamentului glisant descrie un proces folosit de mușchi pentru a se contracta. Este un ciclu de evenimente repetitive care determină un filament subțire să alunece peste un filament gros și să genereze tensiune în mușchi. A fost dezvoltat independent de Andrew Huxley și Rolf Niedergerke și de Hugh Huxley și Jean Hanson în 1954. Fiziologic, această contracție nu este uniformă pe sarcomer; poziția centrală a filamentelor groase devine instabilă și se poate schimba în timpul contracției. Cu toate acestea, se presupune că acțiunile proteinelor elastice, cum ar fi Titina, mențin tensiunea uniformă pe sarcomer și trag filamentul gros într-o poziție centrală.
Crossbridge cyclingEdit

crossbridge cycling este o secvență de evenimente moleculare care stă la baza teoriei filamentului glisant. Un pod încrucișat este o proiecție de miozină, formată din două capete de miozină, care se extinde de la filamentele groase. Fiecare cap de miozină are două situsuri de legare: unul pentru ATP și altul pentru actină. Legarea ATP de un cap de miozină detașează miozina de actină, permițând astfel miozinei să se lege de o altă moleculă de actină. Odată atașat, ATP este hidrolizat de miozină, care folosește energia eliberată pentru a se deplasa în „poziția înclinată” prin care se leagă slab de o parte a situsului de legare a actinei. Restul locului de legare a actinei este blocat de tropomiozină. Cu ATP hidrolizat, capul de miozină armat conține acum ADP + Pi. Doi Ca2+
ioni se leagă de troponina C pe filamentele actinei. Complexul troponin-Ca2 + face ca tropomiozina să alunece și să deblocheze restul sitului de legare a actinei. Deblocarea restului situsurilor de legare a actinei permite închiderea celor două capete de miozină și miozina să se lege puternic de actină. Capul de miozină eliberează apoi fosfatul anorganic și inițiază o cursă de putere, care generează o forță de 2 pN. Cursa de putere mișcă filamentul de actină spre interior, scurtând astfel sarcomerul. Myosin eliberează apoi ADP, dar rămâne strâns legat de actină. La sfârșitul cursei de putere, ADP este eliberat din capul miozinei, lăsând miozina atașată la actină într-o stare de rigoare până când un alt ATP se leagă de miozină. Lipsa ATP ar duce la starea de rigoare caracteristică rigor mortis. Odată ce un alt ATP se leagă de miozină, capul miozinei se va detașa din nou de actină și apare un alt ciclu crossbridges.
ciclismul Crossbridge este capabil să continue atâta timp cât există cantități suficiente de ATP și Ca2+
în citoplasmă. Încetarea ciclismului crossbridge poate apărea atunci când Ca2+
este pompat activ înapoi în reticulul sarcoplasmic. Când Ca2+
nu mai este prezent pe filamentul subțire, tropomiozina schimbă conformația înapoi la starea sa anterioară, astfel încât să blocheze din nou locurile de legare. Miozina încetează să se lege de filamentul subțire, iar mușchiul se relaxează. Ca2 +
ionii părăsesc molecula de troponină pentru a menține concentrația de ioni Ca2+
în sarcoplasmă. Pomparea activă a ionilor Ca2 +
în reticulul sarcoplasmic creează o deficiență în fluidul din jurul miofibrilelor. Aceasta determină îndepărtarea ionilor de Ca2 +
din troponină. Astfel, complexul tropomiozin-troponină acoperă din nou locurile de legare pe filamentele de actină și contracția încetează.
gradarea contractiilor musculare scheletaledit
forța contracțiilor musculare scheletice poate fi în general separată în tic nervos, însumare și tetanos. Un tic nervos este un singur ciclu de contracție și relaxare produs de un potențial de acțiune în interiorul fibrei musculare în sine. Timpul dintre un stimul la nervul motor și contracția ulterioară a mușchiului inervat se numește perioada latentă, care durează de obicei aproximativ 10 ms și este cauzată de timpul necesar pentru propagarea potențialului de acțiune nervoasă, timpul pentru transmiterea chimică la joncțiunea neuromusculară, apoi etapele ulterioare în cuplarea excitație-contracție.
dacă un alt potențial de acțiune musculară ar fi produs înainte de relaxarea completă a unei mișcări musculare, atunci următoarea mișcare se va rezuma pur și simplu la mișcarea anterioară, producând astfel o însumare. Însumarea poate fi realizată în două moduri: însumarea frecvenței și însumarea mai multor fibre. În însumarea frecvenței, forța exercitată de mușchiul scheletic este controlată prin variația frecvenței la care potențialele de acțiune sunt trimise fibrelor musculare. Potențialele de acțiune nu ajung la mușchi sincron și, în timpul unei contracții, o parte din fibrele din mușchi vor arde la un moment dat. Într-o circumstanță tipică, atunci când oamenii își exercită mușchii la fel de greu pe cât sunt capabili în mod conștient, aproximativ o treime din fibrele din fiecare dintre acești mușchi se vor declanșa simultan, deși acest raport poate fi afectat de diverși factori fiziologici și psihologici (inclusiv organele tendonului Golgi și celulele Renshaw). Acest nivel scăzut de contracție este un mecanism de protecție pentru a preveni avulsia tendonului—forța generată de o contracție de 95% a tuturor fibrelor este suficientă pentru a deteriora corpul. În însumarea mai multor fibre, dacă sistemul nervos central trimite un semnal slab pentru a contracta un mușchi, unitățile motorii mai mici, fiind mai excitabile decât cele mai mari, sunt stimulate mai întâi. Pe măsură ce puterea semnalului crește, mai multe unități motorii sunt excitate pe lângă cele mai mari, cele mai mari unități motorii având până la 50 de ori puterea contractilă decât cele mai mici. Pe măsură ce sunt activate unități motorii din ce în ce mai mari, forța contracției musculare devine progresiv mai puternică. Un concept cunoscut sub numele de principiul mărimii, permite o gradare a forței musculare în timpul contracției slabe să apară în pași mici, care apoi devin progresiv mai mari atunci când sunt necesare cantități mai mari de forță.
în cele din urmă, dacă frecvența potențialelor de acțiune musculară crește astfel încât contracția musculară atinge forța maximă și platourile la acest nivel, atunci contracția este un tetanos.
relație lungime-tensiune

relația lungime-tensiune leagă puterea unei contracții izometrice de lungimea mușchiului la care are loc contracția. Mușchii funcționează cu cea mai mare tensiune activă atunci când sunt aproape de o lungime ideală (adesea lungimea lor de repaus). Când este întins sau scurtat dincolo de aceasta (fie datorită acțiunii mușchiului în sine, fie printr-o forță exterioară), tensiunea activă maximă generată scade. Această scădere este minimă pentru abateri mici, dar tensiunea scade rapid pe măsură ce lungimea se abate mai departe de ideal. Datorită prezenței proteinelor elastice într-o celulă musculară (cum ar fi Titina) și matricea extracelulară, deoarece mușchiul este întins dincolo de o lungime dată, există o tensiune complet pasivă, care se opune prelungirii. Combinate împreună, există o rezistență puternică la prelungirea unui mușchi activ cu mult peste vârful tensiunii active.
relația forță-viteză
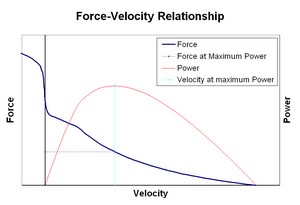
relația forță–viteză leagă viteza cu care un mușchi își schimbă lungimea (de obicei reglată de forțe externe, cum ar fi sarcina sau alți mușchi) de cantitatea de forță pe care o generează. Forța scade într-un mod hiperbolic în raport cu forța izometrică pe măsură ce viteza de scurtare crește, ajungând în cele din urmă la zero la o anumită viteză maximă. Reversul este valabil atunci când mușchiul este întins – forța crește peste maximul izometric, până când ajunge în cele din urmă la un maxim absolut. Această proprietate intrinsecă a țesutului muscular activ joacă un rol în amortizarea activă a articulațiilor care sunt acționate de mușchii opuși simultan activi. În astfel de cazuri, profilul forță-viteză sporește forța produsă de mușchiul prelungitor în detrimentul mușchiului scurtat. Această favorizare a oricărui mușchi readuce articulația la echilibru crește efectiv amortizarea articulației. Mai mult, rezistența amortizării crește odată cu forța musculară. Astfel, sistemul motor poate controla activ amortizarea articulațiilor prin contracția simultană (co-contracție) a grupurilor musculare opuse.
musculatură Netedăedit
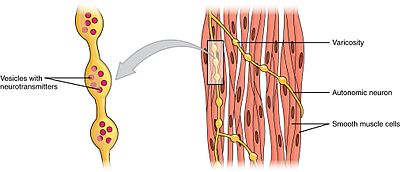
mușchii netezi pot fi împărțiți în două subgrupe: o singură unitate (unitară) și mai multe unități. Celulele musculare netede cu o singură unitate pot fi găsite în intestin și vasele de sânge. Deoarece aceste celule sunt legate între ele prin joncțiuni gap, ele sunt capabile să se contracte ca un sincitiu. Celulele musculare netede cu o singură unitate se contractă miogenic, care pot fi modulate de sistemul nervos autonom.spre deosebire de celulele musculare netede cu o singură unitate, celulele musculare netede cu mai multe unități se găsesc în mușchiul ochiului și în baza foliculilor de păr. Celulele musculare netede cu mai multe unități se contractă prin stimularea separată a nervilor sistemului nervos autonom. Ca atare, ele permit un control fin și răspunsuri treptate, la fel ca recrutarea unității motorii în mușchii scheletici.
mecanisme de contracție a mușchilor netezi
activitatea contractilă a celulelor musculare netede este influențată de intrări multiple, cum ar fi activitatea electrică spontană, intrările neuronale și hormonale, modificările locale ale compoziției chimice și întinderea. Acest lucru este în contrast cu activitatea contractilă a celulelor musculare scheletice, care se bazează pe o singură intrare neuronală. Unele tipuri de celule musculare netede sunt capabile să-și genereze propriile potențiale de acțiune spontan, care apar de obicei în urma unui potențial de stimulator cardiac sau a unui potențial de undă lentă. Aceste potențiale de acțiune sunt generate de afluxul de ca extracelular2+
, și nu Na+
. La fel ca mușchii scheletici, ionii citosolici Ca2+
sunt, de asemenea, necesari pentru ciclismul crossbridge în celulele musculare netede.
cele două surse pentru Ca2+citosolic
în celulele musculare netede sunt Ca2+extracelular
care intră prin canalele de calciu și Ca2+
ioni care sunt eliberați din reticulul sarcoplasmic. Creșterea Ca2 citosolic + are ca rezultat mai mult Ca2+
legarea la calmodulină, care apoi se leagă și activează miozina kinază cu lanț ușor. Complexul de kinază cu lanț ușor de calciu-calmodulină-miozină fosforilează miozina pe lanțurile ușoare de miozină de 20 kilodalton (kDa) pe reziduurile de aminoacizi-Serina 19, inițiind contracția și activând ATPaza miozinei. Spre deosebire de celulele musculare scheletice, celulele musculare netede nu au troponină, chiar dacă conțin proteina cu filament subțire tropomiozină și alte proteine notabile – caldesmon și calponină. Astfel, contracțiile musculare netede sunt inițiate de fosforilarea Ca2 + activată a miozinei, mai degrabă decât de legarea Ca2+de complexul troponinei care reglează locurile de legare a miozinei pe actină, cum ar fi în mușchii scheletici și cardiaci.
încetarea ciclismului crossbridge (și lăsarea mușchiului în stare de blocare) apare atunci când fosfataza lanțului ușor de miozină îndepărtează grupările fosfat din capetele miozinei. Fosforilarea lanțurilor ușoare de miozină de 20 kDa se corelează bine cu viteza de scurtare a mușchiului neted. În această perioadă, există o explozie rapidă de utilizare a energiei măsurată prin consumul de oxigen. În câteva minute de la inițiere, nivelul calciului scade semnificativ, fosforilarea lanțurilor ușoare de miozină de 20 kDa scade și utilizarea energiei scade; cu toate acestea, forța în mușchiul neted tonic este menținută. În timpul contracției musculare, se formează încrucișări rapide între actina activată și miozina fosforilată, generând forță. Se presupune că menținerea forței rezultă din „punți de blocare” defosforilate care circulă încet și mențin forța. Se crede că un număr de kinaze precum rho kinaza, dapk3 și protein kinaza C participă la faza susținută de contracție, iar fluxul de Ca2+
poate fi semnificativ.
NeuromodulationEdit
deși contracțiile musculare netede sunt miogene, rata și forța contracțiilor lor pot fi modulate de sistemul nervos autonom. Fibrele nervoase postganglionare ale sistemului nervos parasimpatic eliberează neurotransmițătorul acetilcolină, care se leagă de receptorii muscarinici ai acetilcolinei (machr) pe celulele musculare netede. Acești receptori sunt metabotropi sau receptori cuplați cu proteina G care inițiază o a doua cascadă mesager. În schimb, fibrele nervoase postganglionare ale sistemului nervos simpatic eliberează neurotransmițătorii epinefrină și norepinefrină, care se leagă de receptorii adrenergici care sunt, de asemenea, metabotropici. Efectele exacte asupra mușchiului neted depind de caracteristicile specifice ale receptorului activat—atât intrarea parasimpatică, cât și intrarea simpatică pot fi fie excitatoare (contractile), fie inhibitoare (relaxante).
mușchiul Cardiacedit

există două tipuri de celule musculare cardiace: contractile. Celulele autoritmice nu se contractă, ci stabilesc ritmul contracției pentru alte celule musculare cardiace, care pot fi modulate de sistemul nervos autonom. În schimb, celulele musculare contractile (cardiomiocite) constituie majoritatea mușchiului cardiac și sunt capabile să se contracte.
excitație-contracție cuplareedit
în ambele scheletice și musculare cardiace excitație-contracție (E-C) cuplare, conducție de depolarizare și Ca2+ procesele de eliberare apar. Cu toate acestea, deși proteinele implicate sunt similare, ele sunt distincte în structură și reglare. Receptorii dihidropiridinei (Dhpr) sunt codificați de diferite gene, iar receptorii ryanodinei (RyRs) sunt izoforme distincte. În plus, contactele DHPR cu RyR1 (izoforma principală RyR în mușchiul scheletic) pentru a regla eliberarea Ca2+ în mușchiul scheletic, în timp ce canalul de calciu de tip L (DHPR pe miocitele cardiace) și RyR2 (izoforma principală RyR în mușchiul cardiac) nu sunt cuplate fizic în mușchiul cardiac, ci se confruntă unul cu celălalt printr-un cuplaj joncțional.spre deosebire de mușchii scheletici, se crede că cuplarea E-C în mușchiul cardiac depinde în primul rând de un mecanism numit eliberare de calciu indusă de calciu, care se bazează pe structura joncțională dintre tubul T și reticulul sarcoplasmic. Junctophilin – 2 (JPH2) este esențială pentru a menține această structură, precum și integritatea tubulului T. O altă proteină, proteina auxiliară a receptorului 5 (REEP5), funcționează pentru a menține morfologia normală a Sr joncțional. defectele cuplării joncționale pot rezulta din deficiențele oricăreia dintre cele două proteine. În timpul procesului de eliberare a calciului indusă de calciu, Ryr2-urile sunt activate de un declanșator de calciu, care este cauzat de fluxul de Ca2+ prin canalele de calciu de tip L. După aceasta, mușchiul cardiac tinde să prezinte structuri diad (sau diad), mai degrabă decât triade.
cuplarea excitație-contracție în celulele musculare cardiace apare atunci când un potențial de acțiune este inițiat de celulele stimulatorului cardiac în nodul sinoatrial sau nodul Atrioventricular și condus la toate celulele din inimă prin joncțiuni gap. Potențialul de acțiune se deplasează de-a lungul membranei de suprafață în tubulii T (acestea din urmă nu sunt observate la toate tipurile de celule cardiace), iar depolarizarea determină Ca2+extracelular
să intre în celulă prin canale de calciu de tip L și, eventual, schimbător de sodiu-calciu (NCX) în prima parte a fazei de platou. Deși acest aflux de Ca2 + contează doar pentru aproximativ 10% din Ca2+ necesar pentru activare, este relativ mai mare decât cel al mușchilor scheletici. Acest aflux Ca2 + determină o mică creștere locală a Ca2 intracelular +
. Creșterea intracelulară Ca2 +
este detectată de RyR2 în membrana reticulului sarcoplasmic, care eliberează Ca2+
într-un răspuns fiziologic de feedback pozitiv. Acest feedback pozitiv este cunoscut sub numele de eliberare de calciu indusă de calciu și dă naștere la scântei de calciu (Ca2+
scântei). Însumarea spațială și temporală a ~30.000 Ca2 + scântei dă o creștere la nivel celular a concentrației de calciu citoplasmatic. Creșterea calciului citosolic în urma fluxului de calciu prin membrana celulară și reticulul sarcoplasmic este moderată de tampoanele de calciu, care leagă o proporție mare de calciu intracelular. Ca urmare, o creștere mare a calciului total duce la o creștere relativ mică a Ca2+liber
.
calciul citoplasmatic se leagă de troponina C, deplasând complexul de tropomiozină de pe situsul de legare a actinei, permițând capului miozinei să se lege de filamentul actinei. Din acest punct de vedere, mecanismul contractil este în esență același ca și pentru mușchiul scheletic (de mai sus). Pe scurt, folosind hidroliza ATP, capul miozinei trage filamentul de actină spre centrul sarcomerului.

În urma sistolului, calciul intracelular este preluat de pompa sarco/reticulului endoplasmatic ATPază (serca) înapoi reticulul sarcoplasmatic gata pentru următorul ciclu pentru a începe. Calciul este, de asemenea, evacuat din celulă în principal de schimbătorul de sodiu-calciu (NCX) și, într-o măsură mai mică, de o membrană plasmatică ATPază de calciu. Unele calciu este, de asemenea, preluat de mitocondrii. O enzimă, fosfolamban, servește ca frână pentru SERCA. La ritm cardiac scăzut, fosfolambanul este activ și încetinește activitatea ATPazei, astfel încât Ca2+
nu trebuie să părăsească celula în întregime. La ritm cardiac ridicat, fosfolambanul este fosforilat și dezactivat, luând astfel majoritatea Ca2+
din citoplasmă înapoi în reticulul sarcoplasmatic. Încă o dată, tampoanele de calciu moderează această scădere a concentrației de Ca2+
, permițând o scădere relativ mică a concentrației libere de Ca2+
ca răspuns la o schimbare mare a calciului total. Concentrația de Ca2+
care se încadrează permite complexului troponinei să se disocieze de filamentul de actină, încheind astfel contracția. Inima se relaxează, permițând ventriculelor să se umple cu sânge și să înceapă din nou ciclul cardiac.
Leave a Reply