Muskelkontraktion

hos hvirveldyr er der tre typer muskelvæv: skelet, glat og hjerte. Skeletmuskulatur udgør størstedelen af muskelmassen i kroppen og er ansvarlig for lokomotorisk aktivitet. Glat muskel danner blodkar, mave-tarmkanalen og andre områder i kroppen, der producerer vedvarende sammentrækninger. Hjertemuskel udgør hjertet, som pumper blod. Skelet-og hjertemuskler kaldes striated muskel på grund af deres stribede udseende under et mikroskop, hvilket skyldes det meget organiserede skiftende mønster af A-bånd og i-bånd.
Skeletmuskulaturrediger

eksklusive reflekser forekommer alle skeletmuskulaturkontraktioner som et resultat af bevidst indsats med oprindelse i hjernen. Hjernen sender elektrokemiske signaler gennem nervesystemet til den motoriske neuron, der innerverer flere muskelfibre. I tilfælde af nogle reflekser kan signalet om at trække sig sammen stamme i rygmarven gennem en tilbagekoblingssløjfe med det grå Stof. Andre handlinger såsom bevægelse, vejrtrækning og tygning har et refleksaspekt for dem: sammentrækningerne kan indledes både bevidst eller ubevidst.
neuromuskulær junctionEdit

et neuromuskulært kryds er en kemisk synaps dannet af kontakten mellem en motorneuron og en muskelfiber. Det er det sted, hvor en motorneuron transmitterer et signal til en muskelfiber for at indlede muskelkontraktion. Sekvensen af begivenheder, der resulterer i depolarisering af muskelfiberen ved det neuromuskulære kryds, begynder, når et handlingspotentiale initieres i cellelegemet i en motorneuron, som derefter formeres ved saltledning langs dets akson mod det neuromuskulære kryds. Når den når terminalen bouton, forårsager handlingspotentialet en Ca2+
iontilstrømning til terminalen ved hjælp af de spændingsstyrede calciumkanaler. Ca2 +
– tilstrømningen får synaptiske vesikler, der indeholder neurotransmitteren acetylcholin, til at smelte sammen med plasmamembranen og frigive acetylcholin i den synaptiske kløft mellem den motoriske neuronterminal og den neuromuskulære forbindelse mellem skeletmuskelfiberen. Acetylcholin diffunderer over synapsen og binder til og aktiverer nikotinacetylcholinreceptorer på det neuromuskulære kryds. Aktivering af nikotinreceptoren åbner sin indre natrium / kaliumkanal, hvilket får natrium til at skynde sig ind og kalium til at sive ud. Som et resultat vender sarcolemma polariteten, og dens spænding springer hurtigt fra hvilemembranpotentialet på-90mV til så højt som +75mv, når natrium kommer ind. Membranpotentialet bliver derefter hyperpolariseret, når kalium kommer ud og justeres derefter tilbage til hvilemembranpotentialet. Denne hurtige udsving kaldes endepladepotentialet de spændingsstyrede ionkanaler i sarcolemma ved siden af endepladen åben som reaktion på endepladepotentialet. De er natrium – og kaliumspecifikke og tillader kun en igennem. Denne bølge af ionbevægelser skaber handlingspotentialet, der spreder sig fra motorens endeplade i alle retninger. Hvis handlingspotentialer holder op med at ankomme, ophører acetylcholin med at blive frigivet fra terminalen bouton. Den resterende acetylcholin i den synaptiske kløft nedbrydes enten af aktiv acetylcholinesterase eller reabsorberes af den synaptiske knap, og der er ingen tilbage til at erstatte den nedbrudte acetylcholin.
eksitation-sammentrækningskoblingredit
eksitation–sammentrækningskobling er den proces, hvormed et muskulært handlingspotentiale i muskelfiberen får myofibrillerne til at trække sig sammen. I skeletmuskulatur er spændingskobling afhængig af en direkte kobling mellem nøgleproteiner, det sarkoplasmatiske retikulum (SR) calciumfrigivelseskanal (identificeret som ryanodinreceptor, RyR) og spændingsstyrede L-type calciumkanaler (identificeret som dihydropyridinreceptorer, DHPRs). DHPRs er placeret på sarcolemma (som inkluderer overfladen sarcolemma og de tværgående tubuli), mens RyRs ligger over SR-membranen. Den tætte placering af en tværgående tubule og to SR–regioner, der indeholder RYR ‘ er, beskrives som en triade og er overvejende hvor eksitations-sammentrækningskobling finder sted. Spænding-sammentrækningskobling opstår, når depolarisering af skeletmuskelcelle resulterer i et muskelaktionspotentiale, der spreder sig over celleoverfladen og ind i muskelfiberens netværk af T-tubuli og derved depolariserer den indre del af muskelfiberen. Depolarisering af de indre dele aktiverer dihydropyridinreceptorer i de terminale Cisterner, som er tæt på ryanodinreceptorer i det tilstødende sarkoplasmatiske retikulum. De aktiverede dihydropyridinreceptorer interagerer fysisk med ryanodinreceptorer for at aktivere dem via fodprocesser (involverer konformationsændringer, der allosterisk aktiverer ryanodinreceptorerne). Når ryanodinreceptorerne åbnes, frigives Ca2+
fra det sarkoplasmatiske retikulum ind i det lokale Krydsrum og diffunderer ind i massecytoplasmaet for at forårsage en calciumgnist. Bemærk, at det sarkoplasmatiske retikulum har en stor calciumbufferkapacitet delvist på grund af et calciumbindende protein kaldet calsecestrin. Den næsten synkrone aktivering af tusinder af calciumgnister ved handlingspotentialet forårsager en celledækkende stigning i calcium, der giver anledning til opstød af calcium forbigående. Ca2+
frigivet i cytosolen binder til Troponin C af actinfilamenterne for at tillade Crossbridge-cykling, der producerer kraft og i nogle situationer bevægelse. Det sarco / endoplasmatiske retikulum calcium-ATPase (SERCA) pumper aktivt Ca2+
Tilbage i det sarkoplasmatiske retikulum. Da Ca2 +
falder tilbage til hvilende niveauer, falder kraften og afslapning opstår.
glidende filamentteoriedit

den glidende filamentteori beskriver en proces, der bruges af muskler til at trække sig sammen. Det er en cyklus af gentagne begivenheder, der får et tyndt filament til at glide over et tykt filament og generere spændinger i muskelen. Det blev uafhængigt udviklet af Rolf Niedergerke og Hugh Hucsley og Jean Hanson i 1954. Fysiologisk er denne sammentrækning ikke ensartet på tværs af sarkomeren; den centrale position af de tykke filamenter bliver ustabil og kan skifte under sammentrækning. Imidlertid antages handlingerne af elastiske proteiner, såsom titin, at opretholde ensartet spænding over sarkomeren og trække det tykke filament i en central position.
Crossbridge cyclingEdit
Crossbridge cycling er en sekvens af molekylære begivenheder, der ligger til grund for glidende filamentteori. En crossbridge er en myosinprojektion, der består af to myosinhoveder, der strækker sig fra de tykke filamenter. Hvert myosinhoved har to bindingssteder: et for ATP og et andet for actin. Bindingen af ATP til et myosinhoved løsner myosin fra actin, hvorved myosin kan binde til et andet actinmolekyle. Når den er fastgjort, hydrolyseres ATP af myosin, som bruger den frigjorte energi til at bevæge sig ind i den “spændte position”, hvorved den binder svagt til en del af actinbindingsstedet. Resten af actinbindingsstedet er blokeret af tropomyosin. Med ATP hydrolyseret indeholder det spændte myosinhoved nu ADP + Pi. To Ca2 +
ioner binder til troponin C på actinfilamenterne. Troponin-Ca2 +
– komplekset får tropomyosin til at glide over og fjerne blokeringen af resten af actinbindingsstedet. Blokering af resten af actinbindingsstederne gør det muligt for de to myosinhoveder at lukke, og myosin binder stærkt til actin. Myosinhovedet frigiver derefter det uorganiske fosfat og indleder et kraftslag, der genererer en kraft på 2 pN. Effektslaget bevæger actinfilamentet indad og derved forkorter sarkomeren. Myosin frigiver derefter ADP, men forbliver stadig tæt bundet til actin. I slutningen af kraftslaget frigøres ADP fra myosinhovedet, hvilket efterlader myosin bundet til actin i en streng tilstand, indtil en anden ATP binder til myosin. Mangel på ATP ville resultere i rigor state karakteristisk for rigor mortis. Når en anden ATP binder til myosin, vil myosinhovedet igen løsne sig fra actin, og der opstår en anden krydsbridecyklus.Crossbridge cycling kan fortsætte, så længe der er tilstrækkelige mængder ATP og Ca2+
i cytoplasmaet. Afslutning af crossbridge-cykling kan forekomme, når Ca2+
pumpes aktivt tilbage i det sarkoplasmatiske retikulum. Når Ca2+
ikke længere er til stede på det tynde filament, ændrer tropomyosinet konformation tilbage til sin tidligere tilstand for at blokere bindingsstederne igen. Myosinet ophører med at binde til det tynde filament, og muskelen slapper af. Ca2 +
ionerne forlader troponinmolekylet for at opretholde Ca2+
ionkoncentrationen i sarkoplasmaet. Den aktive pumpning af Ca2 +
ioner i det sarkoplasmatiske retikulum skaber en mangel i væsken omkring myofibrillerne. Dette medfører fjernelse af Ca2 +
ioner fra troponin. Således dækker tropomyosin-troponinkomplekset igen bindingsstederne på actinfilamenterne, og sammentrækningen ophører.
Gradation af skeletmuskelkontraktionerredit
styrken af Skeletmuskelkontraktioner kan bredt adskilles i træk, summation og stivkrampe. En træk er en enkelt sammentræknings-og afslapningscyklus produceret af et handlingspotentiale i selve muskelfiberen. Tiden mellem en stimulus til motornerven og den efterfølgende sammentrækning af den innerverede muskel kaldes den latente periode, som normalt tager omkring 10 ms og er forårsaget af den tid, det tager for nerveaktionspotentialet at formere sig, tiden for kemisk transmission ved det neuromuskulære kryds, derefter de efterfølgende trin i eksitation-sammentrækningskobling.
Hvis et andet muskelhandlingspotentiale skulle produceres inden fuldstændig afslapning af en muskeltrækning, vil den næste trækning simpelthen summe på den forrige trækning og derved producere en summation. Summation kan opnås på to måder: frekvens summation og multiple fiber summation. I frekvenssummering styres den kraft, der udøves af skeletmuskulaturen, ved at variere den frekvens, hvormed handlingspotentialer sendes til muskelfibre. Handlingspotentialer ankommer ikke synkront til musklerne, og under en sammentrækning skyder en del af fibrene i musklen til enhver tid. I en typisk situation, når mennesker udøver deres muskler så hårdt som de bevidst er i stand til, vil ca.en tredjedel af fibrene i hver af disse muskler skyde på en gang, selvom dette forhold kan påvirkes af forskellige fysiologiske og psykologiske faktorer (herunder Golgi seneorganer og Rensavceller). Dette’ lave ‘ sammentrækningsniveau er en beskyttelsesmekanisme til at forhindre avulsion af senen—kraften genereret af en 95% sammentrækning af alle fibre er tilstrækkelig til at skade kroppen. I flere fiber summation, hvis centralnervesystemet sender et svagt signal for at indgå en muskel, stimuleres de mindre motorenheder, der er mere spændende end de større, først. Efterhånden som signalets styrke øges, er flere motorenheder spændte ud over større, hvor de største motorenheder har så meget som 50 gange kontraktilstyrken som de mindre. Efterhånden som flere og større motorenheder aktiveres, bliver kraften i muskelkontraktion gradvist stærkere. Et koncept kendt som størrelsesprincippet muliggør en gradering af muskelkraft under svag sammentrækning at forekomme i små trin, som derefter gradvist bliver større, når der kræves større mængder kraft.
endelig, hvis frekvensen af muskelaktionspotentialer øges således, at muskelkontraktionen når sin maksimale kraft og plateauer på dette niveau, så er sammentrækningen en stivkrampe.
Længde-spændingsrelationrediger

Længde-spændingsforhold relaterer styrken af en isometrisk sammentrækning til længden af den muskel, hvor sammentrækningen forekommer. Muskler fungerer med størst aktiv spænding, når de er tæt på en ideel længde (ofte deres hvilende længde). Når den strækkes eller forkortes ud over dette (hvad enten det skyldes selve muskelens virkning eller ved en ydre kraft), falder den maksimale aktive spænding, der genereres. Dette fald er minimalt for små afvigelser, men spændingen falder hurtigt, da længden afviger længere fra idealet. På grund af tilstedeværelsen af elastiske proteiner i en muskelcelle (såsom titin) og ekstracellulær matrice, når muskelen strækkes ud over en given længde, er der en helt passiv spænding, der modsætter sig forlængelse. Kombineret sammen er der en stærk modstand mod at forlænge en aktiv muskel langt ud over toppen af aktiv spænding.
Krafthastighedsrelationeredit
Krafthastighedsforhold relaterer den hastighed, hvormed en muskel ændrer sin længde (normalt reguleret af eksterne kræfter, såsom belastning eller andre muskler) til den mængde kraft, den genererer. Kraft falder på en hyperbolsk måde i forhold til den isometriske kraft, når forkortelseshastigheden øges og til sidst når nul ved en vis maksimal hastighed. Det modsatte gælder, når musklen strækkes-kraften stiger over isometrisk maksimum, indtil den endelig når et absolut maksimum. Denne iboende egenskab ved aktivt muskelvæv spiller en rolle i den aktive dæmpning af led, der aktiveres af samtidig aktive modstående muskler. I sådanne tilfælde forstærker krafthastighedsprofilen den kraft, der produceres af den forlængende muskel på bekostning af den forkortede muskel. Denne begunstigelse af, hvilken muskel der returnerer leddet til ligevægt, øger effektivt dæmpningen af leddet. Desuden øges styrken af dæmpningen med muskelkraft. Motorsystemet kan således aktivt kontrollere ledd dæmpning via den samtidige sammentrækning (co-sammentrækning) af modstående muskelgrupper.
glat muskleredit
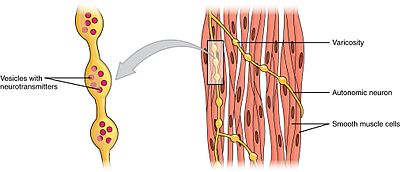
glatte muskler kan opdeles i to undergrupper: single-unit (unitary) og multi-unit. Enkelt-enhed glatte muskelceller kan findes i tarmen og blodkar. Fordi disse celler er bundet sammen af hulkryds, er de i stand til at indgå som et syncytium. Glatte muskelceller med en enhed sammentrækkes myogenisk, som kan moduleres af det autonome nervesystem.
I modsætning til glatte muskelceller med en enhed findes glatte muskelceller med flere enheder i øjets muskel og i bunden af hårsækkene. Multi-enhed glatte muskelceller trækker sig sammen ved at blive stimuleret separat af nerver i det autonome nervesystem. Som sådan giver de mulighed for fin kontrol og gradvise reaktioner, ligesom rekruttering af motorenheder i skeletmuskulatur.
mekanismer for glat muskelkontraktionredit
den kontraktile aktivitet af glatte muskelceller påvirkes af flere input såsom spontan elektrisk aktivitet, neurale og hormonelle input, lokale ændringer i kemisk sammensætning og strækning. Dette er i modsætning til den kontraktile aktivitet af skeletmuskelceller, der er afhængig af et enkelt neuralt input. Nogle typer glatte muskelceller er i stand til at generere deres egne handlingspotentialer spontant, hvilket normalt forekommer efter et pacemakerpotentiale eller et langsomt bølgepotentiale. Disse handlingspotentialer genereres ved tilstrømningen af ekstracellulær Ca2+
og ikke Na+
. Ligesom skeletmuskler kræves cytosoliske Ca2+
ioner også til crossbridge-cykling i glatte muskelceller.
de to kilder til cytosolisk Ca2+
i glatte muskelceller er den ekstracellulære Ca2+
ind gennem calciumkanaler og Ca2+
ioner, der frigives fra det sarkoplasmatiske retikulum. Forhøjelsen af cytosolisk Ca2+
resulterer i mere Ca2+
binding til calmodulin, som derefter binder og aktiverer myosin-lyskædekinase. Calcium-calmodulin-myosin-lyskædekinasekomplekset phosphorylerer myosin på de 20 kilodalton (kDa) myosin-lette kæder på aminosyrerest-serin 19, initierende sammentrækning og aktivering af myosin-atpasen. I modsætning til skeletmuskelceller mangler glatte muskelceller troponin, selvom de indeholder det tynde filamentprotein tropomyosin og andre bemærkelsesværdige proteiner – caldesmon og calponin. Således initieres glatte muskelsammentrækninger af Ca2+
-aktiveret phosphorylering af myosin snarere end Ca2+
binding til troponinkomplekset, der regulerer myosinbindingssteder på actin som i skelet-og hjertemuskler.
afslutning af crossbridge-cykling (og forlader muskelen i latch-state) opstår, når myosin-lyskædefosfatase fjerner fosfatgrupperne fra myosinhovederne. Phosphorylering af de 20 kDa myosin lette kæder korrelerer godt med forkortelseshastigheden af glat muskel. I denne periode er der en hurtig udbrud af energiudnyttelse målt ved iltforbrug. Inden for få minutter efter initiering falder calciumniveauet markant, 20 kDa myosin-lette kæders phosphorylering falder, og energiudnyttelsen falder; imidlertid opretholdes kraft i tonisk glat muskel. Under sammentrækning af muskler dannes hurtigt cyklende krydsbroer mellem aktiveret actin og phosphoryleret myosin, hvilket genererer kraft. Det antages, at vedligeholdelsen af kraft skyldes dephosphorylerede “låsebroer”, der langsomt cykler og opretholder kraft. Et antal kinaser såsom rho-kinase, DAPK3 og proteinkinase C antages at deltage i den vedvarende fase af sammentrækning, og Ca2+
strømning kan være signifikant.
Neuromodulationredit
selvom glatte muskelkontraktioner er myogene, kan hastigheden og styrken af deres sammentrækninger moduleres af det autonome nervesystem. Postganglioniske nervefibre i det parasympatiske nervesystem frigiver neurotransmitteren acetylcholin, som binder til muskariniske acetylcholinreceptorer (machr ‘ er) på glatte muskelceller. Disse receptorer er metabotrope eller G-proteinkoblede receptorer, der initierer en anden messenger-kaskade. Omvendt frigiver postganglioniske nervefibre i det sympatiske nervesystem neurotransmitterne epinephrin og norepinephrin, som binder til adrenerge receptorer, der også er metabotrope. De nøjagtige virkninger på den glatte muskel afhænger af de specifikke egenskaber ved den aktiverede receptor—både parasympatisk input og sympatisk input kan enten være spændende (kontraktil) eller hæmmende (afslappende).
Hjertemuskleredit

Der er to typer hjertemuskelceller: autorhythmic og kontraktile. Autorytmiske celler trækker sig ikke sammen, men indstiller i stedet tempoet for sammentrækning for andre hjertemuskelceller, som kan moduleres af det autonome nervesystem. I modsætning hertil udgør kontraktile muskelceller (kardiomyocytter) størstedelen af hjertemuskelen og er i stand til at trække sig sammen.
eksitation-sammentrækningskoblingredit
i både skelet-og hjertemuskelekcitation-sammentrækning (E-C) – kobling forekommer depolarisationsledning og Ca2+ frigivelsesprocesser. Men selvom de involverede proteiner er ens, er de forskellige i struktur og regulering. Dihydropyridinreceptorerne (DHPRs) er kodet af forskellige gener, og ryanodinreceptorerne (RyRs) er forskellige isoformer. Desuden kontakter DHPR med RyR1 (hoved RyR isoform i skeletmuskulatur) for at regulere Ca2+ frigivelse i skeletmuskulatur, mens L-type calciumkanal (DHPR på hjertemyocytter) og RyR2 (hoved RyR isoform i hjertemuskel) er ikke fysisk koblet i hjertemuskel, men står over for hinanden ved hjælp af en krydskobling.
I modsætning til skeletmuskulatur menes E-C-kobling i hjertemuskel primært at afhænge af en mekanisme kaldet calciuminduceret calciumfrigivelse, som er baseret på den forbindelsesstruktur mellem T-tubule og sarkoplasmatisk retikulum. Junctophilin-2 (JPH2) er afgørende for at opretholde denne struktur såvel som integriteten af T-tubule. Et andet protein, receptor tilbehør protein 5 (REEP5), funktioner til at holde den normale morfologi af junctional SR. defekter af junctional kobling kan skyldes mangler af en af de to proteiner. Under processen med calciuminduceret calciumfrigivelse aktiveres Ryr2 ‘ er af en calciumudløser, som er forårsaget af strømmen af Ca2+ gennem L-type calciumkanaler. Efter dette har hjertemuskel tendens til at udvise diad (eller dyad) strukturer snarere end triader.
eksitation-sammentrækningskobling i hjertemuskelceller opstår, når et handlingspotentiale initieres af pacemakerceller i den sinoatriale knude eller den atrioventrikulære knude og ledes til alle celler i hjertet via spaltekryds. Handlingspotentialet bevæger sig langs overflademembranen ind i T-tubuli (sidstnævnte ses ikke i alle hjertecelletyper), og depolariseringen får ekstracellulær Ca2+
til at komme ind i cellen via l-type calciumkanaler og muligvis natrium-calciumveksler (NC) i den tidlige del af plateaufasen. Selvom denne Ca2 + – tilstrømning kun tæller for cirka 10% af den Ca2+, der er nødvendig til aktivering, er den relativt større end skeletmuskulaturen. Denne Ca2+
tilstrømning forårsager en lille lokal stigning i intracellulær Ca2+
. Forøgelsen af intracellulær Ca2+
detekteres af RyR2 i membranen i det sarkoplasmatiske retikulum, som frigiver Ca2+
i en positiv feedback fysiologisk respons. Denne positive feedback er kendt som calciuminduceret calciumfrigivelse og giver anledning til calciumgnister (Ca2+
gnister). Den rumlige og tidsmæssige summation af ~30.000 Ca2+
gnister giver en celledækkende stigning i cytoplasmatisk calciumkoncentration. Stigningen i cytosolisk calcium efter strømmen af calcium gennem cellemembranen og sarkoplasmatisk retikulum modereres af calciumbuffere, som binder en stor del af intracellulært calcium. Som følge heraf fører en stor stigning i total calcium til en relativt lille stigning i fri Ca2+
.
det cytoplasmatiske calcium binder til Troponin C og flytter tropomyosinkomplekset fra actinbindingsstedet, hvilket gør det muligt for myosinhovedet at binde til actinfilamentet. Fra dette tidspunkt er den kontraktile mekanisme i det væsentlige den samme som for skeletmuskulatur (ovenfor). Kort, ved hjælp af ATP hydrolyse, myosinhovedet trækker actinfilamentet mod midten af sarkomeren.

efter systole optages intracellulært calcium af sarco / endoplasmatisk retikulum ATPase (SERCA) pumpe tilbage retikulum klar til den næste cyklus til at begynde. Calcium udstødes også fra cellen hovedsageligt af natrium-calcium-veksleren og i mindre grad en plasmamembran calcium ATPase. Nogle calcium optages også af mitokondrier. Phospholamban fungerer som en bremse for SERCA. Ved lave hjertefrekvenser er phospholamban aktiv og nedsætter aktiviteten af atpasen, så Ca2+
ikke behøver at forlade cellen helt. Ved høje hjertefrekvenser phospholamban phosphoryleres og deaktiveres således at tage de fleste Ca2+
fra cytoplasmaet tilbage i det sarkoplasmatiske retikulum. Endnu en gang modererer calciumbuffere dette fald i Ca2 +
koncentration, hvilket tillader et relativt lille fald i fri Ca2+
koncentration som reaktion på en stor ændring i total calcium. Den faldende Ca2+
koncentration gør det muligt for troponinkomplekset at adskille sig fra actinfilamentet og derved afslutte sammentrækningen. Hjertet slapper af, så ventriklerne kan fyldes med blod og begynde hjertecyklussen igen.
Leave a Reply