筋肉収縮

脊椎動物では、筋肉組織の三つのタイプがあります。筋肉組織:骨格、滑らかな、および心臓。 骨格筋はボディの筋肉固まりの大半を構成し、locomotor活動に責任があります。 平滑筋は、血管、消化管、および持続的な収縮を生成する体内の他の領域を形成する。 心筋は心臓を構成し、血液を送ります。 骨格筋および心筋は、顕微鏡下での縞模様の外観のために横紋筋と呼ばれ、これはAバンドおよびIバンドの高度に組織化された交互のパターンに
骨格筋編集

反射を除いて、すべての骨格筋の収縮は、脳に由来する意識的な努力の結果 脳は、神経系を介していくつかの筋線維を神経支配する運動ニューロンに電気化学信号を送る。 いくつかの反射の場合、収縮する信号は、灰白質とのフィードバックループを介して脊髄に由来する可能性がある。 運動、呼吸、咀嚼などの他の行動は、それらに反射的な側面を持っています:収縮は意識的または無意識のうちに開始することができます。
神経筋接合部編集

イオン流入を引き起こす。 Ca2+
流入により、神経伝達物質アセチルコリンを含むシナプス小胞が原形質膜と融合し、運動ニューロン末端と骨格筋線維の神経筋接合部との間のシナプス裂け目にアセチルコリンを放出する。 アセチルコリンはシナプスを渡って拡散し、に結合し、neuromuscular接続点のニコチンのアセチルコリンの受容器を活動化させます。 ニコチン受容体の活性化は、その本質的なナトリウム/カリウムチャネルを開き、ナトリウムが突入し、カリウムが流出する。 その結果、sarcolemmaは極性を逆転させ、電圧はナトリウムが入ると同時に-90mvの休止の膜の潜在性から+75mv高いにすぐに跳びます。 膜電位は、カリウムが出ると過分極し、次に休止中の膜電位に戻って調整される。 この急速な変動は,エンドプレート電位に応答してエンドプレートの隣にあるサルコレマの電圧ゲートイオンチャネルが開くエンドプレート電位と呼ばれる。 彼らはナトリウムとカリウムの特定であり、唯一のスルーを可能にします。 イオン動きのこの波はすべての方向のモーター端版から広がる活動電位を作成する。 活動電位が到達するのを止めると、アセチルコリンは末端ブートンから放出されなくなる。 シナプスの裂け目の残りのアセチルコリンは活動的なアセチルコリンのエステラーゼによって低下するか、またはシナプスのノブによって再吸収され、どれも低下したアセチルコリンを取り替えるために残っていません。
励起-収縮カップリング編集
励起–収縮カップリングは、筋線維の筋肉活動電位が筋原線維を収縮させるプロセスである。 骨格筋では、励起収縮カップリングは、キータンパク質、筋小胞体(SR)カルシウム放出チャネル(リアノジン受容体、RyRとして識別)と電圧ゲートL型カルシウムチャ DHPRsはsarcolemma(表面のsarcolemmaおよび横断細管を含んでいる)にRyRsはSRの膜を渡って存在するが、あります。 横尿細管とRyrを含む二つのSR領域の密接な同相はトライアドとして記述され,主に励起–収縮結合が起こる場所である。 興奮収縮のカップリングは細胞の表面を渡ってそして筋繊維のt細管のネットワークに広がる筋活動電位で骨格筋の細胞の結果の脱分極が筋繊維の内部の部分を脱分極させるとき起こります。 内側部分の脱分極は、隣接する筋小胞体のリアノジン受容体に近接している末端槽のジヒドロピリジン受容体を活性化する。 活性化されたジヒドロピリジン受容体は、リアノジン受容体と物理的に相互作用して、足のプロセス(アロステリックにリアノジン受容体を活性化する配座変化を含む)を介してそれらを活性化する。 リアノジン受容体が開くと、Ca2+
は筋小胞体から局所接合空間に放出され、バルク細胞質に拡散してカルシウムスパークを引き起こす。 筋小胞体は、カルセクストリンと呼ばれるカルシウム結合タンパク質のために、部分的に大きなカルシウム緩衝能力を有することに注意してくださ 活動電位によるカルシウム火花の何千もの近くの同期活性化は、カルシウム一過性の上昇ストロークを生じさせるカルシウムの細胞全体の増加を引 サイトゾル中に放出されたCa2+
は、アクチンフィラメントによってトロポニンCに結合し、クロスブリッジサイクルを可能にし、力を生成し、いくつかの状況では運動を可能にする。 Sarco/小胞体カルシウム-ATPase(SERCA)は、Ca2+を積極的に筋小胞体に戻す。 Ca2+
が安静時レベルに戻ると、力が低下し、弛緩が起こる。
スライディングフィラメント理論編集

スライディングフィラメント理論は、使用されるプロセスを記述する。収縮する筋肉によって。 これは、薄いフィラメントが厚いフィラメントの上を滑り、筋肉に張力を発生させる反復的な事象のサイクルである。 Andrew HuxleyとRolf Niedergerkeによって独立して開発され、1954年にHugh HuxleyとJean Hansonによって開発されました。 生理学的には、この収縮は肉腫全体で均一ではなく、厚いフィラメントの中心位置は不安定になり、収縮中にシフトする可能性がある。 しかし、ティチンのような弾性タンパク質の作用は、肉腫全体で均一な張力を維持し、厚いフィラメントを中心位置に引っ張ると仮定されている。
クロスブリッジサイクリングエディット

クロスブリッジサイクリングは、スライディングフィラメント理論の根底にある分子イベントのシーケンスである。 クロスブリッジは、太いフィラメントから伸びる二つのミオシンヘッドからなるミオシン投影である。 それぞれのミオシンヘッドには、ATPとアクチンの二つの結合部位がある。 ATPのミオシンヘッドへの結合は、ミオシンをアクチンから切り離し、それによってミオシンが別のアクチン分子に結合することを可能にする。 結合されると、ATPはミオシンによって加水分解され、放出されたエネルギーを使用してアクチン結合部位の一部に弱く結合する「コック位置」に移動する。 アクチン結合部位の残りの部分はトロポミオシンによってブロックされる。 加水分解されたATPによって、cockedミオシンの頭部はADP+Piを今含んでいます。 二つのCa2+
イオンはアクチンフィラメント上のトロポニンCに結合する。 トロポニン-Ca2+
複合体は、トロポミオシンをスライドさせ、アクチン結合部位の残りの部分のブロックを解除する。 残りのアクチン結合部位のブロックを解除すると、二つのミオシンヘッドが閉じ、ミオシンがアクチンに強く結合することができる。 ミオシンの頭部はそれから無機隣酸塩を解放し、2pNの力を発生させる力の打撃を始める。 パワーストロークはアクチンフィラメントを内側に移動させ、それによってサルコメアを短縮する。 その後、ミオシンはADPを放出するが、アクチンにしっかりと結合したままである。 力の打撃の終わりに、ADPはミオシンの頭部から解放され、別のATPがミオシンに結合するまで厳密な状態でアクチンに付すミオシンを残します。 ATPの欠如は、死後硬直の特徴的な硬直状態をもたらすであろう。 別のATPがミオシンに結合すると、ミオシンヘッドは再びアクチンから切り離され、別のクロスブリッジサイクルが発生する。
クロスブリッジサイクリングは、細胞質に十分な量のATPとCa2+
がある限り続けることができます。 クロスブリッジサイクリングの終了は、Ca2+
が筋小胞体に積極的にポンプバックされるときに起こり得る。 Ca2+
が薄いフィラメント上に存在しなくなると、トロポミオシンは結合部位を再びブロックするように立体配座を以前の状態に戻す。 ミオシンは細いフィラメントに結合しなくなり、筋肉は弛緩する。 Ca2+
イオンは、筋小胞中のCa2+
イオン濃度を維持するためにトロポニン分子を離れる。 Ca2+
イオンを筋小胞体に能動的にポンピングすると、筋原線維の周りの流体に欠損が生じる。 これによりトロポニンからCa2+
イオンが除去される。 したがって、トロポミオシン-トロポニン複合体は再びアクチンフィラメント上の結合部位を覆い、収縮は止まる。
骨格筋収縮のグラデーションedit
骨格筋収縮の強さは、単収縮、総和、破傷風に大きく分けることができます。 単収縮は、筋繊維自体内の活動電位によって生成される単一の収縮および弛緩サイクルである。 運動神経への刺激と神経支配された筋肉のそれに続く収縮の間の時間は通常約10msを取り、神経の活動電位が伝播するのにかかる時間、neuromuscular接続点で化学伝達の時間、そして刺激収縮のカップリングのそれに続くステップによって引き起こされる潜伏期間と呼ばれます。
筋肉のけいれんが完全に緩和される前に別の筋肉活動電位が生成される場合、次のけいれんは単に前のけいれんに合計され、合計が生成されます。
総和は2つの方法で達成することができます:頻度総和および多数繊維の総和。 頻度総和では、骨格筋によって及ぼされる力は活動電位が筋繊維に送られる頻度の変化によって制御されます。 活動電位は筋肉に同期的に到着せず、収縮中に筋肉内の繊維の一部が任意の時点で発火する。 典型的な状況では、人間が意識的にできるように筋肉を強く発揮しているとき、これらの筋肉のそれぞれの繊維の約三分の一が一度に発射されますが、この比率は様々な生理学的および心理的要因(ゴルジ腱器官およびレンショー細胞を含む)によって影響される可能性があります。 この「低」レベルの収縮は、腱の剥離を防ぐための保護機構であり、すべての繊維の95%の収縮によって生成される力は身体を損傷するのに十分である。 多数繊維の合計では、中枢神経系が筋肉を引き締めるために弱い信号を送ればより大きい物より興奮性である小さいモーター単位は最初に刺激されます。 信号の強度が増加するにつれて、より大きなモータユニットに加えてより多くのモータユニットが励起され、最大のモータユニットは小さいモータの収縮強さの50倍もの強度を有する。 より多くのそしてより大きいモーター単位が活動化させると同時に、筋肉収縮の力は漸進的により強くなります。 サイズの主義として知られている概念は力のより大きい量が要求されるとき漸進的により大きくなる小さいステップで起こるように弱い収縮の間の筋力のグラデーションを可能にします。
最後に、筋肉の活動電位の頻度が増加し、筋肉の収縮がこのレベルでそのピーク力および台地に達すると、収縮は破傷風である。
長さ-張力関係編集
長さ-張力関係編集

長さ-張力関係は、等尺性収縮の強さを、収縮が起こる筋肉の長さに関 筋肉は理想的な長さ(頻繁に休息の長さ)の近くで最も大きい活動的な張力と作動します。 これを超えて伸ばしたり短くしたりすると(筋肉自体の作用によるものであろうと外部の力によるものであろうと)、生成される最大の活性張力が減 この減少は小さい偏差のために最低であるが、張力は長さが理想から更に逸脱すると同時に急速に落ちる。 筋肉細胞内の伸縮性がある蛋白質の存在が原因で(titinのような)および細胞外のマトリックス、筋肉がある特定の長さを越えて伸びると同時に、延長に反対 一緒に組み合わせると、活動的な緊張のピークをはるかに超えて活動的な筋肉を長くすることに対する強い抵抗がある。
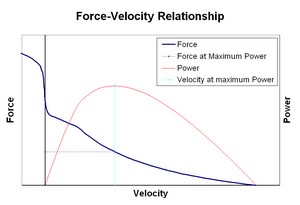
力-速度関係編集
平滑筋編集
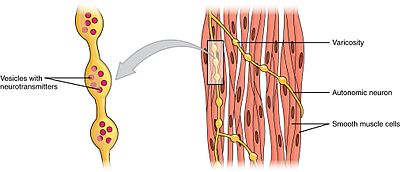
平滑筋は、単一ユニット(ユニタリ)とマルチユニットの二つのサブグループに分けることができます。 単一ユニットの平滑筋細胞は、腸および血管に見出すことができる。 これらの細胞はギャップ接合によって一緒に連結されているので、それらはsyncytiumとして収縮することができる。 単ユニット平滑筋細胞は筋原性に収縮し、これは自律神経系によって調節され得る。
単一単位の平滑筋細胞とは異なり、複数単位の平滑筋細胞は、眼の筋肉および毛包の基部に見出される。 複数のユニットの平滑筋細胞は、自律神経系の神経によって別々に刺激されることによって収縮する。 そのように、それらは骨格筋のモーター単位の募集のような良い制御そして漸進的な応答を、大いに可能にする。
平滑筋収縮のメカニズム編集
平滑筋細胞の収縮活性は、自発的な電気活動、神経およびホルモン入力、化学組成の局所的変化、およびストレッチなどの複数の入力によっ これは、単一の神経入力に依存する骨格筋細胞の収縮活性とは対照的である。 あるタイプの平滑筋細胞は通常ペースメーカーの潜在性か遅い波の潜在性に続いて起こる自身の活動電位を自発的に発生できます。 これらの活動電位は、細胞外Ca2+
の流入によって生成され、Na+
ではない。 骨格筋と同様に、サイトゾルCa2+
イオンは、平滑筋細胞におけるクロスブリッジサイクルにも必要である。
平滑筋細胞における細胞質Ca2+
の二つの源は、カルシウムチャネルを通って入る細胞外Ca2+
と筋小胞体から放出されるCa2+
イオンである。 サイトゾルCa2+
の上昇は、カルモジュリンへのより多くのCa2+
結合をもたらし、ミオシン軽鎖キナーゼに結合し、活性化する。 カルシウム-カルモジュリン-ミオシン軽鎖キナーゼ複合体は、アミノ酸残基-セリン19上の20キロダルトン(kDa)ミオシン軽鎖上のミオシンをリン酸化し、収縮を開始し、ミオシンATPaseを活性化する。 骨格筋の細胞とは違って、平滑筋の細胞は薄いフィラメント蛋白質のtropomyosinおよび他の著しい蛋白質–caldesmonおよびcalponinを含んでいるのに、troponinに欠けています。 したがって、平滑筋収縮は、骨格筋および心筋のようなアクチン上のミオシン結合部位を調節するトロポニン複合体へのCa2+結合ではなく、ミオシンのCa2+活性化リン酸化によって開始される。
ミオシン軽鎖ホスファターゼがミオシン頭部からリン酸基を除去すると、クロスブリッジサイクルの終了(および筋肉をラッチ状態に残す)が起こる。 20kDaのミオシン軽鎖のリン酸化は、平滑筋の短縮速度とよく相関しています。 この期間の間に、酸素の消費によって測定されるようにエネルギー利用の急速な破烈があります。 開始の数分以内に、カルシウムレベルは著しく減少し、20kDaのミオシン軽鎖のリン酸化は減少し、エネルギー利用は減少するが、強壮平滑筋における力は維持される。 筋肉の収縮の間に、活性化アクチンとリン酸化ミオシンの間に急速にサイクリングクロスブリッジが形成され、力を発生させる。 力の維持は、ゆっくりとサイクルして力を維持する脱リン酸化された”ラッチブリッジ”に起因すると仮定されている。 Rhoキナーゼ、DAPK3、プロテインキナーゼCなどのキナーゼの数は、収縮の持続期に関与すると考えられており、Ca2+
フラックスは重要である可能性がある。
NeuromodulationEdit
平滑筋収縮は筋原性であるが、それらの収縮の速度および強さは自律神経系によって調節され得る。 副交感神経系の節後神経線維は,平滑筋細胞上のムスカリン性アセチルコリン受容体(machrs)に結合する神経伝達物質アセチルコリンを放出する。 これらの受容体は、第二のメッセンジャーカスケードを開始するmetabotropic、またはGタンパク質共役受容体です。 逆に、交感神経系の節後神経線維は、神経伝達物質エピネフリンおよびノルエピネフリンを放出し、これはまた、metabotropicであるアドレナリン作動性受容体に結合 平滑筋に対する正確な効果は、活性化された受容体の特定の特性に依存し、副交感神経入力と交感神経入力の両方が興奮性(収縮性)または抑制性(弛緩性)
心筋編集

心筋細胞には2つのタイプがあります:自己リズムと収縮性。 自己リズム細胞は収縮しませんが、代わりに自律神経系によって調節され得る他の心筋細胞の収縮のペースを設定します。 対照的に、収縮性筋細胞(心筋細胞)は心筋の大部分を構成し、収縮することができる。
興奮-収縮カップリング編集
骨格および心筋の興奮-収縮(E-C)カップリングの両方で、脱分極伝導およびCa2+放出プロセスが起こる。 しかし、関与するタンパク質は類似しているが、それらは構造および調節において明確である。 ジヒドロピリジン受容体(DHPRs)は異なる遺伝子によってコードされ、リアノジン受容体(RyRs)は異なるアイソフォームである。 また、DHPRはryr1(骨格筋の主なRyRアイソフォーム)と接触して骨格筋のCa2+放出を調節し、L型カルシウムチャネル(心筋細胞のDHPR)とryr2(心筋の主なRyRアイソフォーム)は心筋で物理的に結合されるのではなく、接合結合によって互いに対向する。
骨格筋とは異なり、心筋におけるE-C結合は、主にt-尿細管と筋小胞体との接合構造に基づいているカルシウム誘発カルシウム放出と呼ばれる機 Junctophilin-2(JPH2)は、この構造だけでなく、T-尿細管の整合性を維持するために不可欠です。 別のタンパク質、受容体アクセサリータンパク質5(REEP5)は、接合SRの正常な形態を維持するために機能します。 カルシウム誘発カルシウム放出の過程で、Ryr2Sは、L型カルシウムチャネルを通るCa2+の流れによってもたらされるカルシウムトリガーによって活性化 この後、心筋はトライアドではなくdiad(またはdyad)構造を示す傾向があります。
心筋細胞における興奮-収縮結合は、活動電位が洞房結節または房室結節のペースメーカー細胞によって開始され、ギャップ接合を介して心臓内のすべ 活動電位は表面膜に沿ってT細管に移動し(後者はすべての心臓細胞タイプでは見られない)、脱分極により細胞外Ca2+
は、プラトー期の初期にL型カルシ このCa2+流入は、活性化に必要なCa2+の約10%にしかカウントされないが、骨格筋のそれよりも比較的大きい。 このCa2+
流入は、細胞内Ca2+
のわずかな局所的な増加を引き起こす。 細胞内Ca2+
の増加は、正のフィードバック生理学的応答でCa2+
を放出する筋小胞体の膜中のRyr2によって検出される。 この正のフィードバックは、カルシウム誘発カルシウム放出として知られており、カルシウム火花(Ca2+
火花)を生じさせる。 -30,000Ca2+
火花の空間的および時間的合計は、細胞質カルシウム濃度の細胞全体の増加を与える。 細胞膜および筋小胞体を通るカルシウムの流れに続く細胞質カルシウムの増加は、細胞内カルシウムの大部分を結合するカルシウム緩衝液によっ その結果、総カルシウムの大きな増加は、遊離Ca2+の比較的小さな上昇をもたらす
。
細胞質カルシウムはトロポニンCに結合し、トロポミオシン複合体をアクチン結合部位から移動させ、ミオシンヘッドがアクチンフィラメントに結合することを可能にする。 この時点から、収縮機構は骨格筋の場合と本質的に同じである(上記)。 簡単に言えば、ATP加水分解を使用して、ミオシンヘッドは筋節の中心に向かってアクチンフィラメントを引っ張る。

収縮期に続いて、細胞内カルシウムは、サルコ/小胞体ATPase(SERCA)ポンプによって取り込まれ、サルコ小胞体に戻って準備ができている。次のサイクルが開始されます。 カルシウムはまた、主にナトリウム-カルシウム交換体(NCX)によって細胞から排出され、より少ない程度では、原形質膜カルシウムATPaseによって放出される。 いくつかのカルシウムはまた、ミトコンドリアによって取り込まれます。 ホスホランバン(phospholamban)という酵素は、セルカのブレーキとして働く。 低心拍数では、ホスホランバンは活性であり、ATPaseの活性を遅くし、Ca2+
が細胞を完全に離れる必要がないようにする。 高い心拍数では、phospholambanはリン酸化され、不活性化され、細胞質から大部分のCa2+
を筋小胞体に戻す。 再び、カルシウム緩衝剤は、総カルシウムの大きな変化に応答して遊離Ca2+
濃度の比較的小さな減少を可能にする、Ca2+
濃度のこの秋中moderate。 低下するCa2+
濃度は、トロポニン複合体がアクチンフィラメントから解離し、それによって収縮を終了させる。 心臓は弛緩し、心室が血液で満たされ、再び心周期を開始することを可能にする。
Leave a Reply