Contraction musculaire

Chez les animaux vertébrés, il existe trois types de tissus musculaires: squelettique, lisse et cardiaque. Le muscle squelettique constitue la majorité de la masse musculaire dans le corps et est responsable de l’activité locomotrice. Le muscle lisse forme des vaisseaux sanguins, le tractus gastro-intestinal et d’autres zones du corps qui produisent des contractions soutenues. Le muscle cardiaque constitue le cœur, qui pompe le sang. Les muscles squelettiques et cardiaques sont appelés muscles striés en raison de leur apparence rayée au microscope, qui est due au motif alterné très organisé des bandes A et des bandes I.
Muscle squelettiquemodifier

À l’exclusion des réflexes, toutes les contractions des muscles squelettiques résultent d’un effort conscient provenant du cerveau. Le cerveau envoie des signaux électrochimiques à travers le système nerveux au motoneurone qui innerve plusieurs fibres musculaires. Dans le cas de certains réflexes, le signal de contraction peut provenir de la moelle épinière à travers une boucle de rétroaction avec la matière grise. D’autres actions telles que la locomotion, la respiration et la mastication ont un aspect réflexe: les contractions peuvent être initiées consciemment ou inconsciemment.
Jonction neuromusculairedit

Une jonction neuromusculaire est une synapse chimique formée par le contact entre un motoneurone et une fibre musculaire. C’est le site dans lequel un motoneurone transmet un signal à une fibre musculaire pour initier la contraction musculaire. La séquence d’événements qui entraîne la dépolarisation de la fibre musculaire au niveau de la jonction neuromusculaire commence lorsqu’un potentiel d’action est initié dans le corps cellulaire d’un motoneurone, qui se propage ensuite par conduction saltatoire le long de son axone vers la jonction neuromusculaire. Une fois qu’il atteint le bouton terminal, le potentiel d’action provoque un afflux d’ions Ca2+
dans la borne par l’intermédiaire des canaux calciques à régulation de tension. L’afflux de Ca2+
provoque la fusion de vésicules synaptiques contenant le neurotransmetteur acétylcholine avec la membrane plasmique, libérant de l’acétylcholine dans la fente synaptique entre le terminal du motoneurone et la jonction neuromusculaire de la fibre musculaire squelettique. L’acétylcholine diffuse à travers la synapse et se lie et active les récepteurs nicotiniques de l’acétylcholine sur la jonction neuromusculaire. L’activation du récepteur nicotinique ouvre son canal sodium / potassium intrinsèque, provoquant l’afflux de sodium et le ruissellement de potassium. En conséquence, le sarcolemme inverse la polarité et sa tension passe rapidement du potentiel de membrane de repos de -90mV à + 75mV lorsque le sodium entre. Le potentiel membranaire devient alors hyperpolarisé lorsque le potassium sort et est ensuite ajusté au potentiel membranaire au repos. Cette fluctuation rapide est appelée le potentiel de la plaque d’extrémité Les canaux ioniques en tension du sarcolemme à côté de la plaque d’extrémité s’ouvrent en réponse au potentiel de la plaque d’extrémité. Ils sont spécifiques au sodium et au potassium et ne permettent qu’un passage. Cette vague de mouvements ioniques crée le potentiel d’action qui se propage à partir de la plaque d’extrémité du moteur dans toutes les directions. Si les potentiels d’action cessent d’arriver, l’acétylcholine cesse d’être libérée du bouton terminal. L’acétylcholine restante dans la fente synaptique est soit dégradée par l’acétylcholine estérase active, soit réabsorbée par le bouton synaptique et il ne reste plus rien pour remplacer l’acétylcholine dégradée.
Couplage excitation-contraction
Le couplage excitation–contraction est le processus par lequel un potentiel d’action musculaire dans la fibre musculaire provoque la contraction des myofibrilles. Dans le muscle squelettique, le couplage excitation-contraction repose sur un couplage direct entre les protéines clés, le canal de libération de calcium du réticulum sarcoplasmique (SR) (identifié comme le récepteur de la ryanodine, RyR) et les canaux calciques de type L à régulation de tension (identifiés comme les récepteurs de la dihydropyridine, DHPRs). Les DHPR sont situés sur le sarcolemme (qui comprend le sarcolemme de surface et les tubules transversaux), tandis que les RYR résident à travers la membrane SR. L’apposition étroite d’un tubule transverse et de deux régions SR contenant des RYR est décrite comme une triade et est principalement l’endroit où le couplage excitation–contraction a lieu. Le couplage excitation-contraction se produit lorsque la dépolarisation de la cellule musculaire squelettique entraîne un potentiel d’action musculaire, qui se propage à la surface de la cellule et dans le réseau de tubules en T de la fibre musculaire, dépolarisant ainsi la partie interne de la fibre musculaire. La dépolarisation des parties internes active les récepteurs de la dihydropyridine dans les citernes terminales, qui sont à proximité des récepteurs de la ryanodine dans le réticulum sarcoplasmique adjacent. Les récepteurs de la dihydropyridine activés interagissent physiquement avec les récepteurs de la ryanodine pour les activer via des processus du pied (impliquant des changements conformationnels qui activent allostériquement les récepteurs de la ryanodine). Lorsque les récepteurs de la ryanodine s’ouvrent, le Ca2+
est libéré du réticulum sarcoplasmique dans l’espace jonctionnel local et diffuse dans le cytoplasme en vrac pour provoquer une étincelle de calcium. Notez que le réticulum sarcoplasmique a une grande capacité tampon de calcium en partie due à une protéine de liaison au calcium appelée calséquestrine. L’activation quasi synchrone de milliers d’étincelles de calcium par le potentiel d’action provoque une augmentation du calcium à l’échelle de la cellule, ce qui donne lieu à la course ascendante du transitoire de calcium. Le Ca2+
libéré dans le cytosol se lie à la troponine C par les filaments d’actine, pour permettre un cycle de traversée, produisant une force et, dans certaines situations, un mouvement. La calcium-ATPase du réticulum sarco/endoplasmique (SERCA) pompe activement le Ca2+
dans le réticulum sarcoplasmique. Lorsque le Ca2+
diminue pour revenir aux niveaux de repos, la force diminue et une relaxation se produit.
Théorie du filament coulissant

div>
La théorie du filament coulissant décrit un processus utilisé par les muscles pour se contracter. C’est un cycle d’événements répétitifs qui font glisser un filament mince sur un filament épais et génèrent une tension dans le muscle. Il a été développé indépendamment par Andrew Huxley et Rolf Niedergerke et par Hugh Huxley et Jean Hanson en 1954. Physiologiquement, cette contraction n’est pas uniforme à travers le sarcomère; la position centrale des filaments épais devient instable et peut se déplacer pendant la contraction. Cependant, les actions des protéines élastiques telles que la titine sont supposées maintenir une tension uniforme à travers le sarcomère et tirer le filament épais dans une position centrale.
Crossbridge cyclingEdit

Le Crossbridge cycling est une séquence d’événements moléculaires qui sous-tend la théorie des filaments glissants. Un pont-croix est une projection de myosine, composée de deux têtes de myosine, qui s’étend des filaments épais. Chaque tête de myosine a deux sites de liaison: un pour l’ATP et un autre pour l’actine. La liaison de l’ATP à une tête de myosine détache la myosine de l’actine, permettant ainsi à la myosine de se lier à une autre molécule d’actine. Une fois attaché, l’ATP est hydrolysé par la myosine, qui utilise l’énergie libérée pour se déplacer dans la « position armée », ce qui lui permet de se lier faiblement à une partie du site de liaison de l’actine. Le reste du site de liaison à l’actine est bloqué par la tropomyosine. L’ATP étant hydrolysé, la tête de myosine armée contient désormais de l’ADP+Pi. Deux ions Ca2+
se lient à la troponine C sur les filaments d’actine. Le complexe troponine-Ca2+
fait glisser la tropomyosine et débloquer le reste du site de liaison à l’actine. Le déblocage du reste des sites de liaison à l’actine permet aux deux têtes de myosine de se fermer et à la myosine de se lier fortement à l’actine. La tête de myosine libère alors le phosphate inorganique et initie une course de puissance, qui génère une force de 2 pN. La course de puissance déplace le filament d’actine vers l’intérieur, raccourcissant ainsi le sarcomère. La myosine libère alors de l’ADP mais reste toujours étroitement liée à l’actine. À la fin de la course de puissance, l’ADP est libéré de la tête de la myosine, laissant la myosine attachée à l’actine dans un état de rigueur jusqu’à ce qu’un autre ATP se lie à la myosine. Un manque d’ATP entraînerait l’état de rigueur caractéristique de rigor mortis. Une fois qu’un autre ATP se lie à la myosine, la tête de la myosine se détache à nouveau de l’actine et un autre cycle de ponts croisés se produit.
Le cycle de Crossbridge peut se poursuivre tant qu’il y a des quantités suffisantes d’ATP et de Ca2+
dans le cytoplasme. La fin du cycle de crossbridge peut se produire lorsque le Ca2+
est pompé activement dans le réticulum sarcoplasmique. Lorsque Ca2+
n’est plus présent sur le filament mince, la tropomyosine change de conformation à son état précédent de manière à bloquer à nouveau les sites de liaison. La myosine cesse de se lier au filament mince et le muscle se détend. Les ions Ca2+
quittent la molécule de troponine afin de maintenir la concentration en ions Ca2+
dans le sarcoplasme. Le pompage actif des ions Ca2+
dans le réticulum sarcoplasmique crée une carence dans le liquide autour des myofibrilles. Cela provoque l’élimination des ions Ca2 +
de la troponine. Ainsi, le complexe tropomyosine-troponine recouvre à nouveau les sites de liaison sur les filaments d’actine et la contraction cesse.
Gradation des contractionsmodifier
La force des contractions musculaires squelettiques peut être largement séparée en contraction, sommation et tétanos. Une contraction est un cycle de contraction et de relaxation unique produit par un potentiel d’action au sein de la fibre musculaire elle-même. Le temps entre un stimulus du nerf moteur et la contraction subséquente du muscle innervé est appelé la période de latence, qui prend généralement environ 10 ms et est causée par le temps nécessaire pour que le potentiel d’action nerveuse se propage, le temps de transmission chimique à la jonction neuromusculaire, puis les étapes ultérieures du couplage excitation-contraction.
Si un autre potentiel d’action musculaire devait être produit avant la relaxation complète d’une contraction musculaire, alors la contraction suivante se résumera simplement à la contraction précédente, produisant ainsi une somme. La sommation peut être réalisée de deux manières: la sommation de fréquence et la sommation de fibres multiples. En sommation de fréquence, la force exercée par le muscle squelettique est contrôlée en faisant varier la fréquence à laquelle les potentiels d’action sont envoyés aux fibres musculaires. Les potentiels d’action n’arrivent pas aux muscles de manière synchrone et, lors d’une contraction, une fraction des fibres du muscle se déclenche à un moment donné. Dans une circonstance typique, lorsque les humains exercent leurs muscles aussi durement qu’ils le peuvent consciemment, environ un tiers des fibres de chacun de ces muscles se déclencheront immédiatement, bien que ce rapport puisse être affecté par divers facteurs physiologiques et psychologiques (y compris les organes tendineux de Golgi et les cellules de Renshaw). Ce niveau de contraction « faible » est un mécanisme de protection pour empêcher l’avulsion du tendon — la force générée par une contraction de 95% de toutes les fibres est suffisante pour endommager le corps. Dans la sommation de fibres multiples, si le système nerveux central envoie un signal faible pour contracter un muscle, les unités motrices plus petites, étant plus excitables que les plus grandes, sont stimulées en premier. À mesure que la force du signal augmente, plus d’unités motrices sont excitées en plus des plus grandes, les plus grandes unités motrices ayant jusqu’à 50 fois la force contractile des plus petites. À mesure que de plus en plus d’unités motrices sont activées, la force de contraction musculaire devient progressivement plus forte. Un concept connu sous le nom de principe de la taille permet une gradation de la force musculaire lors d’une faible contraction par petites étapes, qui deviennent ensuite progressivement plus grandes lorsque de plus grandes quantités de force sont nécessaires.
Enfin, si la fréquence des potentiels d’action musculaire augmente de telle sorte que la contraction musculaire atteigne sa force maximale et ses plateaux à ce niveau, alors la contraction est un tétanos.
Relation longueur-tension

La relation longueur-tension relie la force d’une contraction isométrique à la longueur du muscle sur lequel la contraction se produit. Les muscles fonctionnent avec la plus grande tension active lorsqu’ils sont proches d’une longueur idéale (souvent leur longueur de repos). Lorsqu’elle est étirée ou raccourcie au-delà (que ce soit par l’action du muscle lui-même ou par une force extérieure), la tension active maximale générée diminue. Cette diminution est minime pour les petits écarts, mais la tension diminue rapidement à mesure que la longueur s’écarte davantage de l’idéal. En raison de la présence de protéines élastiques au sein d’une cellule musculaire (telle que la titine) et de la matrice extracellulaire, lorsque le muscle est étiré au-delà d’une longueur donnée, il existe une tension entièrement passive, qui s’oppose à l’allongement. Combinés ensemble, il existe une forte résistance à l’allongement d’un muscle actif bien au-delà du pic de tension active.
Relation Force-vélocitédit
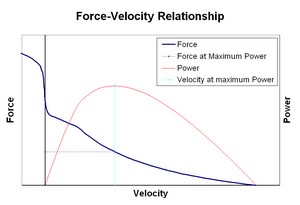
La relation force–vitesse relie la vitesse à laquelle un muscle change de longueur (généralement régulée par des forces externes, telles que la charge ou d’autres muscles) à la quantité de force qu’il génère. La force diminue de manière hyperbolique par rapport à la force isométrique à mesure que la vitesse de raccourcissement augmente, atteignant finalement zéro à une certaine vitesse maximale. L’inverse est vrai lorsque le muscle est étiré – la force augmente au-dessus du maximum isométrique, jusqu’à atteindre finalement un maximum absolu. Cette propriété intrinsèque du tissu musculaire actif joue un rôle dans l’amortissement actif des articulations qui sont actionnées par des muscles opposés simultanément actifs. Dans de tels cas, le profil force-vitesse augmente la force produite par le muscle allongeant au détriment du muscle raccourcissant. Cette faveur du muscle qui ramène l’articulation à l’équilibre augmente efficacement l’amortissement de l’articulation. De plus, la force de l’amortissement augmente avec la force musculaire. Le système moteur peut ainsi contrôler activement l’amortissement articulaire via la contraction simultanée (co-contraction) de groupes musculaires opposés.
Muscle lisse
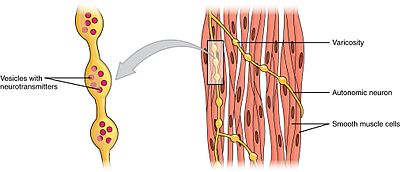
Les muscles lisses peuvent être divisés en deux sous-groupes: une unité (unitaire) et plusieurs unités. Des cellules musculaires lisses à une unité peuvent être trouvées dans l’intestin et les vaisseaux sanguins. Parce que ces cellules sont liées entre elles par des jonctions lacunaires, elles sont capables de se contracter en tant que syncytium. Les cellules musculaires lisses unitaires se contractent myogéniquement, ce qui peut être modulé par le système nerveux autonome.
Contrairement aux cellules musculaires lisses à une unité, les cellules musculaires lisses à plusieurs unités se trouvent dans le muscle de l’œil et à la base des follicules pileux. Les cellules musculaires lisses à plusieurs unités se contractent en étant stimulées séparément par les nerfs du système nerveux autonome. En tant que tels, ils permettent un contrôle fin et des réponses progressives, tout comme le recrutement d’unités motrices dans le muscle squelettique.
Mécanismes de la contraction des muscles lisses
L’activité contractile des cellules musculaires lisses est influencée par de multiples entrées telles que l’activité électrique spontanée, les entrées neurales et hormonales, les modifications locales de la composition chimique et l’étirement. Cela contraste avec l’activité contractile des cellules musculaires squelettiques, qui repose sur une seule entrée neurale. Certains types de cellules musculaires lisses sont capables de générer spontanément leurs propres potentiels d’action, qui se produisent généralement à la suite d’un potentiel de stimulateur cardiaque ou d’un potentiel d’onde lente. Ces potentiels d’action sont générés par l’afflux de Ca2+
extracellulaire, et non de Na+
. Comme les muscles squelettiques, les ions cytosoliques Ca2 +
sont également nécessaires pour le cycle de crossbridge dans les cellules musculaires lisses.
Les deux sources de Ca2+
cytosolique dans les cellules musculaires lisses sont le Ca2+
extracellulaire entrant par les canaux calciques et les ions Ca2+
qui sont libérés du réticulum sarcoplasmique. L’élévation du Ca2+
cytosolique entraîne une plus grande liaison du Ca2+
à la calmoduline, qui se lie ensuite et active la kinase à chaîne légère de la myosine. Le complexe kinase à chaîne légère calcium-calmoduline-myosine phosphoryle la myosine sur les chaînes légères de myosine de 20 kilodaltons (kDa) sur le résidu d’acide aminé – la sérine 19, initiant la contraction et activant l’ATPase de la myosine. Contrairement aux cellules musculaires squelettiques, les cellules musculaires lisses manquent de troponine, même si elles contiennent la protéine de filament mince tropomyosine et d’autres protéines notables – le caldesmon et la calponine. Ainsi, les contractions des muscles lisses sont initiées par la phosphorylation activée par le Ca2+
de la myosine plutôt que par la liaison du Ca2 +
au complexe de la troponine qui régule les sites de liaison de la myosine sur l’actine, comme dans les muscles squelettiques et cardiaques.
La fin du cycle de crossbridge (et le fait de laisser le muscle à l’état de verrouillage) se produit lorsque la phosphatase de la chaîne légère de myosine élimine les groupes phosphate des têtes de myosine. La phosphorylation des chaînes légères de myosine de 20 kDa est bien corrélée avec la vitesse de raccourcissement du muscle lisse. Pendant cette période, il y a une explosion rapide de l’utilisation de l’énergie mesurée par la consommation d’oxygène. Quelques minutes après l’initiation, le taux de calcium diminue nettement, la phosphorylation des chaînes légères de myosine de 20 kDa diminue et l’utilisation d’énergie diminue; cependant, la force dans le muscle lisse tonique est maintenue. Pendant la contraction du muscle, des ponts croisés à cycle rapide se forment entre l’actine activée et la myosine phosphorylée, générant une force. On suppose que le maintien de la force résulte de « ponts-loquets » déphosphorylés qui font un cycle lent et maintiennent la force. On pense qu’un certain nombre de kinases telles que la rho kinase, la DAPK3 et la protéine kinase C participent à la phase soutenue de contraction, et le flux de Ca2+
peut être significatif.
Neuromodulationmodifier
Bien que les contractions des muscles lisses soient myogènes, la vitesse et la force de leurs contractions peuvent être modulées par le système nerveux autonome. Les fibres nerveuses postganglionnaires du système nerveux parasympathique libèrent le neurotransmetteur acétylcholine, qui se lie aux récepteurs muscariniques de l’acétylcholine (MACHR) sur les cellules musculaires lisses. Ces récepteurs sont des récepteurs métabotropes, ou couplés à la protéine G, qui initient une deuxième cascade de messagers. Inversement, les fibres nerveuses postganglionnaires du système nerveux sympathique libèrent les neurotransmetteurs épinéphrine et noradrénaline, qui se lient aux récepteurs adrénergiques qui sont également métabotropes. Les effets exacts sur le muscle lisse dépendent des caractéristiques spécifiques du récepteur activé — l’entrée parasympathique et l’entrée sympathique peuvent être excitatrices (contractiles) ou inhibitrices (relaxantes).
Muscle cardiaquedit

Il existe deux types de cellules musculaires cardiaques: autorythmiques et contractile. Les cellules autorythmiques ne se contractent pas, mais fixent le rythme de contraction des autres cellules du muscle cardiaque, qui peuvent être modulées par le système nerveux autonome. En revanche, les cellules musculaires contractiles (cardiomyocytes) constituent la majorité du muscle cardiaque et sont capables de se contracter.
Couplage excitation-contraction
Dans le couplage excitation-contraction du muscle squelettique et cardiaque (E-C), la conduction de dépolarisation et les processus de libération de Ca2 + se produisent. Cependant, bien que les protéines impliquées soient similaires, elles sont distinctes dans leur structure et leur régulation. Les récepteurs de la dihydropyridine (DHPRs) sont codés par différents gènes et les récepteurs de la ryanodine (RYR) sont des isoformes distinctes. En outre, DHPR entre en contact avec RyR1 (isoforme principale de RyR dans le muscle squelettique) pour réguler la libération de Ca2 + dans le muscle squelettique, tandis que le canal calcique de type L (DHPR sur les myocytes cardiaques) et RyR2 (isoforme principale de RyR dans le muscle cardiaque) ne sont pas physiquement couplés dans le muscle cardiaque, mais se font face par un couplage jonctionnel.
Contrairement au muscle squelettique, on pense que le couplage E-C dans le muscle cardiaque dépend principalement d’un mécanisme appelé libération de calcium induite par le calcium, qui est basé sur la structure jonctionnelle entre le tubule T et le réticulum sarcoplasmique. La junctophiline-2 (JPH2) est essentielle pour maintenir cette structure, ainsi que l’intégrité du tubule en T. Une autre protéine, la protéine accessoire du récepteur 5 (REEP5), fonctionne pour garder la morphologie normale du SR jonctionnel. Des défauts de couplage jonctionnel peuvent résulter de déficiences de l’une ou l’autre des deux protéines. Au cours du processus de libération de calcium induite par le calcium, les RYR2 sont activés par un déclencheur de calcium, qui est provoqué par le flux de Ca2 + à travers les canaux calciques de type L. Après cela, le muscle cardiaque a tendance à présenter des structures de diades (ou dyades), plutôt que des triades.
Le couplage excitation-contraction dans les cellules du muscle cardiaque se produit lorsqu’un potentiel d’action est initié par les cellules du stimulateur cardiaque dans le nœud sino-auriculaire ou le nœud auriculo-ventriculaire et conduit à toutes les cellules du cœur via des jonctions lacunaires. Le potentiel d’action se déplace le long de la membrane de surface dans les tubules en T (ces derniers ne sont pas visibles dans tous les types de cellules cardiaques) et la dépolarisation fait entrer le Ca2 +
extracellulaire dans la cellule via des canaux calciques de type L et éventuellement un échangeur sodium-calcium (NCX) au début de la phase de plateau. Bien que cet afflux de Ca2+ ne compte que pour environ 10% du Ca2+ nécessaire à l’activation, il est relativement plus important que celui du muscle squelettique. Cet afflux de Ca2+
provoque une légère augmentation locale du Ca2+
intracellulaire. L’augmentation du Ca2+
intracellulaire est détectée par RyR2 dans la membrane du réticulum sarcoplasmique, qui libère du Ca2+
dans une réponse physiologique de rétroaction positive. Cette rétroaction positive est connue sous le nom de libération de calcium induite par le calcium et donne lieu à des étincelles de calcium (étincelles Ca2 +
). La sommation spatiale et temporelle d’environ 30 000 étincelles de Ca2+
donne une augmentation de la concentration de calcium cytoplasmique à l’échelle de la cellule. L’augmentation du calcium cytosolique suite à l’écoulement du calcium à travers la membrane cellulaire et le réticulum sarcoplasmique est modérée par des tampons de calcium, qui lient une grande partie du calcium intracellulaire. En conséquence, une augmentation importante du calcium total entraîne une augmentation relativement faible du Ca2 + libre
.
Le calcium cytoplasmique se lie à la troponine C, déplaçant le complexe de la tropomyosine hors du site de liaison de l’actine, permettant à la tête de la myosine de se lier au filament d’actine. À partir de ce moment, le mécanisme contractile est essentiellement le même que pour le muscle squelettique (ci-dessus). Brièvement, en utilisant l’hydrolyse de l’ATP, la tête de myosine tire le filament d’actine vers le centre du sarcomère.

Après la systole, le calcium intracellulaire est absorbé par la pompe sarco/réticulum ATPase endoplasmique (SERCA) retour dans le réticulum sarcoplasmique prêt pour le prochain cycle. Le calcium est également éjecté de la cellule principalement par l’échangeur sodium-calcium (NCX) et, dans une moindre mesure, une ATPase de calcium de la membrane plasmique. Une partie du calcium est également absorbée par les mitochondries. Une enzyme, le phospholamban, sert de frein au SERCA. À basse fréquence cardiaque, le phospholamban est actif et ralentit l’activité de l’ATPase de sorte que Ca2+
n’a pas à quitter complètement la cellule. À des fréquences cardiaques élevées, le phospholamban est phosphorylé et désactivé, ramenant ainsi la majeure partie du Ca2+
du cytoplasme dans le réticulum sarcoplasmique. Encore une fois, les tampons de calcium modèrent cette baisse de la concentration de Ca2+
, ce qui permet une diminution relativement faible de la concentration de Ca2 +
libre en réponse à un changement important du calcium total. La baisse de la concentration en Ca2+
permet au complexe de troponine de se dissocier du filament d’actine, mettant ainsi fin à la contraction. Le cœur se détend, permettant aux ventricules de se remplir de sang et de recommencer le cycle cardiaque.
Leave a Reply