La contrazione muscolare

l’uso di animali vertebrati, ci sono tre tipi di tessuto muscolare: scheletrico, liscio e cardiaco. Il muscolo scheletrico costituisce la maggior parte della massa muscolare nel corpo ed è responsabile dell’attività locomotoria. La muscolatura liscia forma vasi sanguigni, tratto gastrointestinale e altre aree del corpo che producono contrazioni sostenute. Il muscolo cardiaco costituisce il cuore, che pompa il sangue. I muscoli scheletrici e cardiaci sono chiamati muscoli striati a causa del loro aspetto a strisce al microscopio, che è dovuto al modello alternato altamente organizzato di bande A e bande I.
Muscolo scheletromodifica

Esclusi i riflessi, tutti i muscoli scheletrici contrazioni si verificano come risultato di uno sforzo cosciente originari del cervello. Il cervello invia segnali elettrochimici attraverso il sistema nervoso al motoneurone che innerva diverse fibre muscolari. Nel caso di alcuni riflessi, il segnale di contrarsi può avere origine nel midollo spinale attraverso un ciclo di feedback con la materia grigia. Altre azioni come la locomozione, la respirazione e la masticazione hanno un aspetto riflesso: le contrazioni possono essere avviate sia consciamente che inconsciamente.
Neuromuscolare junctionEdit

Una giunzione neuromuscolare è una sinapsi chimica formata dal contatto tra un motoneurone e una fibra muscolare. È il sito in cui un motoneurone trasmette un segnale a una fibra muscolare per avviare la contrazione muscolare. La sequenza di eventi che si traduce nella depolarizzazione della fibra muscolare alla giunzione neuromuscolare inizia quando un potenziale d’azione viene avviato nel corpo cellulare di un motoneurone, che viene poi propagato per conduzione saltatoria lungo il suo assone verso la giunzione neuromuscolare. Una volta raggiunto il bouton terminale, il potenziale d’azione provoca un afflusso di ioni Ca2+
nel terminale tramite i canali del calcio voltaggio-gated. L’afflusso di Ca2 + fa sì che le vescicole sinaptiche contenenti il neurotrasmettitore acetilcolina si fondano con la membrana plasmatica, rilasciando acetilcolina nella fessura sinaptica tra il terminale del motoneurone e la giunzione neuromuscolare della fibra muscolare scheletrica. L’acetilcolina si diffonde attraverso la sinapsi e si lega e attiva i recettori nicotinici dell’acetilcolina sulla giunzione neuromuscolare. L’attivazione del recettore nicotinico apre il suo canale intrinseco sodio / potassio, causando il sodio a precipitare e il potassio a gocciolare fuori. Di conseguenza, il sarcolemma inverte la polarità e la sua tensione salta rapidamente dal potenziale di membrana a riposo di-90mV fino a +75mV all’ingresso di sodio. Il potenziale di membrana diventa quindi iperpolarizzato quando il potassio esce e viene quindi regolato di nuovo al potenziale di membrana a riposo. Questa rapida fluttuazione è chiamata potenziale della piastra terminale I canali ionici voltaggio-dipendenti del sarcolemma vicino alla piastra terminale si aprono in risposta al potenziale della piastra terminale. Sono specifici di sodio e potassio e ne consentono solo uno. Questa ondata di movimenti ionici crea il potenziale d’azione che si diffonde dalla piastra terminale del motore in tutte le direzioni. Se i potenziali d’azione smettono di arrivare, l’acetilcolina cessa di essere rilasciata dal bouton terminale. L’acetilcolina restante nella fessura sinaptica è degradata dall’esterasi attiva dell’acetilcolina o riassorbita dalla manopola sinaptica e nessuno è lasciato per sostituire l’acetilcolina degradata.
Accoppiamento eccitazione-contrazione
L’accoppiamento eccitazione–contrazione è il processo mediante il quale un potenziale d’azione muscolare nella fibra muscolare fa contrarre le miofibrille. Nel muscolo scheletrico, l’accoppiamento eccitazione-contrazione si basa su un accoppiamento diretto tra proteine chiave, il canale di rilascio del calcio del reticolo sarcoplasmatico (SR) (identificato come recettore ryanodine, RyR) e canali del calcio di tipo L voltaggio-dipendenti (identificati come recettori diidropiridinici, DHPRs). I DHPRs si trovano sul sarcolemma (che include il sarcolemma superficiale e i tubuli trasversali), mentre i RYR risiedono attraverso la membrana SR. La stretta apposizione di un tubulo trasversale e due regioni SR contenenti RyRs è descritta come una triade ed è prevalentemente dove avviene l’accoppiamento eccitazione–contrazione. L’accoppiamento eccitazione-contrazione si verifica quando la depolarizzazione delle cellule muscolari scheletriche provoca un potenziale d’azione muscolare, che si diffonde attraverso la superficie cellulare e nella rete di T-tubuli della fibra muscolare, depolarizzando così la porzione interna della fibra muscolare. La depolarizzazione delle porzioni interne attiva i recettori diidropiridinici nelle cisterne terminali, che si trovano in prossimità dei recettori ryanodine nel reticolo sarcoplasmatico adiacente. I recettori diidropiridinici attivati interagiscono fisicamente con i recettori ryanodine per attivarli attraverso i processi del piede (che coinvolgono cambiamenti conformazionali che attivano allostericamente i recettori ryanodine). Quando i recettori ryanodine si aprono, Ca2 +
viene rilasciato dal reticolo sarcoplasmatico nello spazio giunzionale locale e si diffonde nel citoplasma di massa per causare una scintilla di calcio. Si noti che il reticolo sarcoplasmatico ha una grande capacità tampone del calcio parzialmente dovuta a una proteina legante il calcio chiamata calsequestrina. L’attivazione quasi sincrona di migliaia di scintille di calcio da parte del potenziale d’azione provoca un aumento a livello cellulare del calcio dando origine all’aumento del transitorio di calcio. Il Ca2 +
rilasciato nel citosol si lega alla troponina C dai filamenti di actina, per consentire il ciclismo crossbridge, producendo forza e, in alcune situazioni, movimento. Il sarco / reticolo endoplasmatico calcio-ATPasi (SERCA) pompa attivamente Ca2+
nel reticolo sarcoplasmatico. Come Ca2+
declina di nuovo a livelli di riposo, la forza diminuisce e si verifica il rilassamento.
Scorrevole filamento theoryEdit

Lo scorrimento filamento teoria descrive un processo utilizzato da una contrazione muscolare. È un ciclo di eventi ripetitivi che fanno scivolare un filamento sottile su un filamento spesso e generano tensione nel muscolo. È stato sviluppato indipendentemente da Andrew Huxley e Rolf Niedergerke e da Hugh Huxley e Jean Hanson nel 1954. Fisiologicamente, questa contrazione non è uniforme attraverso il sarcomero; la posizione centrale dei filamenti spessi diventa instabile e può spostarsi durante la contrazione. Tuttavia le azioni di proteine elastiche come la titina sono ipotizzate per mantenere una tensione uniforme attraverso il sarcomero e tirare il filamento spesso in una posizione centrale.
Crossbridge cyclingEdit

Crossbridge il ciclismo è una sequenza di eventi molecolari che sottende l’scorrevole filamento teoria. Un crossbridge è una proiezione di miosina, costituita da due teste di miosina, che si estende dai filamenti spessi. Ogni testa di miosina ha due siti di legame: uno per ATP e un altro per actina. Il legame dell’ATP a una testa di miosina stacca la miosina dall’actina, consentendo così alla miosina di legarsi a un’altra molecola di actina. Una volta attaccato, l’ATP viene idrolizzato dalla miosina, che utilizza l’energia rilasciata per spostarsi nella “posizione armata” in cui si lega debolmente a una parte del sito di legame dell’actina. Il resto del sito di legame dell’actina è bloccato dalla tropomiosina. Con l’ATP idrolizzato, la testa di miosina armata ora contiene ADP + Pi. Due ioni Ca2+
si legano alla troponina C sui filamenti di actina. Il complesso troponin-Ca2 +
fa scivolare la tropomiosina e sblocca il resto del sito di legame dell’actina. Lo sblocco del resto dei siti di legame dell’actina consente alle due teste di miosina di chiudersi e alla miosina di legarsi fortemente all’actina. La testa di miosina quindi rilascia il fosfato inorganico e avvia un colpo di potenza, che genera una forza di 2 pN. La corsa di potenza sposta il filamento di actina verso l’interno, accorciando così il sarcomero. La miosina quindi rilascia ADP ma rimane ancora strettamente legata all’actina. Alla fine della corsa di potenza, l’ADP viene rilasciato dalla testa della miosina, lasciando la miosina attaccata all’actina in uno stato di rigore fino a quando un altro ATP si lega alla miosina. Una mancanza di ATP comporterebbe lo stato di rigore caratteristico di rigor mortis. Una volta che un altro ATP si lega alla miosina, la testa della miosina si staccherà nuovamente dall’actina e si verificherà un altro ciclo di ponti incrociati.
Il Crossbridge cycling è in grado di continuare finché ci sono quantità sufficienti di ATP e Ca2+nel citoplasma. La cessazione del ciclo crossbridge può verificarsi quando Ca2 +
è attivamente pompato di nuovo nel reticolo sarcoplasmatico. Quando Ca2 +
non è più presente sul filamento sottile, la tropomiosina cambia conformazione al suo stato precedente in modo da bloccare nuovamente i siti di legame. La miosina cessa di legarsi al filamento sottile e il muscolo si rilassa. Gli ioni Ca2+
lasciano la molecola di troponina per mantenere la concentrazione di ioni Ca2+
nel sarcoplasma. Il pompaggio attivo di ioni Ca2+
nel reticolo sarcoplasmatico crea una carenza nel fluido intorno alle miofibrille. Ciò causa la rimozione degli ioni Ca2+
dalla troponina. Pertanto, il complesso tropomiosina-troponina copre nuovamente i siti di legame sui filamenti di actina e la contrazione cessa.
Gradazione del muscolo scheletrico contractionsEdit
La forza del muscolo scheletrico contrazioni possono essere sostanzialmente divisi in contrazione, di somma, e il tetano. Una contrazione è un singolo ciclo di contrazione e rilassamento prodotto da un potenziale d’azione all’interno della fibra muscolare stessa. Il tempo tra uno stimolo al nervo motorio e la successiva contrazione del muscolo innervato è chiamato il periodo di latenza, che di solito richiede circa 10 ms ed è causato dal tempo impiegato per il potenziale di azione del nervo per propagarsi, il tempo per la trasmissione chimica alla giunzione neuromuscolare, quindi i passaggi successivi nell’accoppiamento eccitazione-contrazione.
Se un altro potenziale d’azione muscolare dovesse essere prodotto prima del completo rilassamento di una contrazione muscolare, allora la contrazione successiva si sommerà semplicemente alla contrazione precedente, producendo così una somma. La somma può essere ottenuta in due modi: somma di frequenza e somma di fibre multiple. Nella somma di frequenza, la forza esercitata dal muscolo scheletrico è controllata variando la frequenza con cui i potenziali d’azione vengono inviati alle fibre muscolari. I potenziali d’azione non arrivano ai muscoli in modo sincrono e, durante una contrazione, una frazione delle fibre nel muscolo sparerà in un dato momento. In una circostanza tipica, quando gli esseri umani stanno esercitando i loro muscoli così duramente come sono coscientemente in grado, circa un terzo delle fibre in ciascuno di questi muscoli sparerà in una sola volta, anche se questo rapporto può essere influenzato da vari fattori fisiologici e psicologici (compresi gli organi tendinei di Golgi e le cellule di Renshaw). Questo’ basso ‘ livello di contrazione è un meccanismo protettivo per prevenire l’avulsione del tendine—la forza generata da una contrazione del 95% di tutte le fibre è sufficiente a danneggiare il corpo. Nella somma di fibre multiple, se il sistema nervoso centrale invia un segnale debole per contrarre un muscolo, le unità motorie più piccole, essendo più eccitabili di quelle più grandi, vengono stimolate per prime. Man mano che la forza del segnale aumenta, vengono eccitate più unità motorie oltre a quelle più grandi, con le unità motorie più grandi che hanno fino a 50 volte la forza contrattile di quelle più piccole. Man mano che vengono attivate unità motorie sempre più grandi, la forza della contrazione muscolare diventa progressivamente più forte. Un concetto noto come principio di dimensione, consente una gradazione della forza muscolare durante la contrazione debole che si verifica a piccoli passi, che diventano progressivamente più grandi quando sono richieste maggiori quantità di forza.
Infine, se la frequenza dei potenziali di azione muscolare aumenta in modo tale che la contrazione muscolare raggiunga la sua forza di picco e gli altipiani a questo livello, allora la contrazione è un tetano.
Rapporto lunghezza-tensionemodiFica

Lunghezza-tensione relazione si riferisce la forza di una contrazione isometrica per la lunghezza del muscolo in cui la contrazione si verifica. I muscoli operano con la massima tensione attiva quando sono vicini a una lunghezza ideale (spesso la loro lunghezza di riposo). Quando allungato o accorciato oltre questo (sia a causa dell’azione del muscolo stesso o di una forza esterna), la massima tensione attiva generata diminuisce. Questa diminuzione è minima per piccole deviazioni, ma la tensione scende rapidamente man mano che la lunghezza si discosta ulteriormente dall’ideale. A causa della presenza di proteine elastiche all’interno di una cellula muscolare (come la titina) e della matrice extracellulare, poiché il muscolo è allungato oltre una data lunghezza, c’è una tensione interamente passiva, che si oppone all’allungamento. Combinati insieme, c’è una forte resistenza all’allungamento di un muscolo attivo ben oltre il picco di tensione attiva.
Forza-velocità relationshipsEdit
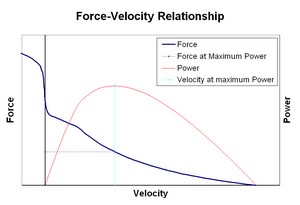
La relazione forza–velocità mette in relazione la velocità alla quale un muscolo cambia la sua lunghezza (solitamente regolata da forze esterne, come il carico o altri muscoli) con la quantità di forza che genera. La forza diminuisce in modo iperbolico rispetto alla forza isometrica all’aumentare della velocità di accorciamento, raggiungendo infine lo zero a una certa velocità massima. Il contrario vale per quando il muscolo è allungato – la forza aumenta al di sopra del massimo isometrico, fino a raggiungere finalmente un massimo assoluto. Questa proprietà intrinseca del tessuto muscolare attivo svolge un ruolo nello smorzamento attivo delle articolazioni che vengono azionate da muscoli opposti simultaneamente attivi. In questi casi, il profilo forza-velocità aumenta la forza prodotta dal muscolo allungante a scapito del muscolo accorciamento. Questo favorire di qualsiasi muscolo restituisce l’articolazione all’equilibrio aumenta efficacemente lo smorzamento dell’articolazione. Inoltre, la forza dello smorzamento aumenta con la forza muscolare. Il sistema motorio può così controllare attivamente lo smorzamento articolare attraverso la contrazione simultanea (co-contrazione) di gruppi muscolari opposti.
Smooth muscleEdit
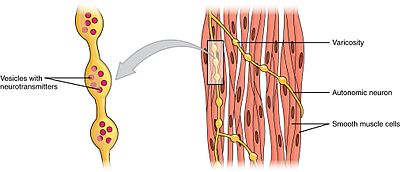
I muscoli lisci possono essere divisi in due sottogruppi: unità singola (unitaria) e multi-unità. Le cellule muscolari lisce a unità singola possono essere trovate nell’intestino e nei vasi sanguigni. Poiché queste cellule sono collegate tra loro da giunzioni gap, sono in grado di contrarsi come sincizio. Le cellule muscolari lisce a singola unità si contraggono miogenicamente, che può essere modulata dal sistema nervoso autonomo.
A differenza delle cellule muscolari lisce a unità singola, le cellule muscolari lisce a più unità si trovano nel muscolo dell’occhio e nella base dei follicoli piliferi. Le cellule muscolari lisce multi-unità si contraggono stimolando separatamente i nervi del sistema nervoso autonomo. In quanto tali, consentono un controllo fine e risposte graduali, proprio come il reclutamento di unità motorie nel muscolo scheletrico.
Meccanismi di muscolo liscio contractionEdit
L’attività contrattile delle cellule muscolari lisce è influenzato da più fattori produttivi come l’attività elettrica spontanea, nervosa e ormonale ingressi, locale cambiamenti nella composizione chimica, e di tratto. Questo è in contrasto con l’attività contrattile delle cellule muscolari scheletriche, che si basa su un singolo input neurale. Alcuni tipi di cellule muscolari lisce sono in grado di generare spontaneamente i propri potenziali di azione, che di solito si verificano a seguito di un potenziale di pacemaker o di un potenziale di onda lenta. Questi potenziali d’azione sono generati dall’afflusso di Ca2+extracellulare
e non Na+
. Come i muscoli scheletrici, gli ioni citosolici Ca2+
sono necessari anche per il ciclismo crossbridge nelle cellule muscolari lisce.
Le due fonti di Ca2+citosolico nelle cellule muscolari lisce sono il Ca2+extracellulare che entra attraverso i canali del calcio e gli ioni Ca2+che vengono rilasciati dal reticolo sarcoplasmatico. L’elevazione di Ca2 + citosolico
provoca più Ca2 +
legare a calmodulin, che poi lega ed attiva la chinasi della catena leggera della miosina. Il complesso di chinasi a catena leggera di calcio-calmodulina-miosina fosforila la miosina sulle catene leggere di miosina da 20 kilodalton (kDa) sul residuo aminoacidico-serina 19, avviando la contrazione e attivando la miosina ATPasi. A differenza delle cellule muscolari scheletriche, le cellule muscolari lisce mancano di troponina, anche se contengono la proteina del filamento sottile tropomiosina e altre proteine notevoli – caldesmon e calponina. Pertanto, le contrazioni muscolari lisce sono iniziate dalla fosforilazione Ca2 +
-attivata della miosina piuttosto che dal legame Ca2+
al complesso della troponina che regola i siti di legame della miosina sull’actina come nei muscoli scheletrici e cardiaci.
La terminazione del ciclo crossbridge (e lasciando il muscolo in stato di fermo) si verifica quando la fosfatasi a catena leggera di miosina rimuove i gruppi fosfatici dalle teste di miosina. La fosforilazione delle catene leggere della miosina di 20 kDa correla bene con la velocità di accorciamento della muscolatura liscia. Durante questo periodo, c’è una rapida esplosione di utilizzo di energia misurata dal consumo di ossigeno. Entro pochi minuti dall’inizio, il livello di calcio diminuisce notevolmente, la fosforilazione delle catene leggere della miosina da 20 kDa diminuisce e l’utilizzo di energia diminuisce; tuttavia, la forza nella muscolatura liscia tonica viene mantenuta. Durante la contrazione del muscolo, si formano rapidamente ponti incrociati tra actina attivata e miosina fosforilata, generando forza. Si ipotizza che il mantenimento della forza deriva da defosforilati “fermo-ponti” che lentamente ciclo e mantenere la forza. Si ritiene che un certo numero di chinasi come la rho chinasi, DAPK3 e la protein chinasi C partecipino alla fase di contrazione sostenuta e il flusso Ca2+
può essere significativo.
NeuromodulationEdit
Sebbene le contrazioni muscolari lisce siano miogeniche, la velocità e la forza delle loro contrazioni possono essere modulate dal sistema nervoso autonomo. Le fibre nervose postgangliari del sistema nervoso parasimpatico rilasciano il neurotrasmettitore acetilcolina, che si lega ai recettori muscarinici dell’acetilcolina (mAChRs) sulle cellule muscolari lisce. Questi recettori sono metabotropici o recettori accoppiati alla proteina G che avviano una seconda cascata di messaggeri. Viceversa, le fibre nervose postgangliari del sistema nervoso simpatico rilasciano i neurotrasmettitori adrenalina e noradrenalina, che si legano ai recettori adrenergici che sono anche metabotropici. Gli effetti esatti sulla muscolatura liscia dipendono dalle caratteristiche specifiche del recettore attivato-sia l’input parasimpatico che l’input simpatico possono essere eccitatori (contrattili) o inibitori (rilassanti).
Cardiaco muscleEdit

Ci sono due tipi di cellule del muscolo cardiaco: autorhythmic e contrattile. Le cellule autoritmiche non si contraggono, ma impostano invece il ritmo di contrazione per altre cellule del muscolo cardiaco, che possono essere modulate dal sistema nervoso autonomo. Al contrario, le cellule muscolari contrattili (cardiomiociti) costituiscono la maggior parte del muscolo cardiaco e sono in grado di contrarsi.
Accoppiamento eccitazione-contrazione
Nell’accoppiamento eccitazione-contrazione del muscolo scheletrico e cardiaco (E-C), si verificano processi di conduzione di depolarizzazione e rilascio di Ca2+. Tuttavia, sebbene le proteine coinvolte siano simili, sono distinte nella struttura e nella regolazione. I recettori diidropiridinici (DHPRs) sono codificati da diversi geni e i recettori ryanodine (RyRs) sono isoforme distinte. Inoltre, i contatti DHPR con RyR1 (isoforma RyR principale nel muscolo scheletrico) per regolare il rilascio di Ca2+ nel muscolo scheletrico, mentre il canale del calcio di tipo L (DHPR sui miociti cardiaci) e RyR2 (isoforma RyR principale nel muscolo cardiaco) non sono fisicamente accoppiati nel muscolo cardiaco, ma si affrontano l’uno con l’altro da un accoppiamento giunzionale.
A differenza del muscolo scheletrico, si pensa che l’accoppiamento E-C nel muscolo cardiaco dipenda principalmente da un meccanismo chiamato rilascio di calcio indotto dal calcio, che si basa sulla struttura giunzionale tra T-tubulo e reticolo sarcoplasmatico. Junctophilin – 2 (JPH2) è essenziale per mantenere questa struttura, così come l’integrità del T-tubulo. Un’altra proteina, proteina accessoria del ricevitore 5 (REEP5), funzioni per tenere la morfologia normale di SR giunzionale. I difetti dell’accoppiamento giunzionale possono derivare dalle carenze di una delle due proteine. Durante il processo di rilascio di calcio indotto dal calcio, i RYR2 sono attivati da un trigger di calcio, che è causato dal flusso di Ca2+ attraverso i canali del calcio di tipo L. Dopo questo, il muscolo cardiaco tende ad esibire strutture diadiche (o diadi), piuttosto che triadi.
L’accoppiamento eccitazione-contrazione nelle cellule del muscolo cardiaco si verifica quando un potenziale d’azione viene avviato dalle cellule del pacemaker nel nodo seno-atriale o nel nodo atrioventricolare e condotto a tutte le cellule del cuore tramite giunzioni gap. Il potenziale d’azione viaggia lungo la membrana superficiale in tubuli T (questi ultimi non sono visibili in tutti i tipi di cellule cardiache) e la depolarizzazione fa sì che Ca2+extracellulare entri nella cellula attraverso i canali del calcio di tipo L e possibilmente lo scambiatore sodio-calcio (NCX) durante la prima parte della fase di plateau. Anche se questo afflusso di Ca2+ conta solo per circa il 10% del Ca2+ necessario per l’attivazione, è relativamente più grande di quello del muscolo scheletrico. Questo afflusso di Ca2+
provoca un piccolo aumento locale di Ca2 + intracellulare
. L’aumento di Ca2 + intracellulare
viene rilevato da RyR2 nella membrana del reticolo sarcoplasmatico, che rilascia Ca2+
in una risposta fisiologica di feedback positivo. Questo feedback positivo è noto come rilascio di calcio indotto dal calcio e dà origine a scintille di calcio (Ca2 +
scintille). La somma spaziale e temporale di ~ 30.000 Ca2 +
scintille dà un aumento a livello cellulare nella concentrazione di calcio citoplasmatico. L’aumento del calcio citosolico in seguito al flusso di calcio attraverso la membrana cellulare e il reticolo sarcoplasmatico è moderato da tamponi di calcio, che legano una grande percentuale di calcio intracellulare. Di conseguenza, un grande aumento del calcio totale porta ad un aumento relativamente piccolo di Ca2 + libero
.
Il calcio citoplasmatico si lega alla troponina C, spostando il complesso della tropomiosina dal sito di legame dell’actina consentendo alla testa della miosina di legarsi al filamento di actina. Da questo punto in poi, il meccanismo contrattile è essenzialmente lo stesso del muscolo scheletrico (sopra). In breve, usando l’idrolisi dell’ATP, la testa della miosina tira il filamento di actina verso il centro del sarcomero.

di Seguito la sistole, calcio intracellulare è occupata dal sarco/Atpasi del reticolo endoplasmatico (SERCA) pompa di nuovo nel reticolo endoplasmatico pronto per il prossimo ciclo per iniziare. Il calcio viene anche espulso dalla cellula principalmente dallo scambiatore di sodio-calcio (NCX) e, in misura minore, da un’ATPasi di calcio a membrana plasmatica. Un certo calcio inoltre è preso dai mitocondri. Un enzima, il fosfolambano, funge da freno per SERCA. A basse frequenze cardiache, il fosfolambano è attivo e rallenta l’attività dell’ATPasi in modo che Ca2+non debba lasciare completamente la cellula. Ad alte frequenze cardiache, il fosfolambano è fosforilato e disattivato, prendendo così la maggior parte Ca2 +
dal citoplasma nel reticolo sarcoplasmatico. Ancora una volta, i tamponi di calcio moderano questo calo della concentrazione di Ca2+
, consentendo una diminuzione relativamente piccola della concentrazione di Ca2+
libera in risposta a un grande cambiamento nel calcio totale. La caduta Ca2 +
concentrazione permette il complesso troponina di dissociarsi dal filamento di actina terminando così contrazione. Il cuore si rilassa, permettendo ai ventricoli di riempirsi di sangue e ricominciare il ciclo cardiaco.
Leave a Reply