Muskelkontraktion

Bei Wirbeltieren gibt es drei Arten von Muskelgewebe: arten von Muskelgewebe: Skelett, glatt und Herz. Der Skelettmuskel macht den größten Teil der Muskelmasse im Körper aus und ist für die Bewegungsaktivität verantwortlich. Glatte Muskulatur bildet Blutgefäße, Magen-Darm-Trakt und andere Bereiche im Körper, die anhaltende Kontraktionen erzeugen. Herzmuskel bilden das Herz, das Blut pumpt. Skelett- und Herzmuskeln werden wegen ihres gestreiften Aussehens unter dem Mikroskop als gestreifte Muskeln bezeichnet, was auf das hochorganisierte alternierende Muster von A-Bändern und I-Bändern zurückzuführen ist.
Skelettmuskelbearbeiten

Ohne Reflexe treten alle Kontraktionen der Skelettmuskulatur als Folge bewusster Anstrengung auf, die vom Gehirn ausgeht. Das Gehirn sendet elektrochemische Signale durch das Nervensystem an das Motoneuron, das mehrere Muskelfasern innerviert. Bei einigen Reflexen kann das Signal zur Kontraktion über eine Rückkopplungsschleife mit der grauen Substanz im Rückenmark entstehen. Andere Aktionen wie Fortbewegung, Atmung und Kauen haben einen Reflexaspekt: Die Kontraktionen können sowohl bewusst als auch unbewusst ausgelöst werden.
Neuromuskulärer Übergang

Ein neuromuskulärer Übergang ist eine chemische Synapse, die durch den Kontakt zwischen einem Motoneuron und einer Muskelfaser gebildet wird. Es ist die Stelle, an der ein Motoneuron ein Signal an eine Muskelfaser sendet, um eine Muskelkontraktion einzuleiten. Die Abfolge von Ereignissen, die zur Depolarisation der Muskelfaser am neuromuskulären Übergang führt, beginnt, wenn im Zellkörper eines Motoneurons ein Aktionspotential initiiert wird, das sich dann durch Salzleitung entlang seines Axons in Richtung des neuromuskulären Übergangs ausbreitet. Sobald es das Terminal Bouton erreicht, verursacht das Aktionspotential einen Ca2 +
Ioneneinstrom in das Terminal über die spannungsgesteuerten Calciumkanäle. Der Ca2 +
-Zustrom bewirkt, dass synaptische Vesikel, die den Neurotransmitter Acetylcholin enthalten, mit der Plasmamembran verschmelzen und Acetylcholin in den synaptischen Spalt zwischen dem Motoneuronenterminal und dem neuromuskulären Übergang der Skelettmuskelfaser freisetzen. Acetylcholin diffundiert über die Synapse und bindet und aktiviert nikotinische Acetylcholinrezeptoren am neuromuskulären Übergang. Die Aktivierung des Nikotinrezeptors öffnet seinen intrinsischen Natrium / Kalium-Kanal, wodurch Natrium einströmt und Kalium herausrieselt. Infolgedessen kehrt das Sarkolemma die Polarität um und seine Spannung springt schnell vom Ruhemembranpotential von -90mV auf +75mV, wenn Natrium eintritt. Das Membranpotential wird dann hyperpolarisiert, wenn Kalium austritt, und wird dann wieder auf das ruhende Membranpotential eingestellt. Die spannungsgesteuerten Ionenkanäle des Sarkolemms neben der Endplatte öffnen sich als Reaktion auf das Endplattenpotential. Sie sind natrium- und kaliumspezifisch und lassen nur einen durch. Diese Welle von Ionenbewegungen erzeugt das Aktionspotential, das sich von der Motorendplatte in alle Richtungen ausbreitet. Wenn Aktionspotentiale nicht mehr ankommen, wird Acetylcholin nicht mehr aus dem terminalen Bouton freigesetzt. Das verbleibende Acetylcholin im synaptischen Spalt wird entweder durch aktive Acetylcholinesterase abgebaut oder durch den synaptischen Knopf resorbiert, und es bleibt nichts übrig, um das abgebaute Acetylcholin zu ersetzen.
Anregungs-Kontraktions–Kopplungbearbeiten
Anregungs-Kontraktions-Kopplung ist der Prozess, bei dem ein Muskelaktionspotential in der Muskelfaser bewirkt, dass sich die Myofibrillen zusammenziehen. Im Skelettmuskel beruht die Anregungs–Kontraktions-Kopplung auf einer direkten Kopplung zwischen Schlüsselproteinen, dem sarkoplasmatischen Retikulum (SR) -Calciumfreisetzungskanal (identifiziert als Ryanodinrezeptor, RyR) und spannungsgesteuerten L-Typ-Calciumkanälen (identifiziert als Dihydropyridinrezeptoren, DHPRs). DHPRs befinden sich auf dem Sarkolemma (das das Oberflächensarkolemma und die transversalen Tubuli umfasst), während sich die RyRs über der SR-Membran befinden. Die enge Apposition eines transversalen Tubulus und zweier SR-Regionen, die RyRs enthalten, wird als Triade beschrieben und ist überwiegend dort, wo eine Anregungs–Kontraktions-Kopplung stattfindet. Anregung-Kontraktion-Kopplung tritt auf, wenn die Depolarisation der Skelettmuskelzelle zu einem Muskelaktionspotential führt, das sich über die Zelloberfläche und in das Netzwerk der T-Tubuli der Muskelfaser ausbreitet, wodurch der innere Teil der Muskelfaser depolarisiert wird. Die Depolarisation der inneren Abschnitte aktiviert Dihydropyridinrezeptoren in den terminalen Zisternen, die sich in unmittelbarer Nähe zu Ryanodinrezeptoren im benachbarten sarkoplasmatischen Retikulum befinden. Die aktivierten Dihydropyridinrezeptoren interagieren physikalisch mit Ryanodinrezeptoren, um sie über Stoffwechselprozesse zu aktivieren (mit Konformationsänderungen, die die Ryanodinrezeptoren allosterisch aktivieren). Wenn sich die Ryanodinrezeptoren öffnen, wird Ca2 + aus dem sarkoplasmatischen Retikulum in den lokalen Übergangsraum freigesetzt und diffundiert in das Bulk-Zytoplasma, um einen Calciumfunken zu verursachen. Beachten Sie, dass das sarkoplasmatische Retikulum eine große Calciumpufferkapazität aufweist, die teilweise auf ein calciumbindendes Protein namens Calsequestrin zurückzuführen ist. Die nahezu synchrone Aktivierung von Tausenden von Calciumfunken durch das Aktionspotential bewirkt einen zellweiten Anstieg des Calciums, der zum Aufschlag des Calciumkanals führt. Das in das Cytosol freigesetzte Ca2 + bindet durch die Aktinfilamente an Troponin C, um ein Crossbridge-Cycling zu ermöglichen, wodurch Kraft und in einigen Situationen Bewegung erzeugt werden. Das sarko/endoplasmatische Retikulum Calcium-ATPase (SERCA) pumpt aktiv Ca2+
zurück in das sarkoplasmatische Retikulum. Wenn Ca2 +
auf das Ruheniveau zurückfällt, nimmt die Kraft ab und es kommt zu einer Entspannung.
Sliding filament theorybearbeiten

Die Sliding filament theory beschreibt einen Prozess der wird von Muskeln verwendet, um sich zusammenzuziehen. Es ist ein Zyklus sich wiederholender Ereignisse, die dazu führen, dass ein dünnes Filament über ein dickes Filament gleitet und Spannungen im Muskel erzeugt. Es wurde 1954 von Andrew Huxley und Rolf Niedergerke sowie von Hugh Huxley und Jean Hanson unabhängig entwickelt. Physiologisch ist diese Kontraktion nicht gleichmäßig über das Sarkomer; Die zentrale Position der dicken Filamente wird instabil und kann sich während der Kontraktion verschieben. Es wird jedoch angenommen, dass die Wirkung elastischer Proteine wie Titin eine gleichmäßige Spannung über das Sarkomer aufrechterhält und das dicke Filament in eine zentrale Position zieht.
Crossbridge cyclingEdit

Crossbridge cycling ist eine Abfolge molekularer Ereignisse, die der Gleitfilamenttheorie zugrunde liegt. Eine Crossbridge ist eine Myosinprojektion, bestehend aus zwei Myosinköpfen, die sich von den dicken Filamenten erstreckt. Jeder Myosinkopf hat zwei Bindungsstellen: eine für ATP und eine für Aktin. Die Bindung von ATP an einen Myosinkopf löst Myosin von Aktin, wodurch Myosin an ein anderes Aktinmolekül binden kann. Einmal befestigt, wird das ATP durch Myosin hydrolysiert, das die freigesetzte Energie verwendet, um sich in die „gespannte Position“ zu bewegen, wodurch es schwach an einen Teil der Aktinbindungsstelle bindet. Der Rest der Aktinbindungsstelle wird durch Tropomyosin blockiert. Mit dem hydrolysierten ATP enthält der gespannte Myosin-Kopf nun ADP + Pi. Zwei Ca2+
-Ionen binden an Troponin C auf den Aktinfilamenten. Der Troponin-Ca2+ -Komplex bewirkt, dass Tropomyosin übergleitet und den Rest der Aktinbindungsstelle freigibt. Durch das Entsperren der restlichen Aktinbindungsstellen können sich die beiden Myosin-Köpfe schließen und Myosin kann stark an Aktin binden. Der Myosin-Kopf gibt dann das anorganische Phosphat frei und leitet einen Krafthub ein, der eine Kraft von 2 pN erzeugt. Der Krafthub bewegt das Aktinfilament nach innen und verkürzt dadurch das Sarkomer. Myosin setzt dann ADP frei, bleibt aber immer noch fest an Aktin gebunden. Am Ende des Krafthubs wird ADP aus dem Myosin-Kopf freigesetzt, wobei Myosin in einem Rigor-Zustand an Aktin gebunden bleibt, bis ein anderes ATP an Myosin bindet. Ein Mangel an ATP würde zu dem für die Totenstarre charakteristischen Rigor-Zustand führen. Sobald ein anderes ATP an Myosin bindet, löst sich der Myosinkopf wieder vom Aktin und ein weiterer Kreuzbrückenzyklus tritt auf.
Das Crossbridge-Cycling kann fortgesetzt werden, solange ausreichende Mengen an ATP und Ca2+
im Zytoplasma vorhanden sind. Die Beendigung des Crossbridge-Cyclings kann auftreten, wenn Ca2 +
aktiv in das sarkoplasmatische Retikulum zurückgepumpt wird. Wenn Ca2 +
nicht mehr auf dem dünnen Filament vorhanden ist, ändert das Tropomyosin die Konformation zurück in seinen vorherigen Zustand, um die Bindungsstellen wieder zu blockieren. Das Myosin hört auf, an das dünne Filament zu binden, und der Muskel entspannt sich. Die Ca2+
-Ionen verlassen das Troponinmolekül, um die Ca2+
-Ionenkonzentration im Sarkoplasma aufrechtzuerhalten. Das aktive Pumpen von Ca2 +
-Ionen in das sarkoplasmatische Retikulum erzeugt einen Mangel in der Flüssigkeit um die Myofibrillen. Dies bewirkt die Entfernung von Ca2+
Ionen aus dem Troponin. Somit bedeckt der Tropomyosin-Troponin-Komplex wieder die Bindungsstellen an den Aktinfilamenten und die Kontraktion hört auf.
Abstufung der Skelettmuskelkontraktionenbearbeiten
Die Stärke der Skelettmuskelkontraktionen kann grob in Zucken, Summieren und Tetanus unterteilt werden. Ein Zucken ist ein einzelner Kontraktions- und Entspannungszyklus, der durch ein Aktionspotential innerhalb der Muskelfaser selbst erzeugt wird. Die Zeit zwischen einem Reiz an den motorischen Nerv und der anschließenden Kontraktion des innervierten Muskels wird als Latenzzeit bezeichnet, die normalerweise etwa 10 ms dauert und durch die Zeit verursacht wird, die für die Ausbreitung des Nervenaktionspotentials benötigt wird, die Zeit für die chemische Übertragung an der neuromuskulären Verbindung, dann die nachfolgenden Schritte in der Erregungs-Kontraktions-Kopplung.
Wenn vor der vollständigen Entspannung eines Muskelzuckens ein weiteres Muskelaktionspotential erzeugt werden sollte, summiert sich das nächste Zucken einfach auf das vorherige Zucken, wodurch eine Summation erzeugt wird. Summation kann auf zwei Arten erzielt werden: Frequenzsummierung und mehrfache Fasersummierung. Bei der Frequenzsummierung wird die vom Skelettmuskel ausgeübte Kraft durch Variieren der Frequenz gesteuert, mit der Aktionspotentiale an die Muskelfasern gesendet werden. Aktionspotentiale kommen nicht synchron zu den Muskeln, und während einer Kontraktion wird ein Teil der Fasern im Muskel zu einem bestimmten Zeitpunkt abgefeuert. In einem typischen Fall, wenn Menschen ihre Muskeln so hart wie möglich trainieren, feuert ungefähr ein Drittel der Fasern in jedem dieser Muskeln auf einmal, obwohl dieses Verhältnis durch verschiedene physiologische und psychologische Faktoren beeinflusst werden kann (einschließlich Golgi-Sehnenorgane und Renshaw-Zellen). Dieses niedrige Kontraktionsniveau ist ein Schutzmechanismus, um einen Abriss der Sehne zu verhindern — die Kraft, die durch eine 95% ige Kontraktion aller Fasern erzeugt wird, reicht aus, um den Körper zu schädigen. Wenn das Zentralnervensystem bei der multiplen Fasersummierung ein schwaches Signal sendet, um einen Muskel zusammenzuziehen, werden zuerst die kleineren motorischen Einheiten stimuliert, die erregbarer sind als die größeren. Wenn die Stärke des Signals zunimmt, werden zusätzlich zu größeren Motoreinheiten mehr Motoreinheiten angeregt, wobei die größten Motoreinheiten bis zu 50-mal die kontraktile Stärke aufweisen wie die kleineren. Wenn mehr und größere motorische Einheiten aktiviert werden, wird die Kraft der Muskelkontraktion zunehmend stärker. Ein Konzept, das als Größenprinzip bekannt ist, ermöglicht eine Abstufung der Muskelkraft während einer schwachen Kontraktion in kleinen Schritten, die dann progressiv größer werden, wenn größere Kraftmengen erforderlich sind.Wenn schließlich die Frequenz der Muskelaktionspotentiale so ansteigt, dass die Muskelkontraktion ihre Höchstkraft und Plateaus auf diesem Niveau erreicht, dann ist die Kontraktion ein Tetanus.
Länge-Spannung-Relationbearbeiten

Die Längen-Spannungs-Beziehung bezieht die Stärke einer isometrischen Kontraktion auf die Länge des Muskels, bei dem die Kontraktion auftritt. Muskeln arbeiten mit der größten aktiven Spannung, wenn sie sich einer idealen Länge nähern (oft ihrer Ruhelänge). Wenn darüber hinaus gedehnt oder verkürzt wird (sei es aufgrund der Wirkung des Muskels selbst oder durch eine äußere Kraft), nimmt die maximal erzeugte aktive Spannung ab. Diese Abnahme ist für kleine Abweichungen minimal, aber die Spannung fällt schnell ab, wenn die Länge weiter vom Ideal abweicht. Aufgrund des Vorhandenseins elastischer Proteine in einer Muskelzelle (wie Titin) und der extrazellulären Matrix kommt es bei einer Dehnung des Muskels über eine bestimmte Länge hinaus zu einer völlig passiven Spannung, die einer Verlängerung entgegenwirkt. In Kombination besteht ein starker Widerstand gegen die Verlängerung eines aktiven Muskels weit über den Höhepunkt der aktiven Spannung hinaus.
Kraft-Geschwindigkeits–Beziehungbearbeiten
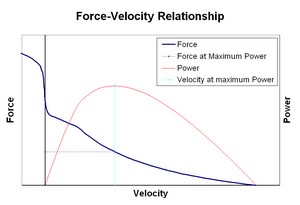
Die Kraft–Geschwindigkeits-Beziehung bezieht die Geschwindigkeit, mit der ein Muskel seine Länge ändert (normalerweise reguliert durch äußere Kräfte wie Last oder andere Muskeln), auf die Kraft, die er erzeugt. Die Kraft nimmt relativ zur isometrischen Kraft hyperbolisch ab, wenn die Verkürzungsgeschwindigkeit zunimmt, und erreicht schließlich bei einer maximalen Geschwindigkeit Null. Das Gegenteil gilt, wenn der Muskel gedehnt wird – die Kraft steigt über das isometrische Maximum hinaus, bis schließlich ein absolutes Maximum erreicht wird. Diese intrinsische Eigenschaft des aktiven Muskelgewebes spielt eine Rolle bei der aktiven Dämpfung von Gelenken, die von gleichzeitig aktiven gegenüberliegenden Muskeln betätigt werden. In solchen Fällen verstärkt das Kraft-Geschwindigkeits-Profil die vom Verlängerungsmuskel erzeugte Kraft auf Kosten des Verkürzungsmuskels. Diese Begünstigung des Muskels, der das Gelenk wieder ins Gleichgewicht bringt, erhöht effektiv die Dämpfung des Gelenks. Darüber hinaus nimmt die Stärke der Dämpfung mit der Muskelkraft zu. Das motorische System kann somit die Gelenkdämpfung über die gleichzeitige Kontraktion (Co-Kontraktion) gegenüberliegender Muskelgruppen aktiv steuern.
Glatte Muskulatur
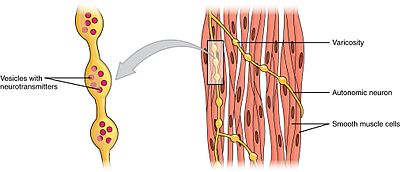
Glatte Muskeln können in zwei Untergruppen unterteilt werden: Single-Unit (unitär) und Multi-Unit. Einzelne glatte Muskelzellen können im Darm und in den Blutgefäßen gefunden werden. Da diese Zellen durch Gap Junctions miteinander verbunden sind, können sie sich als Syncytium zusammenziehen. Einzelne glatte Muskelzellen kontrahieren myogen, was vom autonomen Nervensystem moduliert werden kann.
Im Gegensatz zu glatten Muskelzellen mit einer Einheit befinden sich glatte Muskelzellen mit mehreren Einheiten im Muskel des Auges und in der Basis der Haarfollikel. Glatte Muskelzellen mit mehreren Einheiten ziehen sich zusammen, indem sie getrennt von Nerven des autonomen Nervensystems stimuliert werden. Als solche ermöglichen sie eine feine Kontrolle und allmähliche Reaktionen, ähnlich wie die Rekrutierung motorischer Einheiten im Skelettmuskel.
Mechanismen der glatten Muskelkontraktionbearbeiten
Die kontraktile Aktivität glatter Muskelzellen wird durch mehrere Eingaben wie spontane elektrische Aktivität, neuronale und hormonelle Eingaben, lokale Änderungen der chemischen Zusammensetzung und Dehnung beeinflusst. Dies steht im Gegensatz zur kontraktilen Aktivität von Skelettmuskelzellen, die auf einem einzigen neuronalen Eingang beruht. Einige Arten glatte Muskelzellen sind in der Lage, ihre eigenen Aktionspotentiale spontan zu erzeugen, die normalerweise nach einem Schrittmacherpotential oder einem langsamen Wellenpotential auftreten. Diese Aktionspotentiale werden durch den Zustrom von extrazellulärem Ca2+
und nicht von Na+
erzeugt. Wie Skelettmuskeln werden auch cytosolische Ca2 + -Ionen für das Crossbridge-Cycling in glatten Muskelzellen benötigt.
Die beiden Quellen für cytosolisches Ca2+
in glatten Muskelzellen sind das extrazelluläre Ca2+
, das durch Calciumkanäle eintritt, und die Ca2+
-Ionen, die aus dem sarkoplasmatischen Retikulum freigesetzt werden. Die Erhöhung des cytosolischen Ca2 +
führt zu einer stärkeren Bindung von Ca2 +
an Calmodulin, das dann die Myosin-Leichtkettenkinase bindet und aktiviert. Der Calcium-Calmodulin-Myosin-Leichtkettenkinase-Komplex phosphoryliert Myosin an den 20 Kilodalton (kDa) Myosin-Leichtketten am Aminosäurerest-Serin 19, initiiert die Kontraktion und aktiviert die Myosin-ATPase. Im Gegensatz zu Skelettmuskelzellen fehlt glatten Muskelzellen Troponin, obwohl sie das dünne Filamentprotein Tropomyosin und andere bemerkenswerte Proteine enthalten – Caldesmon und Calponin. Somit werden Kontraktionen der glatten Muskulatur durch die Ca2 +
-aktivierte Phosphorylierung von Myosin initiiert, anstatt dass Ca2 +
an den Troponinkomplex bindet, der Myosin-Bindungsstellen auf Aktin wie in Skelett- und Herzmuskeln reguliert.
Die Beendigung des Crossbridge-Cyclings (und das Verlassen des Muskels im Latch-Zustand) tritt auf, wenn die Myosin-Leichtkettenphosphatase die Phosphatgruppen aus den Myosin-Köpfen entfernt. Die Phosphorylierung der leichten 20-kDa-Myosin-Ketten korreliert gut mit der Verkürzungsgeschwindigkeit der glatten Muskulatur. Während dieser Zeit gibt es einen schnellen Ausbruch der Energienutzung, gemessen am Sauerstoffverbrauch. Innerhalb weniger Minuten nach der Initiierung nimmt der Calciumspiegel deutlich ab, die Phosphorylierung der 20-kDa-Myosin-Leichtketten nimmt ab und die Energienutzung nimmt ab; Die Kraft in der tonischen glatten Muskulatur bleibt jedoch erhalten. Während der Kontraktion des Muskels bilden sich schnell radfahrende Kreuzbrücken zwischen aktiviertem Aktin und phosphoryliertem Myosin, die Kraft erzeugen. Es wird angenommen, dass die Aufrechterhaltung der Kraft von dephosphorylierten „Riegelbrücken“ herrührt, die langsam zyklisch wirken und die Kraft aufrechterhalten. Es wird angenommen, dass eine Reihe von Kinasen wie Rho-Kinase, DAPK3 und Proteinkinase C an der anhaltenden Phase der Kontraktion teilnehmen, und der Ca2 + -Fluss kann signifikant sein.
neuromodulationbearbeiten
Obwohl Kontraktionen der glatten Muskulatur myogen sind, können die Geschwindigkeit und Stärke ihrer Kontraktionen vom autonomen Nervensystem moduliert werden. Postganglionäre Nervenfasern des parasympathischen Nervensystems setzen den Neurotransmitter Acetylcholin frei, der an muskarinische Acetylcholinrezeptoren (mAChRs) an glatten Muskelzellen bindet. Diese Rezeptoren sind metabotrope oder G-Protein-gekoppelte Rezeptoren, die eine zweite Botenstoffkaskade initiieren. Umgekehrt setzen postganglionäre Nervenfasern des sympathischen Nervensystems die Neurotransmitter Adrenalin und Noradrenalin frei, die an adrenerge Rezeptoren binden, die ebenfalls metabotrop sind. Die genauen Auswirkungen auf die glatte Muskulatur hängen von den spezifischen Eigenschaften des aktivierten Rezeptors ab — sowohl der parasympathische als auch der sympathische Eingang können entweder exzitatorisch (kontraktil) oder inhibitorisch (entspannend) sein.
Herzmuskelbearbeiten

Es gibt zwei Arten von Herzmuskelzellen: autorhythmisch und kontraktil. Autorhythmische Zellen ziehen sich nicht zusammen, sondern bestimmen das Kontraktionstempo für andere Herzmuskelzellen, die vom autonomen Nervensystem moduliert werden können. Im Gegensatz dazu bilden kontraktile Muskelzellen (Kardiomyozyten) den Großteil des Herzmuskels und können sich zusammenziehen.
Anregungs-Kontraktions-Kopplungbearbeiten
Sowohl in der Skelett- als auch in der Herzmuskel-Anregungs-Kontraktions-Kopplung (E-C) treten Depolarisationsleitung und Ca2 + -Freisetzungsprozesse auf. Obwohl die beteiligten Proteine ähnlich sind, unterscheiden sie sich in Struktur und Regulation. Die Dihydropyridinrezeptoren (DHPRs) werden von verschiedenen Genen kodiert, und die Ryanodinrezeptoren (RyRs) sind unterschiedliche Isoformen. Außerdem kontaktiert DHPR RyR1 (Haupt-RyR-Isoform im Skelettmuskel), um die Ca2 + -Freisetzung im Skelettmuskel zu regulieren, während der L-Typ-Calciumkanal (DHPR auf Herzmyozyten) und RyR2 (Haupt-RyR-Isoform im Herzmuskel) sind im Herzmuskel nicht physikalisch gekoppelt, sondern stehen sich durch eine Übergangskupplung gegenüber.Im Gegensatz zum Skelettmuskel wird angenommen, dass die E-C-Kopplung im Herzmuskel hauptsächlich von einem Mechanismus abhängt, der als Calcium-induzierte Calciumfreisetzung bezeichnet wird und auf der Verbindungsstruktur zwischen T-Tubulus und sarkoplasmatischem Retikulum basiert. Junctophilin-2 (JPH2) ist wichtig, um diese Struktur sowie die Integrität des T-Tubulus aufrechtzuerhalten. Ein anderes Protein, Rezeptor-Zubehör-Protein 5 (REEP5), Funktionen, um die normale Morphologie der Junctional Kopplung zu halten. Defekte der junctional Kopplung können aus Mängeln der beiden Proteine führen. Während des Prozesses der calciuminduzierten Calciumfreisetzung werden RyR2s durch einen Calciumtrigger aktiviert, der durch den Fluss von Ca2 + durch die Calciumkanäle vom L-Typ hervorgerufen wird. Danach neigt der Herzmuskel eher zu Diaden- (oder Dyaden-) Strukturen als zu Triaden.Die Anregungs-Kontraktions-Kopplung in Herzmuskelzellen tritt auf, wenn ein Aktionspotential von Schrittmacherzellen im Sinusknoten oder Atrioventrikularknoten initiiert und über Gap Junctions zu allen Zellen im Herzen geleitet wird. Das Aktionspotential wandert entlang der Oberflächenmembran in T-Tubuli (letztere sind nicht in allen Herzzelltypen zu sehen) und die Depolarisation bewirkt, dass extrazelluläres Ca2 +
während des frühen Teils der Plateauphase über L-Typ-Calciumkanäle und möglicherweise Natrium-Calcium-Austauscher (NCX) in die Zelle gelangt. Obwohl dieser Ca2 + -Zustrom nur etwa 10% des für die Aktivierung benötigten Ca2 + ausmacht, ist er relativ größer als der des Skelettmuskels. Dieser Ca2+
-Zustrom verursacht einen kleinen lokalen Anstieg des intrazellulären Ca2+
. Der Anstieg von intrazellulärem Ca2 +
wird durch RyR2 in der Membran des sarkoplasmatischen Retikulums nachgewiesen, das Ca2 +
in einer positiven physiologischen Rückkopplungsreaktion freisetzt. Diese positive Rückkopplung wird als kalziuminduzierte Kalziumfreisetzung bezeichnet und führt zu Kalziumfunken (Ca2 +
Funken). Die räumliche und zeitliche Summierung von ~ 30.000 Ca2 +
Funken ergibt einen zellweiten Anstieg der zytoplasmatischen Calciumkonzentration. Der Anstieg des cytosolischen Calciums nach dem Calciumfluss durch die Zellmembran und das sarkoplasmatische Retikulum wird durch Calciumpuffer moderiert, die einen großen Teil des intrazellulären Calciums binden. Infolgedessen führt ein starker Anstieg des Gesamtcalciums zu einem relativ geringen Anstieg des freien Ca2+
.
Das zytoplasmatische Calcium bindet an Troponin C und verschiebt den Tropomyosin-Komplex von der Aktin-Bindungsstelle, so dass der Myosin-Kopf an das Aktin-Filament binden kann. Ab diesem Zeitpunkt ist der Kontraktionsmechanismus im Wesentlichen derselbe wie für den Skelettmuskel (oben). Kurz gesagt, unter Verwendung der ATP-Hydrolyse zieht der Myosin-Kopf das Aktin-Filament in Richtung Zentrum des Sarkomers.

Nach der Systole wird intrazelluläres Kalzium von der sarko / endoplasmatischen Retikulum-ATPase (SERCA)-Pumpe zurück in das sarkoplasmatische Retikulum aufgenommen. damit der nächste Zyklus beginnt. Calcium wird auch hauptsächlich durch den Natrium-Calcium-Austauscher (NCX) und in geringerem Maße durch eine Plasmamembran-Calcium-ATPase aus der Zelle ausgestoßen. Etwas Kalzium wird auch von den Mitochondrien aufgenommen. Ein Enzym, Phospholamban, dient als Bremse für SERCA. Bei niedrigen Herzfrequenzen ist Phospholamban aktiv und verlangsamt die Aktivität der ATPase, so dass Ca2+
die Zelle nicht vollständig verlassen muss. Bei hohen Herzfrequenzen wird Phospholamban phosphoryliert und deaktiviert, wodurch das meiste Ca2+
aus dem Zytoplasma zurück in das sarkoplasmatische Retikulum gelangt. Wiederum moderieren Calciumpuffer diesen Rückgang der Ca2 +
-Konzentration und ermöglichen eine relativ geringe Abnahme der freien Ca2 +
-Konzentration als Reaktion auf eine große Änderung des Gesamtcalciums. Die fallende Ca2 +
-Konzentration ermöglicht es dem Troponinkomplex, sich vom Aktinfilament zu dissoziieren, wodurch die Kontraktion beendet wird. Das Herz entspannt sich, so dass sich die Ventrikel mit Blut füllen und der Herzzyklus erneut beginnen kann.
Leave a Reply