15.3: karboksyylihappojen fysikaaliset ominaisuudet
oppimistavoitteet
- vertaa karboksyylihappojen kiehumispisteitä samankaltaisen moolimassan alkoholeihin.
- vertaa karboksyylihappojen liukoisuutta veteen vastaavien alkaanien ja alkoholien liukoisuuksiin vedessä.
monet karboksyylihapot ovat värittömiä nesteitä, joilla on epämiellyttävä haju. Karboksyylihapoilla, joissa on 5-10 hiiliatomia, on kaikilla ”goaty” – haju (selittäen Limburgerjuuston hajun). Näitä happoja tuottaa myös ihobakteerien vaikutus ihmisen Taliin (ihoöljyihin), mikä selittää huonosti tuuletettujen pukuhuoneiden hajun. Hapot, joissa on yli 10 hiiliatomia, ovat vahamaisia kiinteitä aineita, ja niiden haju vähenee, kun moolimassa kasvaa ja haihtuvuus vähenee.
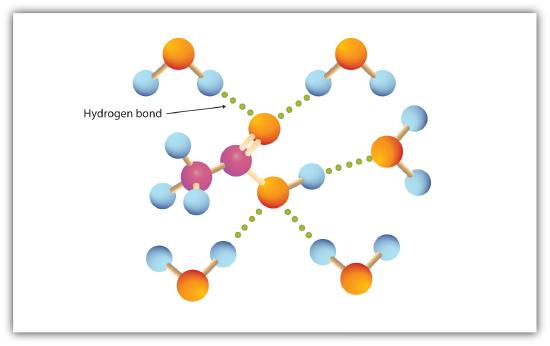
Karboksyylihapoissa esiintyy voimakasta vetysidosta molekyylien välillä. Siksi niillä on korkeat kiehumispisteet verrattuna muihin vastaavanlaisen moolimassan aineisiin.
karboksyyliryhmä sitoutuu helposti vetysidokseen vesimolekyylien kanssa (kuva \(\PageIndex{1}\)). Hapot, joissa on yhdestä neljään hiiliatomia, sekoittuvat täysin veteen. Liukoisuus vähenee hiiliketjun pituuden kasvaessa, koska dipolivoimien merkitys vähenee ja dispersiovoimat tulevat hallitsevammiksi. Heksaanihappo liukenee niukasti veteen (noin 1,0 g/100 g vettä). Palmitiinihappo, jossa on suuri ei-polaarinen hiilivetykomponentti, on olennaisesti veteen liukenematonta. Karboksyylihapot liukenevat yleensä sellaisiin orgaanisiin liuottimiin kuin etanoliin, tolueeniin ja dietyylieetteriin.
taulukossa 15.4.1 luetellaan joitakin fysikaalisia ominaisuuksia tietyille karboksyylihapoille. Kuusi ensimmäistä ovat homologeja. Huomaa, että kiehumispisteet kasvavat moolimassan kasvaessa, mutta sulamispisteissä ei näy säännöllistä kaavaa.
| Condensed Structural Formula | Name of Acid | Melting Point (°C) | Boiling Point (°C) | Solubility (g/100 g of Water) |
|---|---|---|---|---|
| HCOOH | formic acid | 8 | 100 | miscible |
| CH3COOH | acetic acid | 17 | 118 | miscible |
| CH3CH2COOH | propionic acid | –22 | 141 | miscible |
| CH3(CH2)2COOH | butyric acid | –5 | 163 | miscible |
| CH3(CH2)3COOH | valeric acid | –35 | 187 | 5 |
| CH3(CH2)4COOH | caproic acid | –3 | 205 | 1.1 |
| C6H5COOH | benzoic acid | 122 | 249 | 0.29 |
Concept Review Exercises
- Which compound has the higher boiling point—butanoic acid (molar mass 88) or 2-pentanone (molar mass 86)? Explain.
- Would you expect butyric acid (butanoic acid) to be more or less soluble than 1-butanol in water? Explain.
vastaa
- voihappo vetysidoksen vuoksi (2-pentanonissa ei ole molekyylien välistä vetysidosta.)
- li on liukoisempi, koska on laajempi vetysidos
Key Takeaways
- Karboksyylihapoilla on korkea kiehumispiste verrattuna muihin saman moolimassan omaaviin aineisiin. Kiehumispisteet kasvavat moolimassan myötä.
- karboksyylihapot, joissa on yhdestä neljään hiiliatomia, sekoittuvat täysin veteen. Liukoisuus vähenee moolimassan myötä.
harjoitukset
-
kummalla yhdisteellä on korkeampi kiehumispiste—CH3CH2CH2OCH2CH3 vai CH3CH2CH2COOH? Selittää.
-
kummalla yhdisteellä on korkeampi kiehumispiste—CH3CH2CH2CH2OH vai CH3CH2CH2COOH? Selittää.
-
kumpi yhdiste liukenee paremmin veteen—CH3COOH vai CH3CH2CH2CH3? Selittää.
-
kumpi yhdiste liukenee paremmin veteen—ch3ch2cooh vai CH3CH2CH2CH2COOH? Selittää.
vastaa
-
CH3CH2CH2COOH vetysidoksen vuoksi (ei ole olemassa intermolekulaarista vetysidosta CH3CH2CH2CH3: n kanssa.)
CH3COOH, koska se sitoutuu vetysidokseen veden kanssa (ei ole molekyylien välistä vetysidosta CH3CH2CH2CH3: n kanssa.)
Leave a Reply