15.3: karbonsavak fizikai tulajdonságai
tanulási célok
- hasonlítsa össze a karbonsavak forráspontjait hasonló móltömegű alkoholokkal.
- hasonlítsa össze a vízben lévő karbonsavak oldhatóságát a vízben lévő hasonló alkánok és alkoholok oldhatóságával.
sok karbonsav színtelen, kellemetlen szagú folyadék. Az 5-10 szénatomú karbonsavak mindegyike “goaty” szagokkal rendelkezik (magyarázva a Limburger sajt szagát). Ezeket a savakat a bőrbaktériumok emberi faggyú (bőrolajok) hatására is előállítják, ami a rosszul szellőző öltözők szagát jelenti. A több mint 10 szénatomot tartalmazó savak viaszszerű szilárd anyagok, szaguk a moláris tömeg növekedésével csökken, és ennek következtében csökken a volatilitás.
a karbonsavak erős hidrogénkötést mutatnak a molekulák között. Ezért magas forráspontjuk van más hasonló moláris tömegű anyagokhoz képest.
a karboxilcsoport hidrogénkötést végez vízmolekulákkal (\(\PageIndex{1}\) ábra). Az egy-négy szénatommal rendelkező savak teljesen összekeverhetők vízzel. Az oldhatóság csökken, mivel a szénlánc hossza növekszik, mivel a dipólerők kevésbé fontosak, és a diszperziós erők dominánsabbá válnak. A hexánsav alig oldódik vízben (körülbelül 1,0 g/100 g víz). A palmitinsav nagy, nem poláris szénhidrogén komponensével lényegében vízben oldhatatlan. A karbonsavak általában olyan szerves oldószerekben oldódnak, mint az etanol, a toluol és a dietil-éter.
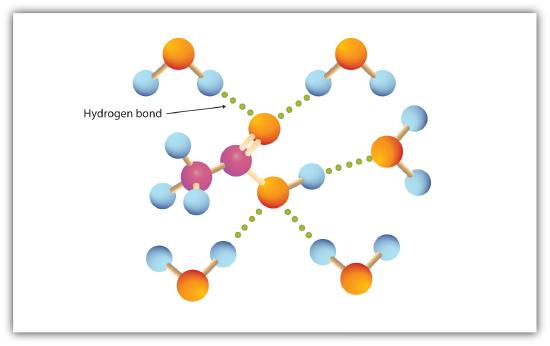
a 15.4.1.táblázat felsorolja a kiválasztott karbonsavak fizikai tulajdonságait. Az első hat homológ. Figyeljük meg, hogy a forráspontok növekvő moláris tömeggel nőnek, de az olvadáspontok nem mutatnak rendszeres mintát.
| Condensed Structural Formula | Name of Acid | Melting Point (°C) | Boiling Point (°C) | Solubility (g/100 g of Water) |
|---|---|---|---|---|
| HCOOH | formic acid | 8 | 100 | miscible |
| CH3COOH | acetic acid | 17 | 118 | miscible |
| CH3CH2COOH | propionic acid | –22 | 141 | miscible |
| CH3(CH2)2COOH | butyric acid | –5 | 163 | miscible |
| CH3(CH2)3COOH | valeric acid | –35 | 187 | 5 |
| CH3(CH2)4COOH | caproic acid | –3 | 205 | 1.1 |
| C6H5COOH | benzoic acid | 122 | 249 | 0.29 |
Concept Review Exercises
- Which compound has the higher boiling point—butanoic acid (molar mass 88) or 2-pentanone (molar mass 86)? Explain.
- Would you expect butyric acid (butanoic acid) to be more or less soluble than 1-butanol in water? Explain.
- vajsav a hidrogénkötés miatt (2-pentanonban nincs intermolekuláris hidrogénkötés.)
- jobban oldható, mert ott kiterjedtebb, hidrogén kötés
Gombot Átvétel
- Karbonsavak magas forró pontok, mint más anyagok a hasonló moláris tömeg. A forráspontok moláris tömeggel nőnek.
- az egy-négy szénatomot tartalmazó karbonsavak vízzel teljesen elegyednek. Az oldhatóság moláris tömeggel csökken.
-
melyik vegyületnek van magasabb forráspontja-CH3CH2CH2CH2CH3 vagy CH3CH2CH2COOH? Magyarázd meg.
-
melyik vegyületnek van magasabb forráspontja-CH3CH2CH2CH2CH2OH vagy CH3CH2CH2COOH? Magyarázd meg.
-
melyik vegyület jobban oldódik vízben-CH3COOH vagy CH3CH2CH2CH3? Magyarázd meg.
-
melyik vegyület jobban oldódik vízben—CH3CH2COOH vagy CH3CH2CH2CH2CH2COOH? Magyarázd meg.
válaszok
-
CH3CH2CH2COOH a hidrogénkötés miatt (nincs intermolekuláris hidrogénkötés CH3CH2CH2CH3-mal.)
-
CH3COOH mivel hidrogénkötést folytat vízzel (nincs intermolekuláris hidrogénkötés CH3CH2CH2CH3-mal.)
Leave a Reply