근육의 수축

척추 동물의 세 가지 유형이 있습니다 근육 조직:골격,부드러운,그리고 심장. 골격근은 신체의 근육 질량의 대부분을 구성하며 운동 활동을 담당합니다. 평활근은 혈관,위장관 및 지속적인 수축을 일으키는 신체의 다른 부위를 형성합니다. 심장 근육은 혈액을 펌핑하는 심장을 구성합니다. 골격과 심장 근육이라는 전기 때문에 근육의 스트라이프 외관을 현미경으로 인해 높은 조직된 교 패턴의 밴드와 나는 밴드입니다.
골격 muscleEdit

제외 반사,모든 뼈와 근육의 수축의 결과로 발생할 의식적인 노력에서 발생하는 뇌입니다. 뇌는 신경계를 통해 전기 화학 신호를 여러 근육 섬유에 신경이 쓰이는 운동 신경 세포로 보냅니다. 의 경우에는 일부 반사 신호가 계약에 발생 할 수 있습 척수를 통해 피드백 루프를 가진 회색 문제입니다. 같은 다른 작업을 운동,호흡,그리고 씹는 반사 측면 그들의 수축을 시작할 수 있습니다 모두 의식적으로나 무의식적으로.
Neuromuscular junctionEdit

신경근 접합은 운동 뉴런과 근육 섬유 사이의 접촉에 의해 형성된 화학적 시냅스입니다. 그것은 운동 뉴런이 근육 섬유에 신호를 전송하여 근육 수축을 시작하는 부위입니다. 이벤트 시퀀스에서 결과의 도발은 근육 섬유 at the neuromuscular junction 때 시작된 조치는 잠재적에서 시작된 세포체의 운동신경세포,다음에 의해 전파 saltatory 전도와 함께 그것의 축삭으로 neuromuscular junction. 그것은 터미널에 도착한 bouton,액션이 잠재적인 원인 Ca2+
이온 유입으로 터미널의 방법으로 전압 개폐 칼슘 채널이 있습니다. Ca2+
유입이 발생 synaptic vesicles 포함하는 신경 전달 물질의 아세틸콜린이 융합하는 플라즈마 막으로 해제,아세틸콜린으로 시냅 사 motor neuron 터미널 및 neuromuscular junction 의 골격근 섬유입니다. 아세틸 콜린은 시냅스를 가로 질러 확산되어 신경근 접합부의 니코틴 성 아세틸 콜린 수용체에 결합하고 활성화시킵니다. 의 활성화 니코틴 수용체가 본질적인 나트륨/칼륨 채널을 일으키는 나트륨을 러시와 칼륨을 밖. 결과적으로,sarcolemma 는 극성을 역전시키고 그 전압은-90mV 의 휴식 막 전위에서 나트륨이 유입됨에 따라+75mV 만큼 높게 빠르게 점프합니다. 그런 다음 막 전위는 칼륨이 빠져 나올 때 과분극 상태가되어 휴식 막 전위로 다시 조정됩니다. 이 급격한 변동이라고 결국-판 잠재력의 전압 개폐의 이온 채널 sarcolemma 에 다음을 끝판에서 열린 응답을 끝판 잠재력입니다. 그들은 나트륨과 칼륨 특정이며 오직 하나를 통해 허용합니다. 이 이온 운동의 물결은 모터 엔드 플레이트에서 모든 방향으로 퍼지는 작용 잠재력을 만듭니다. 활동 전위가 도착을 멈 추면 아세틸 콜린은 말단 부톤에서 방출되는 것을 중단합니다. 나머지에 있는 아세틸콜린 시냅스가 중 하나에 의해 분해 활성 아세틸콜린 esterase 또는 재 흡수에 의하여 시냅스 노브고도 남을 대체하이 저하되는 아세틸콜린.
여기 수축 couplingEdit
Excitation–contraction coupling 프로세스는 근육질의 작업에서 잠재적인 근섬유의 원인 근원을 계약합니다. 에서 골격근,excitation–contraction coupling 에 의존하고 직접적인 연결이 키 단백질,sarcoplasmic 그물(SR)칼슘 릴리스 채널(으로 확인 ryanodine receptor,RyR)및 전압 개폐 L-type calcium channels(으로 식별 수용 체 dihydropyridine,DHPRs). DHPRs 는 sarcolemma(표면 sarcolemma 및 횡단 세뇨관을 포함)에 위치하는 반면,RyRs 는 SR 막을 가로 질러 상주합니다. Close apposition 의 가로 세관 및 두 SR 포함하는 영역 RyRs 설명으로 인조은 주로 어디로 여기 수축 결합이 일어난다. Excitation–contraction coupling 할 때 발생하는 감극의 골격근 세포에서 결과 잠재적인 근육 활동,에 퍼져있는 세포 표면 근육으로 섬유의 네트워크의 T-세관,그로 인하여 줄어들면서의 안쪽 부분은 근육 섬유입니다. 내부 부분의 탈분극은 인접한 사르코 플라스마 망상에있는 리아 노딘 수용체에 근접한 말단 시스 테르 나에서 디 하이드로 피리딘 수용체를 활성화시킨다. 의 활성화 수용 체 dihydropyridine 물리적으로 상호 작용 ryanodine receptors 활성화를 통해 그들발 프로세스(포함한 구조적 변경 내용 allosterically 활성화 ryanodine receptors). 로 ryanodine receptors 오픈,Ca2+
출시에서 sarcoplasmic 그물로 지역 접합 공간으로 확산이 대량으로 세포질 일으킬 칼슘 불꽃이 있습니다. 참고 sarcoplasmic 그물에는 큰 칼슘 버퍼링이 능력에 부분적으로는 칼슘-인 단백질이라는 calsequestrin. 가까운 동기 인증의 수천의 칼슘 불꽃 조치에 의해 잠재적인 원인 셀-넓은 증가하는 칼슘 상승을주는 상승 운동의 칼슘은 일시적이다. Cytosol 로 방출 된 Ca2+
은 액틴 필라멘트에 의해 트로포 닌 C 에 결합하여 크로스 브리지 사이클링,힘 생성 및 일부 상황에서는 운동을 허용합니다. Sarco/endoplasmic reticulum calcium-ATPase(SERCA)는 Ca2+
을 다시 sarcoplasmic reticulum 으로 적극적으로 펌핑합니다. Ca2+
이 휴식 수준으로 다시 감소함에 따라 힘이 감소하고 이완이 발생합니다.
필라멘트 슬라이딩 theoryEdit

필라멘트 슬라이딩 이론을 설명하는 데 사용하는 프로세스에 의해 근육을 계약합니다. 그것은 얇은 필라멘트가 두꺼운 필라멘트 위로 미끄러 져 근육에 긴장을 발생시키는 반복적 인 사건의주기입니다. 1954 년 Andrew Huxley 와 Rolf Niedergerke 와 hugh Huxley 와 Jean Hanson 이 독립적으로 개발했습니다. 생리적으로 이 수축하지 않은 유니폼에 근절,중앙 위의 두꺼운 필라멘트가 불안정과 이동할 수 있 수축하는 동안. 그러나 동작의 탄력 단백질 등의 titin 는 가설을 유지하는 균일한 긴장에서 근절을 당겨서 두꺼운 필라멘트는 중앙 위치입니다.
Crossbridge cyclingEdit

Crossbridge 순환 순서의 분자 이벤트의 기초가 되는 슬라이딩 필라멘트 이론이다. 크로스 브릿지는 두꺼운 필라멘트에서 연장되는 두 개의 미오신 헤드로 구성된 미오신 투영법입니다. 각 myosin 머리에는 두 개의 결합 부위가 있습니다:하나는 ATP 용이고 다른 하나는 actin 용입니다. 미오신 헤드에 ATP 의 결합은 액틴에서 미오신을 분리하여 미오신이 다른 액틴 분자에 결합 할 수있게한다. 연결이 완료되면 ATP 은 가수분해에 의해 myosin 사용하는 출시하는 에너지로 이동하”격발 위치”그것에 의하여 약하게 결합하는 부분이 말라인딩 사이트입니다. 액틴 결합 부위의 나머지는 트로포 미오신에 의해 차단된다. ATP 가 가수 분해 된 상태에서 cocked myosin 헤드는 이제 ADP+Pi 를 포함합니다. 2 개의 Ca2+
이온은 액틴 필라멘트상의 트로포 닌 C 에 결합한다. Troponin-Ca2+
복합체는 tropomyosin 이 액틴 결합 부위의 나머지 부분을 밀어서 차단 해제하도록합니다. 액틴 결합 부위의 나머지 부분을 차단 해제하면 두 개의 미오신 헤드가 닫히고 미오신이 액틴에 강하게 결합 할 수 있습니다. 그런 다음 미오신 헤드는 무기 인산염을 방출하고 2pN 의 힘을 생성하는 파워 스트로크를 시작합니다. 파워 스트로크는 액틴 필라멘트를 안쪽으로 이동시켜 육종을 단축시킵니다. 그런 다음 Myosin 은 ADP 를 방출하지만 여전히 actin 에 단단히 결합되어 있습니다. 파워 스트로크의 끝에서,ADP 는 myosin 헤드에서 방출되어 다른 ATP 가 myosin 에 결합 할 때까지 엄격 상태로 actin 에 부착 된 myosin 을 남깁니다. ATP 가 부족하면 rigor mortis 의 특징 인 엄격 상태가 발생합니다. 다른 ATP 가 미오신에 결합하면 미오신 헤드가 다시 액틴에서 분리되고 다른 크로스 브리지주기가 발생합니다.
Crossbridge cycling 은 세포질에 충분한 양의 ATP 와 Ca2+
이있는 한 계속 될 수 있습니다. Crossbridge cycling 의 종료는 Ca2+
이 능동적으로 sarcoplasmic reticulum 으로 다시 펌핑 될 때 발생할 수 있습니다. 때 Ca2+
더 이상에 존재하는 얇은 필라멘트의 트로포 미오신 변경 사항 구조를 이전의 상태로를 차단하는 바인딩 사이트 again. 미오신은 얇은 필라멘트에 결합을 중단하고 근육은 이완됩니다. Ca2+
이온은 sarcoplasm 에서 Ca2+
이온 농도를 유지하기 위해 트로포 닌 분자를 떠납니다. Ca2+
이온의 활성 펌핑 sarcoplasmic reticulum 은 myofibrils 주변의 유체에 결핍을 만듭니다. 이로 인해 트로포 닌(troponin)으로부터 Ca2+
이온이 제거됩니다. 따라서,트로포 미오신-트로포 닌 복합체는 액틴 필라멘트상의 결합 부위를 다시 덮고 수축이 중단된다.
그라데이션의 골격근 contractionsEdit
강도의 골격근 수축 폭넓게 사용하실 수 있습으로 구분됩 트,요약,and tetanus. 트 위치는 근육 섬유 자체 내에서 활동 잠재력에 의해 생성 된 단일 수축 및 이완 사이클입니다. 시간 사이에 자극하는 운동신경과 이후의 수축 근육 자극이라는 잠재 기간에는 일반적으로 약 10ms 고가 발생 시간에 의해 신경 조치는 잠재력을 전파,시간이 화학제품을 위한 전송에서 neuromuscular junction,후속 단계에서 자극-contraction coupling.
경우 다른 근육 활동 잠재력을 생산하기 전에 완벽한 휴식의 근육 경련,다음을 트는 단순히 합계에 트 이전,그로 인하여 생산됩니다. 합계는 주파수 합계와 다중 섬유 합계의 두 가지 방법으로 달성 될 수 있습니다. 주파수 합계에서 골격근에 의해 가해지는 힘은 활동 전위가 근육 섬유로 보내지는 빈도를 변화시킴으로써 제어됩니다. 액션이 잠재력 에 도착하지 않는 근육을 동시에,그 동안에 수축이,어떤의 일부분에 있는 섬유 근육이 될 것이다 발사에서는 주어진 시간이다. 에서 일반적인 상황을 때 인간은 발휘들은 근육으로 열심히 그들은 의식적으로 할 수 있 거나 제삼의 섬유에서 이러한 각 근육에서 발사는 한 번도 이 비율에 의해 영향을 받을 수 있는 다양한 생리학적,심리적 요인(를 포함하여 Golgi 건 기관 및 Renshaw 세포). 이’저’수준의 수축을 보호 메커니즘을 방지하는 적출의 건—힘에 의해 생성된 95%축의 모든 섬유에 충분한 손해에 몸입니다. 에서 여러 섬유 합계는 경우,중앙 신경계를 보내는 신호가 약한 계약 근육,작은 운동 단위,더 고르기보다 큰 사람,자극 처음이다. 으로 신호 강도가 증가,더터 유닛은 흥분하는 이외에는 더 큰 것으로,가장 큰 모터 단위로 50 번 수축 강도로 작은 것들입니다. 점점 더 큰 모터 유닛이 활성화됨에 따라 근육 수축의 힘이 점진적으로 강해집니다. 개념으로 알려진 크기의 원리,수,그라데이션의 근간이 약한 수축이 발생하는 작은 단계에서는 다음을 점점 커지면 더 많은 양의 힘이 필요합니다.
경우 마지막으로,주파수의 근육 활동은 잠재력을 증가는 근육의 수축 절정에 도달한 힘과 고원에서 이 수준으로 다음 수축은 파상풍.
길이-장력 relationshipEdit

길이 긴장의 관계에 관한 강의 등축 수축의 길이는 근육에서 수축이 발생합니다. 근육은 이상적인 길이(종종 휴식 길이)에 가까울 때 가장 큰 활동적인 긴장으로 작동합니다. 때 늘어나거나 줄이 넘어(는지 여부의 작용으로 인해 근육을 자체가 또는 외부로부터),최대 active 긴장 생성되는 감소한다. 이 감소는 작은 편차에 대해서는 최소화되지만 길이가 이상으로부터 더 벗어남에 따라 장력이 급격히 떨어집니다. 존재하기 때문에 탄성이 단백질 내에서 근육 세포(과 같은 titin)및 extracellular matrix,근육이 늘어 넘어 주어진 길이 있는 전적으로 수동 긴장,반대하는 길. 함께 결합하면 능동적 인 긴장의 피크를 훨씬 뛰어 넘는 능동적 인 근육을 길게하는 것에 대한 강한 저항력이 있습니다.
포스-속도 relationshipsEdit
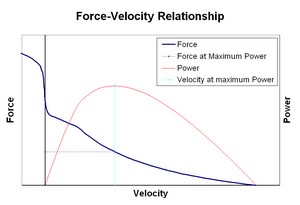
포스–속도계와 관련되는 속도 근육의 변화의 길이(일반적으로 규제에 의해서 외부의 힘으로드하거나 다른 근육)하는 힘의 크기는 그것이 생성됩니다. 력 감소에서 과장되는 패션 상대적 사시는 힘으로 단축하는 속도가 증가하고,결국 제로 도달에 최대 속도합니다. 역도 마찬하면 근육이 늘 힘이 증가 위의 등대,때까지 마지막으로 도달에는 절대 최대. 이 본질적인 속성의 활동적인 근육조직의 역할을에서 활동 감쇠의 관절의 움직이는 동시에 활동이 상대 근육이다. 이러한 경우에 힘 속도 프로파일을 향상 힘에 의해 생산되 길에서 근육의 비용으로 단축 근육이다. 어느 것이든 근육이 평형에 합동을 돌려보내는 이 호의를 베푸는 것은 효과적으로 합동의 감쇠를 증가합니다. 또한,댐핑의 강도는 근육의 힘에 따라 증가합니다. 따라서 모터 시스템은 반대 근육 그룹의 동시 수축(공동 수축)을 통해 관절 댐핑을 능동적으로 제어 할 수 있습니다.
부드러운 muscleEdit
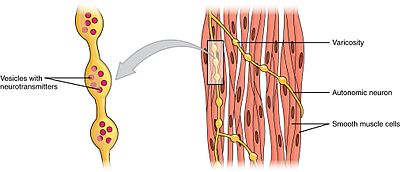
평활근은 단일 단위(단일 단위)와 다중 단위의 두 하위 그룹으로 나눌 수 있습니다. 단일 단위 평활근 세포는 장과 혈관에서 찾을 수 있습니다. 이 세포들은 갭 접합에 의해 서로 연결되어 있기 때문에,그들은 syncytium 으로 계약 할 수 있습니다. 단일 단위 평활근 세포는 자율 신경계에 의해 조절 될 수있는 근원적으로 수축합니다.
단일 단위 평활근 세포와 달리 다중 단위 평활근 세포는 눈의 근육과 모낭의 기저부에서 발견됩니다. 다중 단위 평활근 세포는 자율 신경계의 신경에 의해 별도로 자극되어 수축합니다. 이와 같이,그들은 허용에 대한 정밀한 제어하고 점진적인 응답을 많이 좋아 모터의 모집 단위에서 골격근.
메커니즘의 부드러운 근육 contractionEdit
수축 활동의 평활근 세포에 의해 영향을 받는 여러 개의 입력과 같은 자발적인 전기적 활동,신경 및 호르몬의 입력,현지 화학 성분의 변화에,그리고 스트레칭. 이것은 단일 신경 입력에 의존하는 골격근 세포의 수축 활동과는 대조적입니다. 일부 형태의 부드러운 근육 세포를 생성할 수 있게 자신의 행동 잠재력이 자발적으로는,일반적으로 발생 다음과 같은 맥박 조정기를 잠재 또는 천천히 파 잠재력입니다. 이러한 활동 전위는 na+
이 아닌 세포 외 Ca2+
의 유입에 의해 생성됩니다. 골격근과 마찬가지로 cytosolic Ca2+
이온도 평활근 세포에서 크로스 브리지 사이클링에 필요합니다.
두 개의 원본에 대한 cytosolic Ca2+
에서 부드러운 근육 세포들은 세포 Ca2+
입력을 통해 칼슘 채널 Ca2+
이온서 sarcoplasmic 그물. Cytosolic Ca2+
의 상승은 더 많은 Ca2+
이 calmodulin 에 결합하여 myosin light-chain kinase 를 결합하고 활성화시킵니다. 칼슘-칼모둘린-미오신 경쇄 키나아제 복합체는 아미노산 잔기-세린 19 에서 20 킬로 달톤(kDa)미오신 경쇄에 미오신을 인산화시켜 수축을 시작하고 미오신 ATPase 를 활성화시킨다. 달리 근육골격,세포활근 세포 부족 troponin,비록 그들이 포함 얇은 필라멘트 단백질 트로포 미오신과 다른 주목할 만한 단백질–caldesmon 및 calponin. 따라서,부드러운 근육의 수축가에 의해 시작 Ca2+
활성 인 산화 myosin 보다 Ca2+
바인딩하여 troponin 복잡한 조절 myosin 바인딩 사이트에서 말라에서 같은 골격과 심장 근육이다.
의 종료 crossbridge 자전거(고 근육에서 래치 상태)할 때 발생하 myosin light chain 인산 제거합 인산에서 myosin 다. 20kDa 미오신 경쇄의 인산화는 평활근의 단축 속도와 잘 상관 관계가있다. 이 기간 동안 산소 소비에 의해 측정 된 에너지 이용률의 급격한 파열이 있습니다. 몇 분 이내의 개시,칼슘 수준을 현저히 감소,20kDa myosin light 체인’인산화,감소 및 에너지 사용량 감소;그러나,힘이 강장 부드러운 근육이 유지됩니다. 근육의 수축 동안,활성화 된 액틴과 인산화 된 미오신 사이에 빠르게 순환하는 크로스 브리지가 형성되어 힘을 생성합니다. 힘의 유지는 천천히 힘을 순환시키고 유지하는 탈 인산화 된”래치-브리지”로부터의 결과라는 가설이있다. 수 kinases 과 같은 노 니,DAPK3,및 단백질 kinase C 은 믿에 참여하는 지속적인 단계이의 수축,Ca2+
유출될 수 있 중요합니다.
NeuromodulationEdit
지만 부드러운 근육의 수축 근육조직,속도와 힘이 그들의 수축을 조절할 수 있으로 자율신경 시스템입니다. 절 신경 섬유의 부교감 신경계를 놓는 신경전달물질 아세틸콜린 결합 muscarinic 아세틸콜린 수용체(mAChRs)부드러운 근육 세포입니다. 이 수용체는 metabotropic,또는 제 2 메신저 캐스케이드를 개시하는 g-단백질 결합 수용체이다. 반대로,절후 신경 섬유의 교감 신경계를 놓는 신경전달물질 epinephrine and norepinephrine,bind 는 아드레날린성 수용체는 또한 metabotropic. 정확한 효과에 매끄러운 근육에 따라 특정 특성의 수용기 활성화 모두교감 입력 및 공감력 중 하나가 될 수 있습성(수축)또는 억제(편).
심장 muscleEdit

두 가지 유형이 있는 심장 근육 세포의:autorhythmic 및 수축. Autorhythmic 세포는 계약하지 않지만,대신 속도를 설정의 수축을 위한 다른 심장 근육 세포할 수 있는 변조방식에 의하여 자율신경 시스템입니다. 대조적으로,수축성 근육 세포(심근 세포)는 심장 근육의 대부분을 구성하며 수축 할 수 있습니다.
여기-수축 couplingEdit
골격 및 심장 근육 흥분-수축(E-C)결합 모두에서 탈분극 전도 및 Ca2+방출 과정이 발생합니다. 그러나 관련된 단백질은 유사하지만 구조와 조절면에서 별개입니다. Dihydropyridine 수용체(DHPRs)는 다른 유전자에 의해 암호화되고 ryanodine 수용체(RyRs)는 별개의 isoforms 입니다. 또한,DHPR 연락처 RyR1(주 RyR isoform 에서 골격근)을 조절하는 Ca2+릴리스 골격근하는 동안,L-type calcium channel(DHPR 에 cardiac myocytes)및 RyR2(주 RyR isoform 에서 심장 근육)하지 않은 육체적으로 결합에 있는 심장 근육,그 얼굴을 서로 접합에 연결할 수도 있습니다.
과는 달리 골격근,E-C 결합 심장 근육에서는 생각에 주로 의존하는 메커니즘이라는 칼슘-유도 칼슘 릴리스 기반으로 하는 접합 구조를 사 T 관 sarcoplasmic 그물. Junctophilin-2(JPH2)는 T-tubule 의 완전성뿐만 아니라이 구조를 유지하는 데 필수적입니다. 또 다른 단백질,수용체 액세서리 5 단백질(REEP5),함수를 유지하는 정상적인 형태의 접합 SR. 의 결함을 접합 커플링에서 발생할 수 있습니다 부족의 두 개의 단백질이다. 칼슘 유도 칼슘 방출 과정에서 ryr2s 는 칼슘 트리거에 의해 활성화되며,이는 L 형 칼슘 채널을 통한 Ca2+의 흐름에 의해 유발됩니다. 이 후,심장 근육은 트라이어드보다는 diad(또는 dyad)구조를 나타내는 경향이 있습니다.
Excitation-contraction coupling 에서 심장 근육 세포할 때 발생하는 조치는 잠재력을 시작으로 세포에서 동방 노드 노드 또는 심방하고 진행하는 모든 세포에서 심장을 통해 갭 수 있습니다. 액션이 잠재적인 여행을 따라 표면에 막으로 T-세관(후자는 보이지 않는 모든 심장포 종류)및 depolarisation 원인 외 Ca2+
입력을 통해 셀 L-type 칼슘 채널 시청 가능성 나트륨 칼슘교환기(NCX)동안의 초기 부분 plateau 단계입니다. 이 Ca2+유입은 활성화에 필요한 Ca2+의 약 10%에 대해서만 계산되지만 골격근보다 상대적으로 큽니다. 이 Ca2+
유입은 세포 내 Ca2+
의 작은 국소 증가를 유발합니다. 세포 내 Ca2+
의 증가는 sarcoplasmic reticulum 의 막에서 RyR2 에 의해 검출되며,이는 긍정적 인 피드백 생리 반응에서 Ca2+
을 방출합니다. 이 긍정적 인 피드백은 칼슘 유도 칼슘 방출로 알려져 있으며 칼슘 스파크(Ca2+
스파크)를 발생시킵니다. ~30,000Ca2+
스파크의 공간적 및 시간적 합계는 세포질 칼슘 농도의 세포 전체 증가를 제공합니다. 의 증가 cytosolic 칼슘 다음과 같은 흐름을 칼슘의 세포막을 통과 sarcoplasmic 그물은 중재에 의 칼슘이 버퍼는 바인딩의 큰 비율이 세포내는 칼슘을 섭취할 수 있습니다. 결과적으로,총 칼슘의 큰 증가는 자유 Ca2+
의 비교적 작은 상승을 초래한다.
세포질 칼슘 바인딩하여 Troponin C,이동하는 트로포 미오신 복잡한 오프 말라인딩 사이트를 허용 myosin 머리에 바인딩하는 말라 필라멘트. 이 시점부터 수축 메커니즘은 본질적으로 골격근과 동일합니다(위). 간단히 말해서,ATP 가수 분해를 사용하여,미오신 헤드는 액틴 필라멘트를 육종의 중심쪽으로 끌어 당긴다.

다음과 같은 심장 수축,세포내 칼슘에 의해 촬영 sarco/endoplasmic 그물 ATPase(SERCA)펌프로 sarcoplasmic 그물 준비를 위해 다음 사이클을 시작합니다. 칼슘은 또한 나트륨-칼슘 교환기(ncx)에 의해 주로 세포로부터 배출되고,더 적은 정도로,혈장 막 칼슘 ATPase. 일부 칼슘은 또한 미토콘드리아에 의해 섭취됩니다. 효소 인 phospholamban 은 SERCA 의 브레이크 역할을합니다. 낮은 심박수에서 phospholamban 은 활성화되어 ATPase 의 활성을 늦추므로 Ca2+
이 세포를 완전히 떠날 필요가 없습니다. 높은 심박수에서 phospholamban 은 인산화 및 비활성화되어 세포질에서 대부분의 Ca2+
을 다시 sarcoplasmic reticulum 으로 가져옵니다. 다시 한 번 칼슘 버퍼 온 이 fall in Ca2+
농도,허가는 비교적 작은 감소에서 무료 Ca2+
농도에 응답하여 큰 변화 총 칼슘을 섭취할 수 있습니다. 떨어지는 Ca2+
농도는 트로포 닌 복합체가 액틴 필라멘트로부터 해리되어 수축을 종식시킬 수있게한다. 심장은 이완되어 심실이 혈액으로 채워지고 심장주기를 다시 시작할 수 있습니다.
Leave a Reply