15.3: Właściwości fizyczne kwasów karboksylowych
cele nauki
- Porównaj punkty wrzenia kwasów karboksylowych z alkoholami o podobnej masie molowej.
- Porównaj rozpuszczalność kwasów karboksylowych w wodzie z rozpuszczalnością porównywalnych alkanów i alkoholi w wodzie.
wiele kwasów karboksylowych jest bezbarwnymi cieczami o nieprzyjemnych zapachach. Kwasy karboksylowe z 5 do 10 atomami węgla mają „gęsty” zapach (wyjaśniający zapach sera Limburger). Kwasy te są również wytwarzane w wyniku działania bakterii skórnych na ludzki sebum (olejki skórne), co odpowiada za zapach słabo wentylowanych szatni. Kwasy z ponad 10 atomami węgla są woskowatymi ciałami stałymi, a ich zapach zmniejsza się wraz ze wzrostem masy molowej i zmniejszającą się lotnością.
kwasy karboksylowe wykazują silne wiązanie wodorowe między cząsteczkami. Mają więc wysoką temperaturę wrzenia w porównaniu z innymi substancjami o porównywalnej masie molowej.
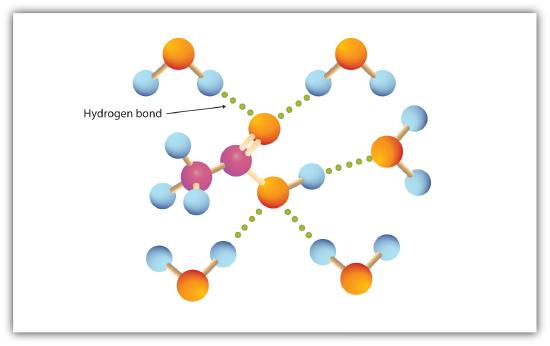
Grupa karboksylowa łatwo angażuje się w wiązanie wodorowe z cząsteczkami wody (rysunek \(\PageIndex{1}\)). Kwasy z jednym do czterech atomów węgla są całkowicie mieszalne z wodą. Rozpuszczalność zmniejsza się wraz ze wzrostem długości łańcucha węglowego, ponieważ siły dipolowe stają się mniej ważne, a siły dyspersji stają się bardziej dominujące. Kwas heksanowy jest słabo rozpuszczalny w wodzie (około 1,0 g/100 g wody). Kwas palmitynowy z dużym niepolarnym składnikiem węglowodorowym jest zasadniczo nierozpuszczalny w wodzie. Kwasy karboksylowe są zwykle rozpuszczalne w takich rozpuszczalnikach organicznych, jak etanol, toluen i eter dietylowy.
w tabeli 15.4.1 wymieniono niektóre właściwości fizyczne wybranych kwasów karboksylowych. Pierwsze sześć to homologi. Zauważ, że temperatura wrzenia wzrasta wraz ze wzrostem masy molowej, ale temperatura topnienia nie wykazuje regularnego wzoru.
| Condensed Structural Formula | Name of Acid | Melting Point (°C) | Boiling Point (°C) | Solubility (g/100 g of Water) |
|---|---|---|---|---|
| HCOOH | formic acid | 8 | 100 | miscible |
| CH3COOH | acetic acid | 17 | 118 | miscible |
| CH3CH2COOH | propionic acid | –22 | 141 | miscible |
| CH3(CH2)2COOH | butyric acid | –5 | 163 | miscible |
| CH3(CH2)3COOH | valeric acid | –35 | 187 | 5 |
| CH3(CH2)4COOH | caproic acid | –3 | 205 | 1.1 |
| C6H5COOH | benzoic acid | 122 | 249 | 0.29 |
Concept Review Exercises
- Which compound has the higher boiling point—butanoic acid (molar mass 88) or 2-pentanone (molar mass 86)? Explain.
- Would you expect butyric acid (butanoic acid) to be more or less soluble than 1-butanol in water? Explain.
odpowiedzi
- kwas masłowy z powodu wiązania wodorowego (nie ma międzycząsteczkowego wiązania wodorowego w 2-pentanonie.)
- bardziej rozpuszczalny, ponieważ istnieje bardziej rozległe wiązanie wodorowe
kluczowe informacje
- kwasy karboksylowe mają wysoką temperaturę wrzenia w porównaniu z innymi substancjami o porównywalnej masie molowej. Temperatura wrzenia wzrasta wraz z masą molową.
- kwasy karboksylowe posiadające od jednego do czterech atomów węgla są całkowicie mieszalne z wodą. Rozpuszczalność zmniejsza się wraz z masą molową.
ćwiczenia
-
który związek ma wyższą temperaturę wrzenia—CH3CH2CH2OCH2CH3 czy CH3CH2CH2COOH? Wyjaśnij.
-
który związek ma wyższą temperaturę wrzenia—CH3CH2CH2CH2CH2OH lub CH3CH2CH2COOH? Wyjaśnij.
-
który związek jest bardziej rozpuszczalny w wodzie—CH3COOH lub CH3CH2CH2CH3? Wyjaśnij.
-
który związek jest bardziej rozpuszczalny w wodzie—CH3CH2COOH lub CH3CH2CH2CH2CH2COOH? Wyjaśnij.
odpowiedzi
-
CH3CH2CH2COOH z powodu wiązania wodorowego (nie ma międzycząsteczkowego wiązania wodorowego z CH3CH2CH2OCH2CH3.)
-
CH3COOH, ponieważ angażuje się w wiązanie wodorowe z wodą (nie ma międzycząsteczkowego wiązania wodorowego z CH3CH2CH2CH3.)
Leave a Reply