7.2: Chymotrypsin
introduktion
Chymotrypsin er et af de mest undersøgte stoffer på grund af dets tofasekinetik: pre-steady-state og steady state. Undersøgelsen af disse to kinetiske tilstande giver bevis for “Ping-Pong” – mekanismen, dannelsen af kovalente komplekser, der fører til kovalente hydrolysereaktioner og hastigheden af de katalyserede reaktioner. Syntese af chymotrypsin forekommer primært i bugspytkirtlen. I stedet for den aktive form produceres den imidlertid som et inaktivt cymogen kaldet chymotrypsinogen for at forhindre dets proteaseaktivitet i at fordøje bugspytkirtlen. Når det udskilles i tyndtarmen, omdannes det til dets aktive form ved hjælp af et andet såkaldt trypsin. Denne afhængighed af et andet ferment til aktivering af en protease er en almindelig måde for kroppen at forhindre fordøjelsen af organer og andre skadelige fermatiske bivirkninger.
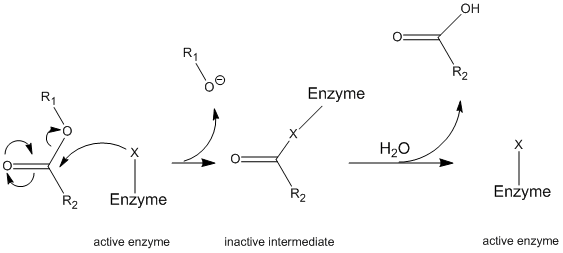
Chymotrypsin fungerer gennem en generel mekanisme kendt som ping-pong-mekanismen (figur \(\Sideindeks{1}\)), hvorved fermet reagerer med et substrat for at danne et mellemprodukt. Dette mellemprodukt har forskellige egenskaber end det oprindelige ferment, så det skal reagere med et sekundært substrat for at regenerere den oprindelige fermentatiske aktivitet. Denne proces er illustreret nedenfor:

mere specifikt fungerer chymotrypsin gennem en bestemt type ping-pong mekanisme kaldet kovalent hydrolyse. Dette betyder, at en kovalent binding først danner en kovalent binding med målsubstratet og fortrænger den mere stabile del til opløsning. Dette kompleks kaldes intermediate. Mellemproduktet reagerer derefter med vand, som fortrænger den resterende del af det oprindelige substrat og reformerer det oprindelige ferment.
Chymotrypsin, som de fleste af dem, er specifik i de typer af substrater, som den reagerer på. Som en protease spalter den polypeptider, og dens iboende specificitet tillader det kun at virke på carboksyterminalen af aromatiske rester. Det er en noget kompliceret mekanisme og forklares bedst i en række trin.
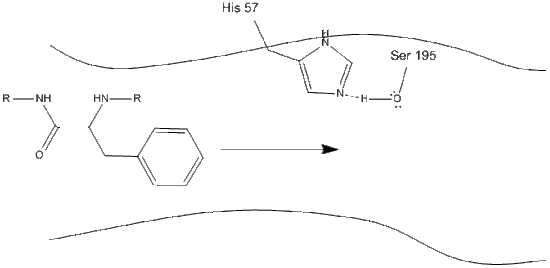
1 . Målet kommer ind i det aktive sted for chymotrypsin, og det holdes der ved hydrofobe interaktioner mellem eksponerede ikke-polære grupper af rester og den ikke-polære aromatiske sidekæde af substratet. Det er vigtigt at bemærke hydrogenbindingen mellem Schiff-nitrogenet på histidin-57 og iltsidekæden af serin-195.
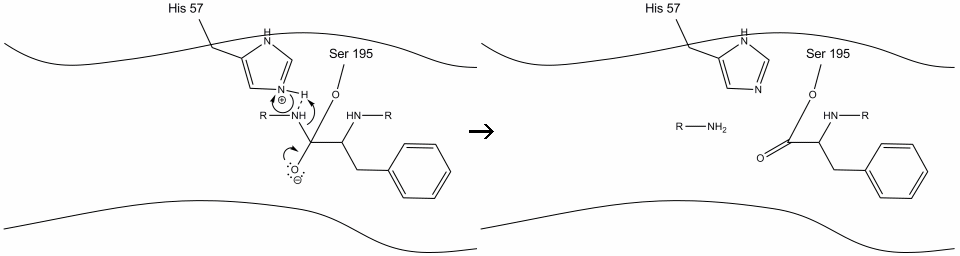
2. Ved hjælp af histidin-serinhydrogenbinding udfører hydroksylgruppen på serin-195 et nukleofilt angreb på carbonylcarbonet i en aromatisk aminosyre, samtidig med at hydroksilhydrogen overføres til histidin Schiff-nitrogenet. Dette angreb skubber pi carbonylelektronerne på carbonyliltet og danner et kortvarigt mellemprodukt bestående af et c-terminalt kulstof med fire enkeltbindinger: en iltanion, beta-carbon af den aromatiske aminosyre, n-terminalen af den efterfølgende aminosyre af substratproteinet og serin-195-sidekædens ilt.
.gif?revision=1&size=bestfit&width=720&height=192)
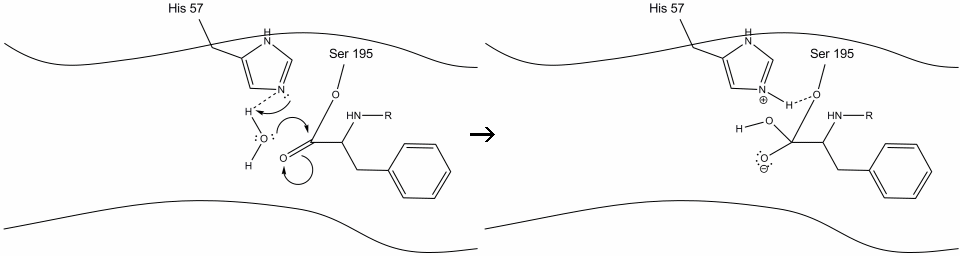
3. Dette mellemprodukt er kortvarigt, da iltelektronerne reformerer pi-bindingen med C-terminalen af den aromatiske aminosyre. Bindingen mellem carboksyterminalen af den aromatiske aminosyre og n-terminalen af den efterfølgende rest spaltes, og dens elektroner bruges til at ekstrahere brintet af det protonerede Schiff-nitrogen på histidin-57. Bindingerne mellem carbonylcarbonet og serin-195-iltet forbliver i en esterkonfiguration. Dette kaldes et mellemprodukt. Den c-terminale side af polypeptidet er nu fri til at adskille sig fra det aktive sted for det aktive stof.
4. Vandmolekyler er nu i stand til at komme ind og binde til aktivt sted gennem hydrogenbinding mellem hydrogenatomerne i vand og histidin-57 Schiff-nitrogenet.
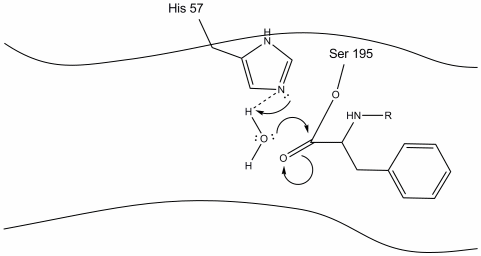
5. Vandet ilt gør nu et nukleofilt angreb på carbonylcarbonet i acyl-mellemproduktet og skubber carbonylens pi-elektroner på carbonylcarbonet, da histidin-57 ekstraherer en proton fra vand. Dette danner et andet kvaternært kulstof, der er kovalent bundet med serin, en hydroksyl, en iltning og den aromatiske aminosyre. Protonen på den nyligt protonerede histidin-57 er nu i stand til at lave en hydrogenbinding med seriniltet.
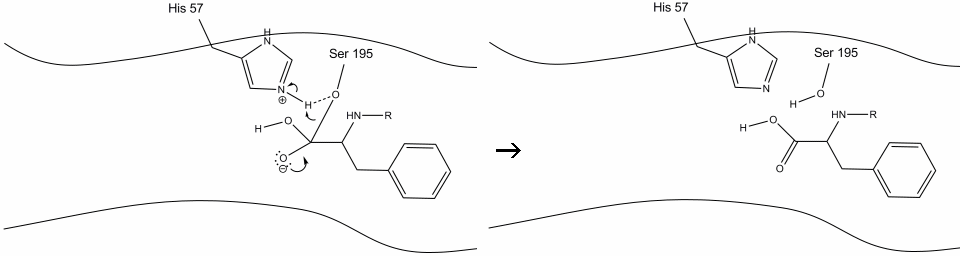
6. En af de mest almindelige typer af carbonylbinding er carbonylbinding, der bruges til at opdele carbonylbinding og serinhydroksyl. Elektronerne i denne binding bruges af serin ilt til at deprotonere histidin Schiff nitrogen og reformere det oprindelige. Underlaget har ikke længere affinitet for det aktive sted, og det adskiller sig snart fra komplekset.
Leave a Reply