4.4: Charakteristika Kovalentní Vazby
Elektronegativitu a Vazba Polarita
i když jsme definovali kovalentní vazby jako sdílení elektronů, elektrony do kovalentní vazby nejsou vždy rovným dílem dva vázané atomy. Pokud vazba spojuje dva atomy téhož prvku, stejně jako v H2, tam bude vždy být jeden atom přitahuje elektrony v pouto silnější než druhý atom má, stejně jako v HCl, je znázorněno na Obrázku \(\PageIndex{1}\). Kovalentní vazba, která má stejné sdílení elektronů (obrázek \(\PageIndex{1a}\)), se nazývá nepolární kovalentní vazba. Kovalentní vazba, která má nerovnoměrné sdílení elektronů, jako na obrázku \(\PageIndex{1b}\), se nazývá polární kovalentní vazba.

Obrázek \(\PageIndex{1}\) Polární vs. Nepolární Kovalentní Vazby. (a) elektrony v kovalentní vazbě jsou rovnoměrně sdíleny oběma atomy vodíku. Jedná se o nepolární kovalentní vazbu. (b) atom chloru přitahuje elektrony ve svazku více než atom vodíku, což vede k nerovnováze v elektronové distribuci. Toto je polární kovalentní vazba.
distribuce elektronové hustoty v polární vazbě je nerovnoměrná. Je větší kolem atomu, který přitahuje elektrony více než ostatní. Například elektrony v vazbě H-Cl molekuly chlorovodíku tráví více času v blízkosti atomu chloru než v blízkosti atomu vodíku. Poznámka: stínovaná oblast kolem Cl na Obrázku \(\PageIndex{1b}\) je mnohem větší, než je kolem H.
Tato nerovnováha v elektronové hustoty v nahromadění částečný záporný náboj (označeny jako δ−) na jednu stranu dluhopisů (Cl) a částečný kladný náboj (označené δ+) na druhé straně bond (H). To je vidět na obrázku \(\PageIndex{2a}\). Oddělení náboje v polární kovalentní vazbě má za následek elektrický dipól (dva póly), reprezentovaný šipkou na obrázku \(\PageIndex{2b}\). Směr šipky je nasměrován směrem k δ-konci, zatímco + ocas šipky označuje δ + konec vazby.
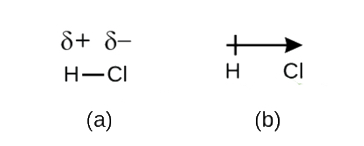
Obrázek \(\PageIndex{2}\): (a) Nerovné sdílení lepení párů elektronů mezi H a Cl vede k parciální kladný náboj na H atom a částečný záporný náboj na Cl. Symboly δ+ a δ-označují polaritu vazby H-Cl. b) dipól je reprezentován šipkou s křížem u ocasu. Kříž je blízko konce δ+ a hrot šípu se shoduje s δ–.
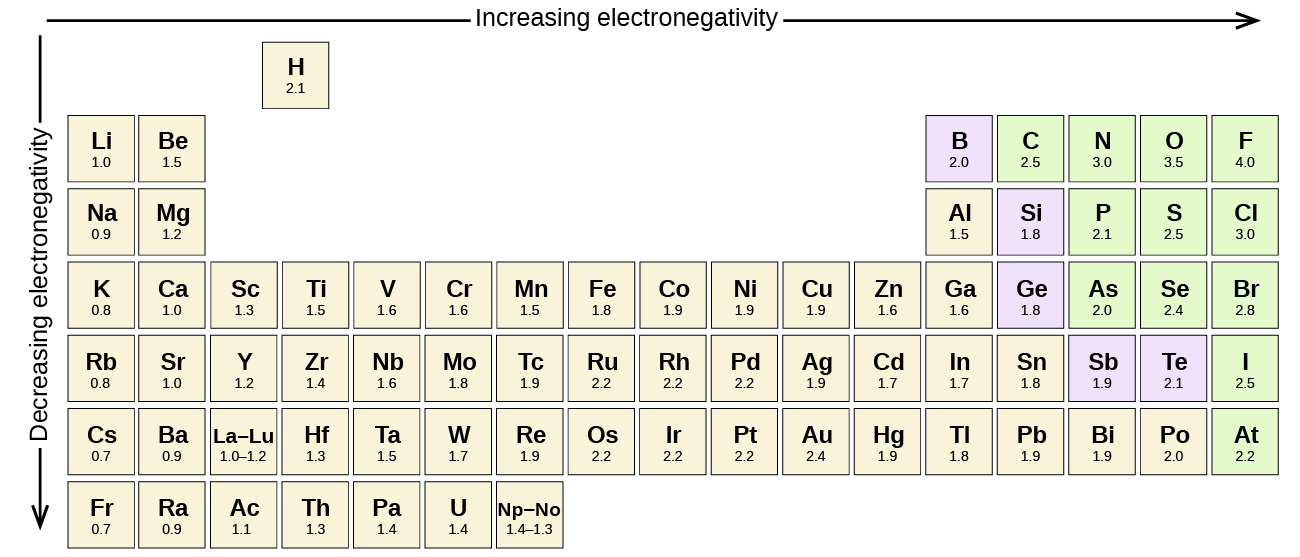
Žádné kovalentní vazby mezi atomy různých prvků je polární vazba, ale stupeň polarity se velmi liší. Některé vazby mezi různými prvky jsou pouze minimálně polární, zatímco jiné jsou silně polární. Iontové vazby lze považovat za nejvyšší polaritu, přičemž elektrony jsou přenášeny spíše než sdíleny. Posoudit relativní polarita kovalentní vazba, chemici použití elektronegativita, který je relativním měřítkem toho, jak silně atom přitahuje elektrony, když to tvoří kovalentní vazbu. Existují různé číselné stupnice pro hodnocení elektronegativity. Obrázek \(\PageIndex{3}\) ukazuje jednu z nejpopulárnějších-Paulingovu stupnici.
při pohledu blíže: Linus Pauling
Pravděpodobně nejvlivnější chemik 20. století, Linus Pauling (1901-94) je jediný, kdo vyhrál dva jednotlivce (to znamená, nesdílené) Nobelovy Ceny. Ve třicátých letech použil Pauling nové matematické teorie k vyjádření některých základních principů chemické vazby. Jeho kniha The Nature of the Chemical Bond z roku 1939 je jednou z nejvýznamnějších knih, jaké kdy v chemii vyšly.
v roce 1935 se Paulingův zájem obrátil na biologické molekuly a za svou práci na struktuře bílkovin získal Nobelovu cenu za chemii v roce 1954. (Byl velmi blízko k objevení struktury dvojité šroubovice DNA, když James Watson a James Crick oznámili svůj vlastní objev její struktury v roce 1953.) Mu byla později udělena Nobelova cena za mír z roku 1962 za jeho snahu zakázat testování jaderných zbraní.

Linus Pauling byl jedním z nejvlivnějších chemiků 20.století.
v pozdějších letech se Pauling přesvědčil, že velké dávky vitaminu C zabrání nemocem, včetně běžného nachlazení. Většina klinických výzkumů neprokázala spojení, ale Pauling pokračoval v užívání velkých dávek denně. Zemřel v roce 1994, poté, co strávil celý život vytvářením vědeckého odkazu, který si málokdo bude rovnat.
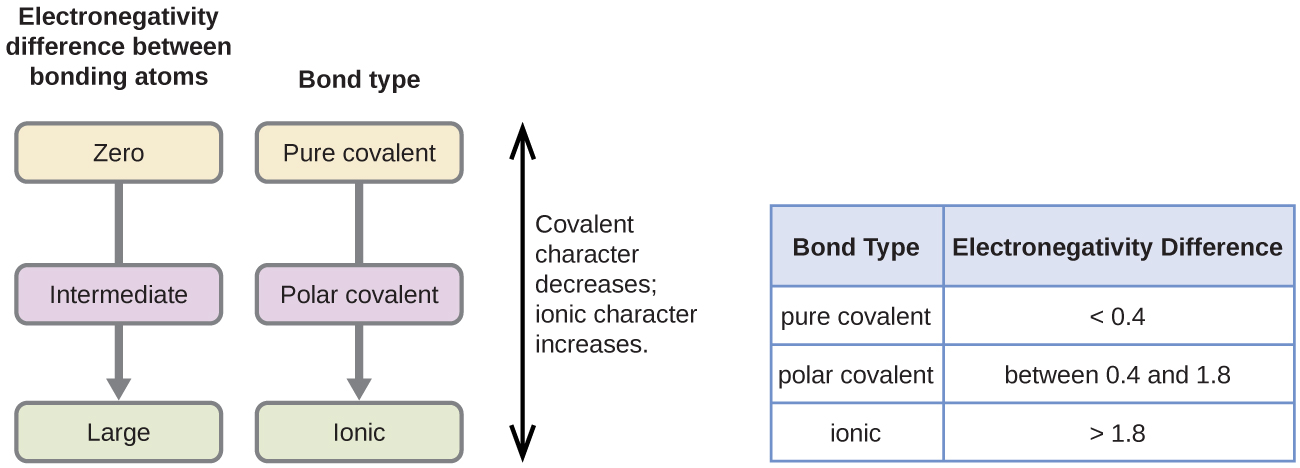
polaritu kovalentní vazby lze posoudit stanovením rozdílu v elektronegativitě dvou atomů tvořících vazbu. Čím větší je rozdíl v elektronegativitách, tím větší je nerovnováha sdílení elektronů ve vazbě. Ačkoli neexistují žádná tvrdá a rychlá pravidla, obecným pravidlem je, pokud je rozdíl v elektronegativitách menší než asi 0.4, vazba se považuje za nepolární; pokud je rozdíl větší než 0,4, považuje se vazba za polární. Pokud je rozdíl v elektronegativitách dostatečně velký (obecně větší než asi 1,8), je výsledná sloučenina považována spíše za iontovou než kovalentní. Rozdíl elektronegativity nula samozřejmě označuje nepolární kovalentní vazbu.
Například \(\PageIndex{1}\)
Popište electronegativity rozdíl mezi každým párem atomů a výsledná polarita (nebo bond).
- C a H
- H a H
- Na a Cl
- O a H
Řešení
- Uhlík má elektronegativitu 2,5, zatímco hodnota pro vodík je 2.1. Rozdíl je 0,4, což je poměrně malé. Vazba C-H se proto považuje za nepolární.
- oba atomy vodíku mají stejnou hodnotu elektronegativity-2.1. Rozdíl je nulový, takže vazba je nepolární.
- elektronegativita sodíku je 0,9, zatímco chlor je 3,0. Rozdíl je 2,1, což je poměrně vysoké, a tak sodík a chlor tvoří iontovou sloučeninu.
- s 2,1 pro vodík a 3,5 pro kyslík je rozdíl elektronegativity 1,4. Očekávali bychom velmi polární vazbu. Sdílení elektronů mezi O A H je nerovnoměrné s elektrony silněji přitahovanými K O.
Cvičení \(\PageIndex{1}\)
Popište elektronegativita (CS) rozdíl mezi každým párem atomů a výsledná polarita (nebo bond).
- C a O
- K a Br
- N a N
- Cs a F
Odpověď:
CS rozdíl je 1.0 , tedy polární. Sdílení elektronů mezi C a O je nerovný s elektrony silněji, byly k. O.
Odpověď b:
CS rozdíl je větší než 1,8, a proto iontové.
odpověď c:
identické atomy mají nulový EN rozdíl, proto nepolární.
odpověď d:
rozdíl EN je větší než 1,8, tedy iontový.
Leave a Reply