4.4: Jellemzők Kovalens kötés
Electronegativity Bond Polaritás
Bár meghatározott kovalens kötés, mint elektron megosztása, az elektronok egy kovalens kötés nem mindig egyenlően oszlanak meg a két ragasztott atomok. Hacsak a kötés nem köti össze ugyanazon elem két atomját, mint a H2-ben, mindig lesz egy atom, amely erősebben vonzza az elektronokat a kötésben,mint a másik atom, mint a HCl-ben, a \(\PageIndex{1}\) ábrán látható. A kovalens kötést, amely egyenlő arányban osztja az elektronokat (\ábra (\PageIndex{1a}\)), nem poláris kovalens kötésnek nevezzük. A kovalens kötést, amely egyenlőtlen elektron-megosztással rendelkezik, mint a \(\PageIndex{1b}\) ábrán, poláris kovalens kötésnek nevezzük.

ábra \(\PageIndex{1}\) poláris versus nempoláris kovalens kötések. a) a kovalens kötésben lévő elektronokat mindkét hidrogénatom egyenlően osztja meg. Ez egy nem poláris kovalens kötés. b) a klór atom jobban vonzza a kötésben lévő elektronokat, mint a hidrogénatom, ami az elektron eloszlásának egyensúlyhiányához vezet. Ez egy sarki kovalens kötés.
az elektronsűrűség eloszlása poláris kötésben egyenetlen. Nagyobb az atom körül, amely jobban vonzza az elektronokat, mint a másik. Például a hidrogén–klorid molekula H-Cl kötésében lévő elektronok több időt töltenek a klóratom közelében, mint a hidrogénatom közelében. Vegye figyelembe, hogy a CL körüli árnyékolt terület A \ábrán(\PageIndex{1b}\) sokkal nagyobb, mint H körül.
Ez az elektronsűrűség egyensúlyhiánya a kötés (CL) egyik oldalán részleges negatív töltés (δ−) felhalmozódását eredményezi, a kötés (h) másik oldalán pedig részleges pozitív töltés (δ+). Ez a \(\PageIndex{2a}\) ábrán látható. A töltés szétválasztása poláris kovalens kötésben elektromos dipólust (két pólust) eredményez, amelyet a \(\PageIndex{2b}\) ábrán látható nyíl képvisel. A nyíl iránya a δ-vég felé mutat, míg a nyíl + farka a kötés δ+ végét jelzi.
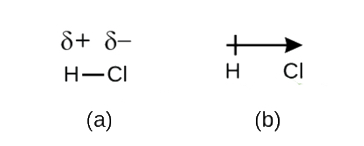
ábra \(\PageIndex{2}\): a) az elektronok H és Cl közötti kötéspár egyenlőtlen megosztása a H atom részleges pozitív töltéséhez és a CL részleges negatív töltéséhez vezet. Δ+ És δ-jelek jelzik a H–Cl kötés polaritását. b) a dipólust egy nyíl képviseli, amelynek keresztje van a faroknál. A kereszt közel van a δ + véghez, a nyílhegy pedig egybeesik a δ– – vel.
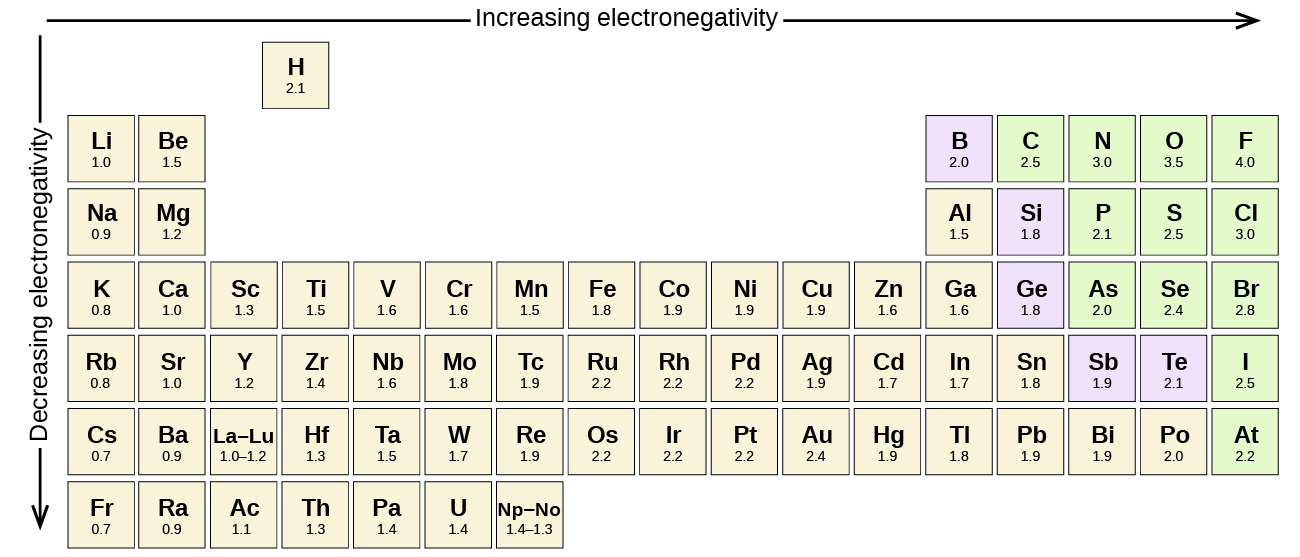
a különböző elemek atomjai közötti kovalens kötés poláris kötés, de a polaritás mértéke széles körben változik. A különböző elemek közötti kötések csak minimálisan polárisak, míg mások erősen polárisak. Ionos kötések lehet tekinteni a végső polaritás, elektronok átvitele helyett megosztott. A kovalens kötés relatív polaritásának megítéléséhez a vegyészek elektronegativitást használnak, ami relatív mércéje annak, hogy egy atom mennyire vonzza az elektronokat, amikor kovalens kötést képez. Különböző numerikus skálák vannak az elektronegativitás értékelésére. Ábra \ (\PageIndex{3}\) mutatja az egyik legnépszerűbb-a Pauling skála.
: Linus Pauling
vitathatatlanul a 20. század legbefolyásosabb kémikusa, Linus Pauling (1901-94) az egyetlen személy, aki két egyéni (azaz meg nem osztott) Nobel-díjat nyert. Az 1930-as években Pauling új matematikai elméleteket használt a kémiai kötés néhány alapelvének kiegészítésére. 1939-es könyve, a kémiai kötés természete az egyik legjelentősebb könyv, amelyet valaha kiadtak a kémiában.
1935-re Pauling érdeklődése a biológiai molekulák felé fordult, és 1954-ben kémiai Nobel-díjat kapott a fehérje szerkezetével kapcsolatos munkájáért. (Nagyon közel állt ahhoz, hogy felfedezze a DNS kettős spirálszerkezetét, amikor James Watson és James Crick 1953-ban bejelentették saját felfedezésüket a szerkezetéről.) Később elnyerte az 1962-es Nobel-békedíjat a nukleáris fegyverek tesztelésének betiltására tett erőfeszítéseiért.

Linus Pauling a 20.század egyik legbefolyásosabb kémikusa volt.
későbbi éveiben Pauling meggyőződött arról, hogy a C-vitamin nagy dózisai megakadályozzák a betegségeket, beleértve a közönséges hideget is. A legtöbb klinikai kutatás nem mutatott kapcsolatot, de Pauling továbbra is nagy adagokat vett be naponta. 1994-ben halt meg, miután egy életen át olyan tudományos örökséget hozott létre, amelyet kevesen fognak valaha egyenlővé tenni.
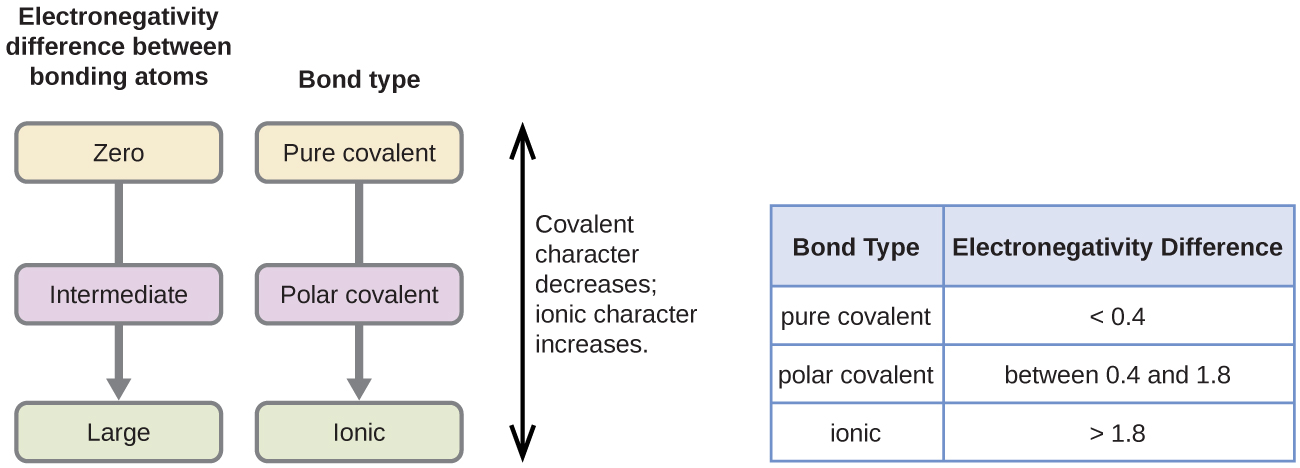
a kovalens kötés polaritása a kötést létrehozó két atom elektronegativitásának különbségének meghatározásával ítélhető meg. Minél nagyobb az elektronegativitás különbsége, annál nagyobb az elektronmegosztás egyensúlyhiánya a kötésben. Bár nincsenek kemény és gyors szabályok, az általános szabály az, ha az elektronegativitások különbsége kevesebb, mint 0.4, a kötés nempoláris; ha a különbség nagyobb, mint 0,4, a kötés polárisnak tekinthető. Ha az elektronegativitások különbsége elég nagy (általában nagyobb, mint körülbelül 1,8), akkor a kapott vegyületet inkább ionnak, mint kovalensnek tekintik. A nulla elektronegativitási különbség természetesen nem poláris kovalens kötést jelez.
Example \(\PageIndex{1}\)
írja le az egyes atompárok elektronegativitási különbségét és a kapott polaritást (vagy kötéstípust).
- C és H
- H és H
- Na és Cl
O és H
- a szén elektronegativitása 2,5, míg a hidrogén értéke 2,1. A különbség 0,4, ami meglehetősen kicsi. A C-H kötvényt ezért nempolárisnak tekintik.
- mindkét hidrogénatom azonos elektronegativitási értékkel rendelkezik-2.1. A különbség nulla, tehát a kötés nem poláris.
- a nátrium elektronegativitása 0,9, míg a klóré 3,0. A különbség 2,1, ami meglehetősen magas, így a nátrium és a klór Ionos vegyületet képez.
- a hidrogén esetében 2, 1, az oxigén esetében 3, 5, az elektronegativitási különbség 1, 4. Nagyon poláris kötődésre számítunk. Az elektronok O és H közötti megosztása egyenlőtlen az O felé erősebben húzott elektronokkal.
Exercise \ (\PageIndex{1}\)
írja le az egyes atompárok és a kapott polaritás (vagy kötéstípus) közötti elektronegativitási (EN) különbséget.
- C és O
- K és br
- Cs és F
N és N
válasz A:
az EN különbség 1,0 , tehát poláris. Az elektronok C és O közötti megosztása egyenlőtlen az O felé erősebben húzott elektronokkal.
válasz b:
az EN különbség nagyobb, mint 1,8, tehát Ionos.
válasz c:
azonos atomok nulla EN különbség, így nempoláris.
válasz d:
az EN különbség nagyobb, mint 1, 8, ezért Ionos.
Leave a Reply