4.4: egenskaber ved kovalente bindinger
elektronegativitet og Bindingspolaritet
selvom vi definerede kovalent binding som elektrondeling, deles elektronerne i en kovalent binding ikke altid ligeligt af de to bundne atomer. Medmindre bindingen forbinder to atomer af det samme element, som i H2, vil der altid være et atom, der tiltrækker elektronerne i bindingen stærkere end det andet atom gør, som i HCI, vist i figur \(\Sideindeks{1}\). En kovalent binding, der har en lige deling af elektroner (figur \(\Sideindeks{1a}\)) kaldes en ikke-polær kovalent binding. En kovalent binding, der har en ulige deling af elektroner, som i figur \(\Sideindeks{1b}\), kaldes en polær kovalent binding.

figur \(\Sideindeks{1}\) polære versus ikke-polære kovalente bindinger. (a) elektronerne i den kovalente binding deles ligeligt af begge hydrogenatomer. Dette er en ikke-polær kovalent binding. (B) kloratomet tiltrækker elektronerne i bindingen mere end hydrogenatomet gør, hvilket fører til en ubalance i elektronfordelingen. Dette er en polær kovalent binding.
fordelingen af elektrondensitet i en polær binding er ujævn. Det er større omkring atomet, der tiltrækker elektronerne mere end det andet. For eksempel bruger elektronerne i h–Cl-bindingen af et hydrogenchloridmolekyle mere tid nær chloratomet end nær hydrogenatomet. Bemærk, at det skraverede område omkring Cl i figur \(\Sideindeks{1B}\) er meget større, end det er omkring H.
denne ubalance i elektrondensitet resulterer i en opbygning af delvis negativ ladning (betegnet som KR−) på den ene side af bindingen (Cl) og en delvis positiv ladning (betegnet kr+) på den anden side af bindingen (H). Dette ses i figur \(\Sideindeks{2a}\). Adskillelsen af ladning i en polær kovalent binding resulterer i en elektrisk dipol (to poler), repræsenteret af pilen i figur \(\Sideindeks{2b}\). Pilens retning peges mod den røde ende, mens pilens + hale angiver den røde + ende af bindingen.
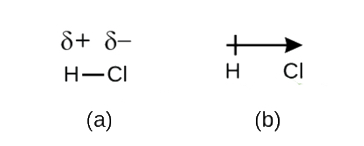
figur \(\Sideindeks{2}\): (A) ulige deling af bindingsparret af elektroner mellem H og Cl fører til delvis positiv ladning på h-atomet og delvis negativ ladning på Cl. Symbolerne RP+ og RP – angiver polariteten af H-Cl-bindingen. (B) dipolen er repræsenteret af en pil med et kryds ved halen. Korset er i nærheden af den største ende, og pilespidsen falder sammen med den største.
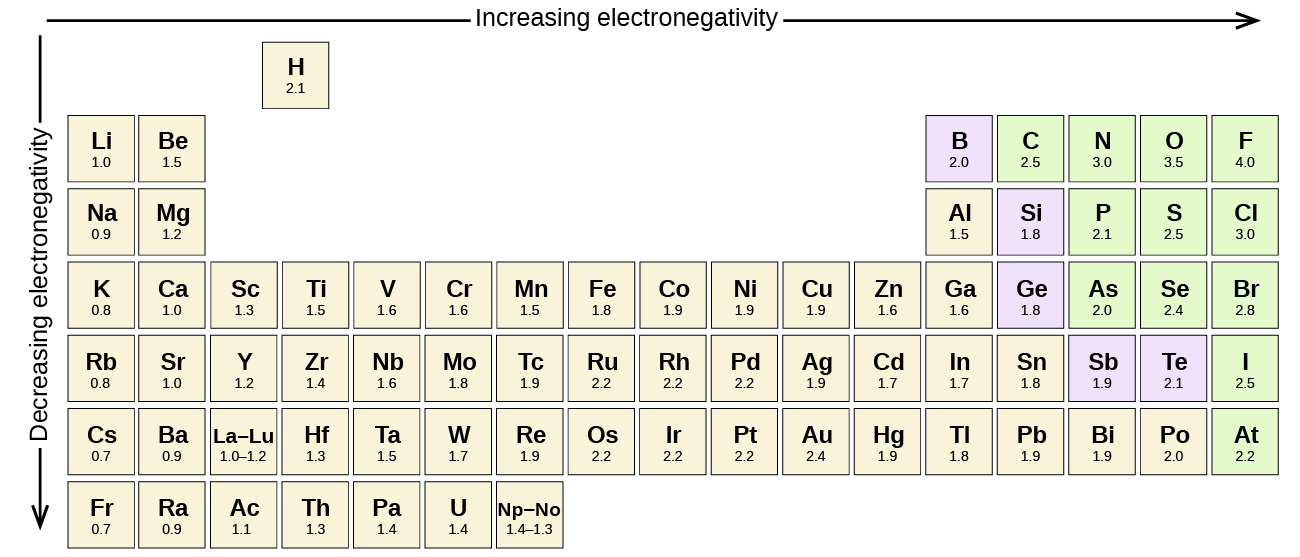
enhver kovalent binding mellem atomer af forskellige elementer er en polær binding, men graden af polaritet varierer meget. Nogle bindinger mellem forskellige elementer er kun minimalt polære, mens andre er stærkt polære. Ionbindinger kan betragtes som det ultimative i polaritet, hvor elektroner overføres snarere end deles. For at bedømme den relative polaritet af en kovalent binding bruger kemikere elektronegativitet, hvilket er et relativt mål for, hvor stærkt et atom tiltrækker elektroner, når det danner en kovalent binding. Der er forskellige numeriske skalaer til vurdering af elektronegativitet. Figur \(\Sideindeks{3}\) viser en af de mest populære—Pauling-skalaen.
ser nærmere: Linus Pauling er uden tvivl den mest indflydelsesrige kemiker i det 20.århundrede, Linus Pauling (1901-94) er den eneste person, der har vundet to individuelle (dvs. ikke-delte) Nobelpriser. I 1930 ‘ erne brugte Pauling nye matematiske teorier til at formulere nogle grundlæggende principper for den kemiske binding. Hans bog fra 1939 the nature of the Chemical Bond er en af de mest betydningsfulde bøger, der nogensinde er udgivet i kemi.i 1935 vendte Paulings interesse sig mod biologiske molekyler, og han blev tildelt Nobelprisen i kemi i 1954 for sit arbejde med proteinstruktur. Han var meget tæt på at opdage den dobbelte spiralstruktur af DNA, da James Crick og James Crick annoncerede deres egen opdagelse af sin struktur i 1953.) Han blev senere tildelt Nobels fredspris i 1962 for hans bestræbelser på at forbyde test af atomvåben.

Linus Pauling var en af de mest indflydelsesrige kemikere i det 20.århundrede.
i sine senere år blev Pauling overbevist om, at store doser C-vitamin ville forhindre sygdom, herunder forkølelse. De fleste kliniske undersøgelser viste ikke en forbindelse, men Pauling fortsatte med at tage store doser dagligt. Han døde i 1994 efter at have brugt et helt liv på at etablere en videnskabelig arv, som få nogensinde vil svare til.
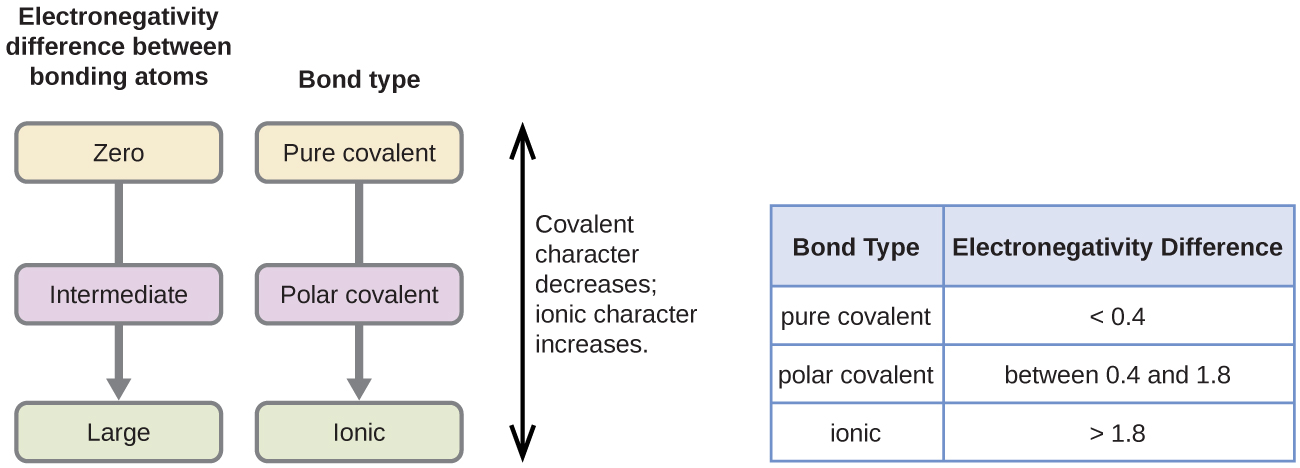
polariteten af en kovalent binding kan bedømmes ved at bestemme forskellen i elektronegativiteterne af de to atomer, der gør bindingen. Jo større forskellen i elektronegativiteter er, desto større er ubalancen af elektrondeling i bindingen. Selvom der ikke er nogen hårde og hurtige regler, er den generelle regel, hvis forskellen i elektronegativiteter er mindre end omkring 0.4 betragtes bindingen som ikke-polær; hvis forskellen er større end 0,4, betragtes bindingen som polær. Hvis forskellen i elektronegativiteter er stor nok (generelt større end ca.1,8), betragtes den resulterende forbindelse som ionisk snarere end kovalent. En elektronegativitetsforskel på nul indikerer naturligvis en ikke-polær kovalent binding.
eksempel \(\Sideindeks{1}\)
beskriv elektronegativitetsforskellen mellem hvert par atomer og den resulterende polaritet (eller bindingstype).
- C og H
- H og h
- Na og Cl
- O og H
opløsning
- kulstof har en elektronegativitet på 2,5, mens værdien for hydrogen er 2,1. Forskellen er 0,4, hvilket er ret lille. C – H-bindingen betragtes derfor som ikke-polær.
- begge hydrogenatomer har samme elektronegativitetsværdi-2.1. Forskellen er nul, så bindingen er ikke-polær.
- natriums elektronegativitet er 0,9, mens klor er 3,0. Forskellen er 2,1, hvilket er ret højt, og så danner natrium og chlor en ionisk forbindelse.
- med 2,1 for hydrogen og 3,5 for ilt er elektronegativitetsforskellen 1,4. Vi ville forvente en meget polær binding. Delingen af elektroner mellem O og H er ulige med elektronerne stærkere trukket mod O.
øvelse \(\Sideindeks{1}\)
beskriv elektronegativitetsforskellen (EN) mellem hvert par atomer og den resulterende polaritet (eller bindingstype).
- C og O
- K og Br
- N og N
- Cs og F
svar A:
En-forskellen er 1,0 , derfor polar. Delingen af elektroner mellem C og O er ulige med elektronerne stærkere trukket mod O.
svar b:
EN-Forskellen er større end 1,8, derfor ionisk.
svar c:
identiske atomer har nul en forskel, derfor ikke-polær.
svar d:
EN-Forskellen er større end 1,8, derfor ionisk.
Leave a Reply