4.4:共有結合の特性
電気陰性度と結合極性
共有結合を電子共有と定義しましたが、共有結合の電子は常に二つの結合原子によって等しく共有されるわけではありません。 結合がH2のように同じ元素の2つの原子を接続しない限り、図\(\PageIndex{1}\)に示すように、HClのように、結合中の電子を他の原子よりも強く引き付ける1つの原子が常に存在する。 電子の共有が等しい共有結合(図\(\PageIndex{1a}\))は、非極性共有結合と呼ばれます。 図\(\PageIndex{1b}\)のように、電子の不等な共有を持つ共有結合は、極性共有結合と呼ばれます。P>

図\(\PageIndex{1}\)極性対非極性共有結合。 (a)共有結合中の電子は、両方の水素原子によって均等に共有される。 これは非極性共有結合である。 (b)塩素原子は、水素原子よりも結合中の電子を引き付け、電子分布の不均衡につながる。 これは極性共有結合である。
極性結合中の電子密度の分布は不均一です。 それは他より電子をもっと引き付ける原子のまわりでより大きいです。 例えば、塩化水素分子のH–Cl結合中の電子は、水素原子の近くよりも塩素原子の近くでより多くの時間を費やす。 この電子密度の不均衡は、結合(Cl)の片側に部分的な負電荷(δ−と呼ばれる)が蓄積し、結合(H)の反対側に部分的な正電荷(δ+と呼ばれる)が蓄積する。
電子密度の不均衡は、結合(Cl)の一方の側に部分的な負電荷(δ+と呼ばれる)が蓄積する。 これは図\(\PageIndex{2a}\)に見られます。 極性共有結合における電荷の分離は、図\(\PageIndex{2b}\)の矢印で表される電気双極子(2つの極)をもたらす。 矢印の方向はδ端に向けられ、矢印の+尾部は結合のδ+端を示す。P>
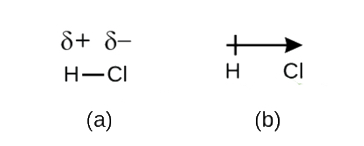
図\(\PageIndex{2}\):(a)HとClの間の電子の結合対の不等共有は、H原子上の部分的な正電荷とCl上の部分的な負電荷につながります。 記号δ+およびδ–は、H–Cl結合の極性を示す。 (b)双極子は、尾部に十字を持つ矢印で表されます。 十字はδ+の端の近くにあり、矢頭はδ–と一致する。
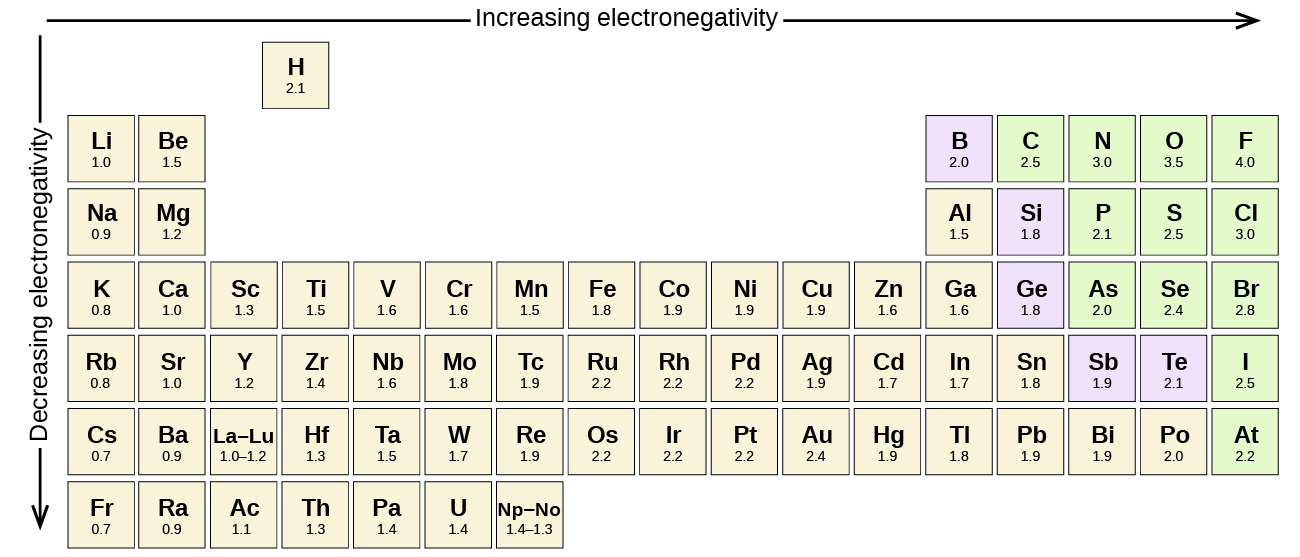
異なる要素の原子間の共有結合は極性結合ですが、極性の程度は大きく異なります。 異なる要素間のいくつかの結合は最小限にしか極性がありませんが、他のものは強く極性があります。 イオン結合は究極の極性と考えることができ、電子は共有されるのではなく転送されます。 共有結合の相対的な極性を判断するために、化学者は、それが共有結合を形成するときに原子が電子を引き付ける方法を強くの相対的な尺度であ 電気陰性度の評価には様々な数値スケールがあります。 Paulingスケール—図\(\PageIndex{3}\)は、最も人気のあるの一つを示しています。p>
より近い探して: ライナス-ポーリング
間違いなく20世紀の最も影響力のある化学者、ライナス-ポーリング(1901-94)は、二つの個人(つまり、共有されていない)ノーベル賞を受賞した唯一の人です。 1930年代、ポーリングは化学結合のいくつかの基本的な原理を明らかにするために新しい数学的理論を使用しました。 彼の1939年の著書”化学結合の性質”は、これまでに化学で出版された最も重要な本の一つです。1935年までに、ポーリングの関心は生物学的分子に変わり、彼はタンパク質構造に関する彼の研究のために1954年のノーベル化学賞を授与されました。 (彼は1953年にJames WatsonとJames Crickがその構造の発見を発表したとき、DNAの二重らせん構造を発見することに非常に近かった。 1962年には、核兵器の実験禁止に尽力した功績でノーベル平和賞を受賞している。

Linus Paulingは20世紀の最も影響力のある化学者の一人でした。
彼の晩年、ポーリングはビタミンCの大量投与は、一般的な風邪を含む病気を防ぐだろうと確信しました。 ほとんどの臨床研究は接続を示すことができませんでしたが、ポーリングは毎日大量の用量を服用し続けました。 彼は1994年に亡くなり、生涯を費やして科学的遺産を確立しました。共有結合の極性は、結合を作る2つの原子の電気陰性度の差を決定することによって判断することができる。
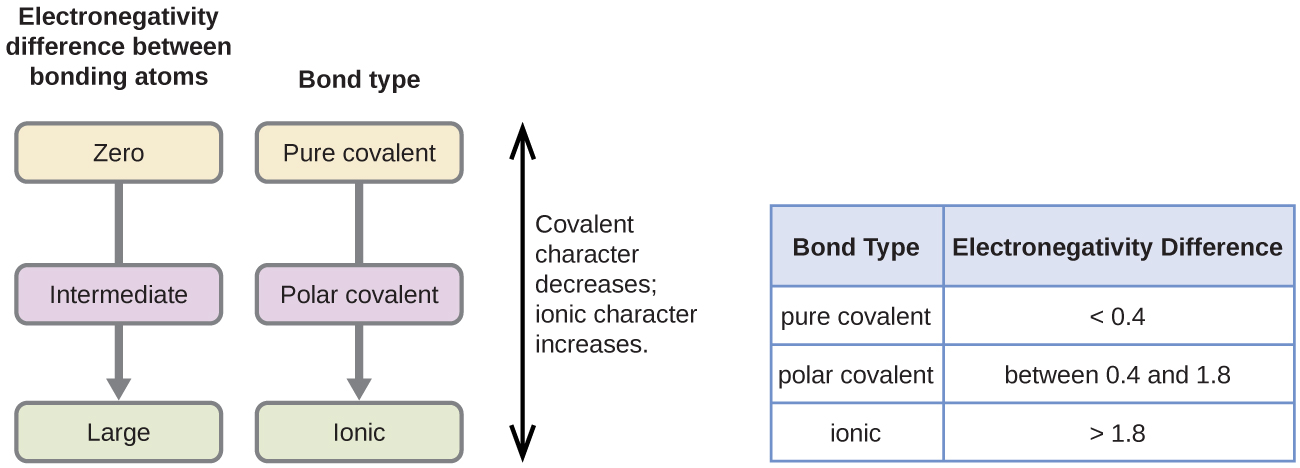
共有結合の極性は、結合を 電子陰性度の差が大きいほど、結合中の電子共有の不均衡が大きくなります。 ハードと高速のルールはありませんが、一般的なルールは、電気陰性度の差が約0未満である場合です。4つは、結束非極性考慮されます;相違が0.4より大きければ、結束は北極考慮されます。 電気陰性度の差が十分に大きい(一般に約1.8より大きい)場合、得られる化合物は共有結合ではなくイオン性であると考えられる。 ゼロの電気陰性度の差は、もちろん、非極性共有結合を示します。P>
例\(\PageIndex{1}\)
原子の各ペアと結果の極性(または結合タイプ)との間の電気陰性度の違いを説明します。
- CとH
- HとH
- NaとCl
- OとH
溶液
- 炭素は2.5の電気陰性度を 差は0.4であり、これはかなり小さい。 したがって、C-H結合は非極性であると考えられている。
- 両方の水素原子は同じ電気陰性度値を持っています—2.1。 差はゼロであるので、結合は非極性である。
- ナトリウムの電気陰性度は0.9であり、塩素は3.0である。 その差は2.1であり、これはかなり高いので、ナトリウムと塩素はイオン化合物を形成する。
- 水素の場合は2.1、酸素の場合は3.5で、電気陰性度の差は1.4です。 私たちは非常に極性の結合を期待します。 OとHの間の電子の共有は、より強くOに向かって描かれた電子と等しくありません。P>
原子の各ペアと結果の極性(または結合型)との間の電気陰性度(EN)差を記述します。
運動\(\PageIndex{1}\)
結果の極性(または結合型)との間の電
- CとO
- KとBr
- NとN
- CsとF
答えA:
ENの差は1.0であるため、極です。答えa:
ENの差は1.0であるため、極性があります。
ENの差は1.8よりも大きく、したがってイオン性です。
答えc:
同一の原子は、したがって、非極性、ゼロEN差を持っています。
答えC:
答えd:
ENの差は1.8より大きいため、ionicです。
div
Leave a Reply