4.4: egenskaper hos kovalenta bindningar
elektronegativitet och Bindningspolaritet
även om vi definierade kovalent bindning som elektrondelning delas elektronerna i en kovalent bindning inte alltid lika av de två bundna atomerna. Om inte bindningen förbinder två atomer av samma element, som i H2, kommer det alltid att finnas en atom som lockar elektronerna i bindningen starkare än den andra atomen gör, som i HCl, som visas i Figur \(\PageIndex{1}\). En kovalent bindning som har en lika fördelning av elektroner (figur \(\PageIndex{1a}\)) kallas en icke-polär kovalent bindning. En kovalent bindning som har en ojämn delning av elektroner, som i Figur \(\PageIndex{1b}\), kallas en polär kovalent bindning.

figur \(\PageIndex{1}\) polära kontra icke-polära kovalenta bindningar. (a) elektronerna i den kovalenta bindningen delas lika av båda väteatomerna. Detta är en icke-polär kovalent bindning. (B) kloratomen lockar elektronerna i bindningen mer än väteatomen gör, vilket leder till en obalans i elektronfördelningen. Detta är en polär kovalent bindning.
fördelningen av elektrondensitet i en polär bindning är ojämn. Det är större runt atomen som lockar elektronerna mer än den andra. Till exempel spenderar elektronerna i h–Cl-bindningen av en vätekloridmolekyl mer tid nära kloratomen än nära väteatomen. Observera att det skuggade området runt Cl i Figur \(\PageIndex{1b}\) är mycket större än det är runt H.
denna obalans i elektrondensitet resulterar i en uppbyggnad av partiell negativ laddning (betecknad som bisexuell−) på ena sidan av bindningen (Cl) och en partiell positiv laddning (betecknad Bisexuell+) på andra sidan av bindningen (H). Detta ses i Figur \(\PageIndex{2a}\). Separationen av laddning i en polär kovalent bindning resulterar i en elektrisk dipol (två poler), representerad av pilen i Figur \(\PageIndex{2b}\). Pilens riktning pekas mot slutet av den bakre änden medan pilens + – svans indikerar slutet på bindningen av den bakre änden av den bakre änden av bindningen.
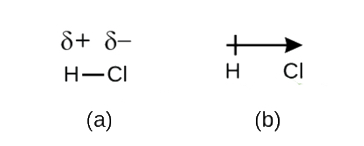
figur \(\PageIndex{2}\): (a) ojämn delning av bindningsparet av elektroner mellan H och Cl leder till partiell positiv laddning på H-atomen och partiell negativ laddning på Cl. Symboler för + och Cl-indikerar polariteten hos H-CL-bindningen. (b) dipolen representeras av en pil med ett kors i svansen. Korset är nära slutet av + och pilspetsen sammanfaller med slutet av–.
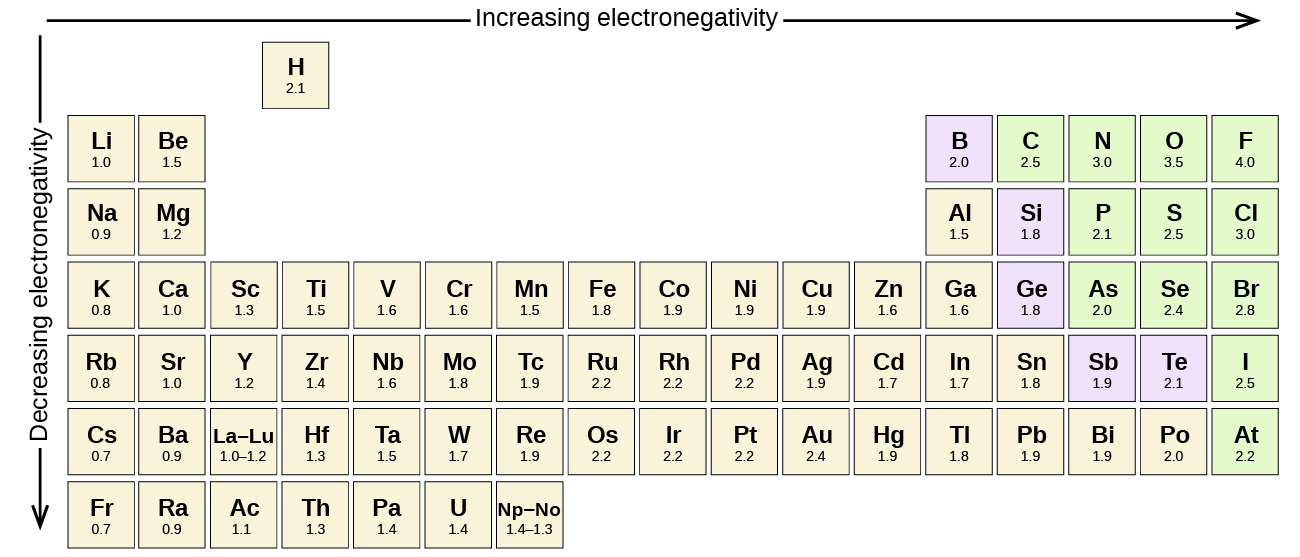
varje kovalent bindning mellan atomer av olika element är en polär bindning, men polaritetsgraden varierar mycket. Vissa bindningar mellan olika element är endast minimalt polära, medan andra är starkt polära. Joniska bindningar kan betraktas som den ultimata polariteten, med elektroner som överförs snarare än delas. För att bedöma den relativa polariteten hos en kovalent bindning använder kemister elektronegativitet, vilket är ett relativt mått på hur starkt en atom lockar elektroner när den bildar en kovalent bindning. Det finns olika numeriska skalor för betyg elektronegativitet. Figur \(\PageIndex{3}\) visar en av de mest populära—Pauling-skalan.
tittar närmare: Linus Pauling
förmodligen den mest inflytelserika kemisten i 20-talet, Linus Pauling (1901-94) är den enda personen som har vunnit två individuella (det vill säga odelade) Nobelpriser. På 1930-talet använde Pauling nya matematiska teorier för att förklara några grundläggande principer för den kemiska bindningen. Hans bok från 1939 the Nature of the Chemical Bond är en av de viktigaste böckerna som någonsin publicerats i kemi.år 1935 vände sig Paulings intresse till biologiska molekyler, och han tilldelades Nobelpriset i kemi 1954 för sitt arbete med proteinstruktur. (Han var mycket nära att upptäcka DNA: s dubbla helixstruktur när James Watson och James Crick tillkännagav sin egen upptäckt av sin struktur 1953.) Han tilldelades senare Nobels fredspris 1962 för sina ansträngningar att förbjuda testning av kärnvapen.

Linus Pauling var en av de mest inflytelserika kemisterna från 20-talet.
under sina senare år blev Pauling övertygad om att stora doser C-vitamin skulle förhindra sjukdom, inklusive förkylning. De flesta kliniska undersökningar misslyckades med att visa en koppling, men Pauling fortsatte att ta stora doser dagligen. Han dog 1994, efter att ha tillbringat en livstid med att skapa ett vetenskapligt arv som få någonsin kommer att vara lika.
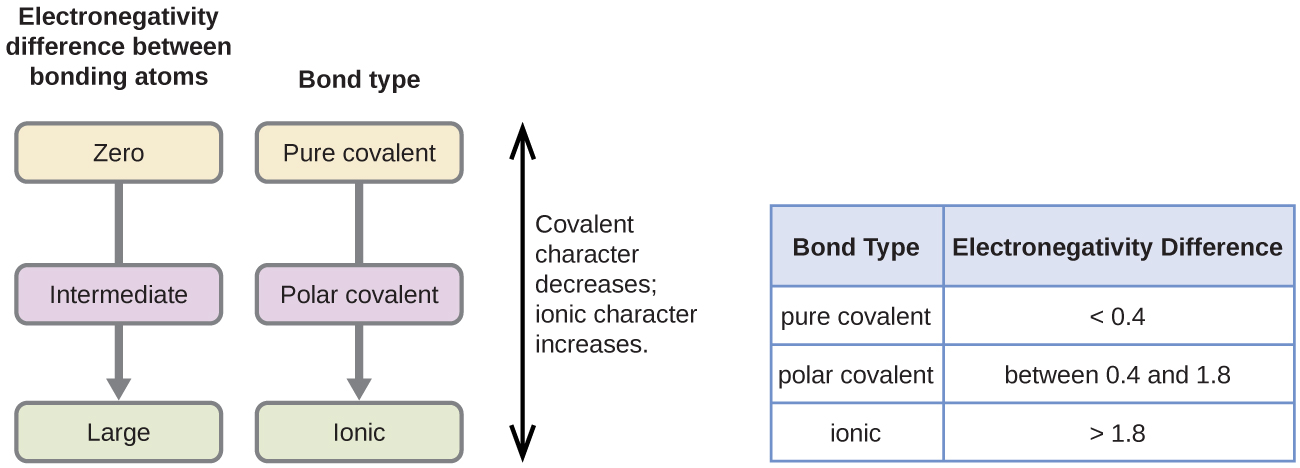
polariteten hos en kovalent bindning kan bedömas genom att bestämma skillnaden i elektronegativiteterna hos de två atomerna som gör bindningen. Ju större skillnad i elektronegativiteter, desto större obalans av elektrondelning i bindningen. Även om det inte finns några hårda och snabba regler, den allmänna regeln är om skillnaden i elektronegativiteter är mindre än ca 0.4, bindningen anses vara icke-polär; om skillnaden är större än 0,4 anses bindningen vara polär. Om skillnaden i elektronegativiteter är tillräckligt stor (i allmänhet större än ca 1,8) anses den resulterande föreningen vara jonisk snarare än kovalent. En elektronegativitetsskillnad på noll indikerar naturligtvis en icke-polär kovalent bindning.
exempel \(\PageIndex{1}\)
beskriv elektronegativitetsskillnaden mellan varje par atomer och den resulterande polariteten (eller bindningstypen).
- C och H
- H och H
- Na och Cl
- O och h
lösning
- kol har en elektronegativitet på 2,5, medan värdet för väte är 2,1. Skillnaden är 0,4, vilket är ganska liten. C-H-bindningen anses därför vara icke-polär.
- båda väteatomerna har samma elektronegativitetsvärde-2,1. Skillnaden är noll, så bindningen är icke-polär.
- natriums elektronegativitet är 0,9, medan klor är 3,0. Skillnaden är 2,1, vilket är ganska högt, och så bildar natrium och klor en jonisk förening.
- med 2.1 för väte och 3.5 för syre är elektronegativitetsskillnaden 1.4. Vi förväntar oss ett mycket polärt band. Fördelningen av elektroner mellan O och H är ojämn med elektronerna starkare dras mot O.
övning \(\PageIndex{1}\)
beskriv elektronegativiteten (EN) skillnaden mellan varje par atomer och den resulterande polariteten (eller bindningstypen).
- C och O
- K och Br
- n och n
- Cs och F
svar a:
EN-skillnaden är 1,0 , därav polär. Delningen av elektroner mellan C och O är ojämn med elektronerna starkare dras mot O.
svar b:
EN-skillnaden är större än 1,8, därav jonisk.
svar c:
identiska atomer har noll EN skillnad, följaktligen icke-polär.
svar d:
EN-skillnaden är större än 1,8, därav jonisk.
Leave a Reply